隐丹参酮对宫颈鳞癌Siha细胞增殖及凋亡影响机制的研究
徐豪杰,周建超,杨文辉
(郑州大学第三附属医院药学部,河南 郑州 450052)
丹参具有活血、调经、止痛、祛瘀等功效。研究[1-2]显示,丹参中含有数百种化学成分,主要分为水溶性的酚酸类和脂溶性的丹参酮类。丹参酮类是丹参的特征性成分之一,包括丹参酮ⅡA、隐丹参酮、二氢丹参酮Ⅰ、丹参酮Ⅰ等多种。其中丹参酮ⅡA和丹酚酸B被选为国家药典中丹参质量控制的指标性成分,具有明显的心血管保护作用。研究[3]发现,丹参酮ⅡA、隐丹参酮、丹参酮Ⅰ、二氢丹参酮I等多种丹参酮类均具有抗肿瘤活性。目前关于隐丹参酮的研究较少,本实验主要研究隐丹参酮对宫颈鳞癌Siha细胞的细胞毒性作用的影响,初步探讨其抗肿瘤作用的具体机制。
1 材料与方法
1.1 实验材料宫颈鳞癌细胞株Siha,由北京协和医学院细胞中心提供;隐丹参酮,由中国食品药品检定研究院提供,纯度为98%。
试剂与仪器:高糖型DMEM培养基,美国Gibco公司;四氮唑噻唑蓝(MTT),上海生物工程有限公司;牛血清,美国Gibco公司;鼠抗人E6、P53、P21、甘油醛-3-磷酸脱氢酶(GAPDH)单抗,美国Santa Cruz公司;其他试剂均为国产分析纯。CO2培养箱,美国Thermo Fisher Scientific公司;LX-800型酶联免疫检测仪,日本Epson公司;倒置显微镜,日本Olympus公司;凝胶成像分析仪,瑞典Pharmacia公司;流式细胞仪,美国BD公司。
1.2 实验方法
1.2.1 细胞培养 Siha细胞常规培养在含体积分数10%胎牛血清的高糖型DMEM培养基中,培养条件为37 ℃、体积分数5% CO2及相对饱和湿度。孵育2~3 d后用质量分数0.25%胰蛋白酶消化传代,选对数生长期的Shia细胞进行试验。
1.2.2 MTT法测定隐丹参酮对Siha细胞的抑制作用 选取对数生长期的Shia细胞,用质量分数0.25%胰蛋白酶消化,磷酸盐缓冲液洗涤2次,加无血清DMEM培养基,以细胞浓度3×103个/孔接种于96孔板,每孔培养基总体积为200 μL;空白对照组给予相同体积的磷酸盐缓冲液;给药组分别加入不同浓度的隐丹参酮(0.1、1、5、10、100 μmol·L-1),每个浓度设6个复孔。分别培养4、8、12、16、20、24 h后,加入5 g·L-1的MTT(20 μL/孔)4 h后,吸去上清加入DMSO 150 μL/孔,微型震荡器震荡10 min,使其完全混匀溶解结晶,在酶标仪上于492 nm处测吸光度,每个浓度设平行重复6孔,实验重复3次。按以下公式计算抑制率,拟合后求IC50值。细胞增殖抑制率=(1-A试验组/A对照组)×100%。
1.2.3 细胞周期及凋亡的测定 取对数期生长的Siha细胞以1.0×105个/mL的细胞浓度接种于6孔板,分别设有空白对照组、给药组(12、24、36、48 h);隐丹参酮给药浓度为(1、10、25 μmol·L-1);空白对照组给予相同体积的磷酸盐缓冲液。培养24 h后,胰蛋白酶消化,离心(1 000 r·min-1,5 min),磷酸盐缓冲液洗涤2次,用体积分数70%冷乙醇使细胞悬浮固定,置于4 ℃冰箱中保存30 min,-20 ℃过夜。经核糖核酸酶消化,碘化丙啶染色,4 ℃避光染30 min后流式细胞仪监测分析,重复实验3次。2 h内流式细胞仪检测细胞周期分布,计算细胞增殖指数[(S+G2/M)/(G0/G1+S+G2/M)×100%]。
1.2.4 Western blot法检测细胞蛋白 隐丹参酮给药后,收集对数生长的Siha细胞,加入细胞裂解液,冰上放置15 min, 12 000 r·min-1离心15 min,取上清,以Bradford法作蛋白定量后置-80 ℃贮存备用。灌制质量分数10% SDS-聚丙烯酰胺凝胶,常规电泳、转膜、封闭。一抗(1500),4 ℃孵育过夜,二抗(15 000),室温孵育2 h,增强化学发光法显色。GAPDH检测作为内对照,进行细胞间蛋白表达的比较。
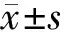
2 结果
2.1 隐丹参酮对Siha细胞增殖的抑制作用不同浓度(0.1、1、5、10、100 μmol·L-1)的隐丹参酮给药4、8、12、16、20、24 h后, 对Siha细胞的生长呈明显抑制作用。不同浓度(0、1、1、5、10、100 μmol·L-1)的隐丹参酮对Siha细胞的细胞毒性作用有明显剂量和时间依赖性。见图1。
2.2 隐丹参酮对Siha细胞的细胞周期及早期凋亡的影响与空白对照组比较,各给药组Siha细胞生长产生G0/G1期阻滞,S期所占比例随给药时间的延长不断减少,且随着给药时间的增加抑制作用更加明显。见图2。
图1 不同浓度隐丹参酮作用不同时间后对Siha细胞的抑制作用

图2 不同浓度隐丹参酮作用不同时间后Siha细胞生长周期变化
2.3 隐丹参酮对Siha细胞的相关蛋白表达的影响随着隐丹参酮(25 μmol·L-1)作用时间的延长,Siha细胞E6蛋白水平表达逐渐降低,P53和P21的蛋白水平表达逐渐升高。见图3。
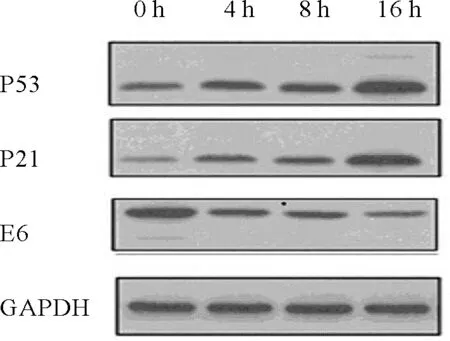
图3 隐丹参酮(25 μmol·L-1)作用不同时间后Siha细胞相关蛋白表达情况
3 讨论
宫颈癌是常见的妇科恶性肿瘤之一,发展中国家的发病率及其导致的死亡率均高于发达国家[4]。与其他恶性肿瘤比较,宫颈癌多发病于中年女性[5],一旦患病给患者及其家庭带来极大痛苦和威胁。
隐丹参酮属于丹参的脂溶性成分,具有菲醌结构,其中菲环结构可与DNA结合,而呋喃环和醌类结构可产生自由基,引起DNA损伤,从而抑制肿瘤细胞DNA合成[6]。丹参酮通过抑制抗增殖细胞核抗原和细胞增殖相关的基因表达发挥抗肿瘤作用[7]。
细胞凋亡与肿瘤发生、发展有密切关系,部分抗肿瘤药物作用的强弱与其诱导肿瘤细胞凋亡的活性呈正比。诱导肿瘤细胞凋亡成为抗肿瘤药物研发的新思路,以及评价疗效的新指标[8]。有研究[9]认为大多化疗药物可以引起肿瘤细胞特定靶成分的损伤或功能丧失,从而引起细胞周期阻滞及进入细胞凋亡。
目前,许多分化诱导剂能抑制肿瘤细胞生长,诱导其分化,这主要是由某些癌基因及抑癌基因的表达抑制、失活和活化所致,其作用机制可能是通过抑制细胞原癌基因、诱导抑癌基因的表达,阻滞细胞进入S期及其DNA合成,从而诱导肿瘤细胞分化[10]。本实验通过MTT法研究发现,不同浓度的隐丹参酮对Siha细胞的细胞毒性作用有明显剂量和时间依赖性;流式细胞仪检查表明,隐丹参酮对Siha细胞的细胞周期有明显的阻滞,在抑制Siha细胞增殖的同时,可以诱导细胞周期阻滞在G0/G1期,降低S期细胞比例,减慢肿瘤细胞的增殖速度,抑制DNA的合成并加速诱导细胞凋亡。DNA损伤后,P53或Mdm-2磷酸化,从而上调P21表达,导致细胞周期阻滞,进而促进DNA修复或细胞凋亡[11]。感染了人乳头瘤病毒(HPV)的宫颈癌细胞中P53的降解是通过E6蛋白介导的泛素化途径来实现的,正常P53功能被E6蛋白所破坏[12]。P21基因是P53的效应基因。本研究发现,隐丹参酮能够显著抑制HPV E6蛋白水平的表达,同时Western blot法发现P53蛋白表达增加,进而诱导其下游的P21蛋白表达增加。
综上所述,隐丹参酮能明显抑制宫颈鳞癌Siha细胞的增殖,这与其抑制HPV E6蛋白的表达,使P53和P21的蛋白表达逐渐升高,P53功能恢复并启动凋亡,从而诱导Siha细胞凋亡有关。但其具体作用机制还需进一步的研究证实。

