过敏性紫癜患儿实验室检测指标的临床价值分析
郑丽娟, 于静, 李小芹, 王向辉
过敏性紫癜又称亨诺-许兰紫癜(Henoch-Schonlein purpura,HSP),是一种侵犯皮肤和其他器官的全身性小血管炎,主要表现为皮肤紫癜,可伴有或不伴有腹痛、关节痛、肾损害。多数患儿呈自限性,预后良好,但仍有一部分患儿合并严重的胃肠道、肾脏或其他脏器损伤。以消化道症状为主要表现的为腹型过敏性紫癜,占51%~74%,临床表现为恶心、呕吐、腹痛、黑便或便血等[1]。腹痛多为弥漫性,类似于肠绞痛[2]。以消化道症状为首发的过敏性紫癜患儿,皮疹出现迟于消化道症状,故容易被误诊,国内一篇文献报道[3],误诊率达47.1%,误诊原因常见的有急性胃肠炎、阑尾炎、胆道疾病、消化道溃疡等,甚至一部分患儿因误诊行剖腹探查。因此,积极寻找提示过敏性紫癜的一些实验室检测指标,对临床疑似过敏性紫癜而皮肤未出现紫癜的患儿尽早行胃肠镜检查,有利于以消化道症状为首发的过敏性紫癜患儿的早期诊断。
1 资料与方法
1.1 临床资料 选择2016年6月至2018年6月在我院住院的HSP患儿80例,其中以消化道症状为首发的患儿40例,为消化道首发组,其中男20例,女20例;年龄3~12岁,平均(6.20±2.08)岁。以皮肤紫癜为首发症状的患儿40例,为皮肤紫癜首发组,其中男20例,女20例;年龄4~11岁,平均(6.65±2.05)岁。同期选取本院急性胃肠炎患儿40例,其中男20例,女20例;年龄2~10岁,平均(5.88±1.92)岁。3组患儿在年龄、性别方面比较差异无统计学意义(P<0.05)。
1.2 诊断标准 参照《儿科学》第8版中过敏性紫癜的诊断标准[4]。
1.3 纳入标准 (1)符合过敏性紫癜的诊断标准;(2)年龄2~12岁;(3)患儿家属知情同意。
1.4 排除标准 (1)慢性胃炎、炎症性肠病、肾炎、肾病综合征、慢性肾病、结缔组织病、心血管疾病、哮喘、过敏性鼻炎、糖尿病;(2)确诊紫癜性肾炎且需应用大剂量激素或免疫抑制剂的患儿;(3)近1个月患呼吸道感染患儿。(4)近1个月有应用糖皮质激素、免疫抑制剂或调节剂病史的患儿。
1.5 方法
1.5.1 标本采集 入院后第2天空腹抽血检测血常规、淋巴细胞亚群、免疫功能及补体C3、C4、IgE、D-二聚体,留取晨尿检测尿微量白蛋白。
1.5.2 指标检测 (1)血常规:日本全自动血细胞分析仪检测;(2)免疫功能+补体C3、C4:免疫比浊法,试剂由宁波瑞源生物科技有限公司提供;(3)淋巴细胞亚群:流式细胞仪检测,试剂由美国BD公司提供,应用BD FACSDiava软件分析结果;(4)IgE:电化学发光法,试剂由罗氏诊断产品(上海)有限公司提供;(5)D-二聚体:免疫比浊法,试剂由沃芬医疗器械商贸(北京)有限公司提供;(6)尿微量白蛋白:免疫比浊法,试剂由宁波瑞源生物科技有限公司提供。
2 结果
3组患儿的IgG、IgM、补体C3、补体C4、血小板比较,差异无统计学意义(P>0.05)。消化道首发组与皮肤紫癜首发组HSP患儿的IgA、D-二聚体、CD8+、CD19+、尿微量白蛋白均高于急性胃肠炎组,CD3+、CD4+、CD4+/CD8+均低于急性胃肠炎组,差异有统计学意义(P<0.05);消化道首发组与皮肤紫癜首发组HSP患儿的IgA、D-二聚体、CD8+、CD19+、尿微量白蛋白、CD3+、CD4+、CD4+/CD8+比较,差异无统计学意义(P>0.05)。皮肤紫癜首发组HSP患儿的IgE高于消化道症状首发组及急性胃肠炎组,差异有统计学意义(P<0.05);消化道首发组与急性胃肠炎组IgE比较差异无统计学意义(P>0.05)。见表1。
3 讨论
过敏性紫癜是一种累及毛细血管及细小动脉的白细胞碎裂性血管炎[5],关于其确切的发病机制,尚未研究十分清楚,多认为是遗传易感性、环境因素、免疫紊乱等综合作用的结果[6]。越来越多的研究发现,HSP患儿存在体液与细胞免疫功能紊乱[7-10]。目前研究多倾向于IgA1分子异常糖基化造成含IgA1的免疫复合物在各脏器毛细血管,引起小血管炎的学说[11]。本研究结果显示,以消化道症状为首发的HSP组患儿与以皮肤紫癜为首发的HSP组患儿的IgA均高于急性胃肠炎组,差异有统计学意义(P<0.05)。而两组紫癜患儿的IgA差异无统计学意义(P>0.05)。IgA可能是通过与抗内皮细胞抗体结合形成复合物,然后通过抗体依赖性细胞毒性途径,产生活性氧以及形成中性粒细胞胞外诱捕网在内的炎症过程,从而造成血管损伤。本研究还发现,以皮肤紫癜为首发症状的HSP组患儿的IgE高于以消化道症状为首发的HSP组及急性胃肠炎组患儿(P<0.05)。IgE是介导Ⅰ型变态反应的抗体,Ⅰ型变态反应主要参与了以皮肤紫癜为主的HSP患儿的发病,故IgE对以消化道症状为首发的HSP患儿的提示意义不大。
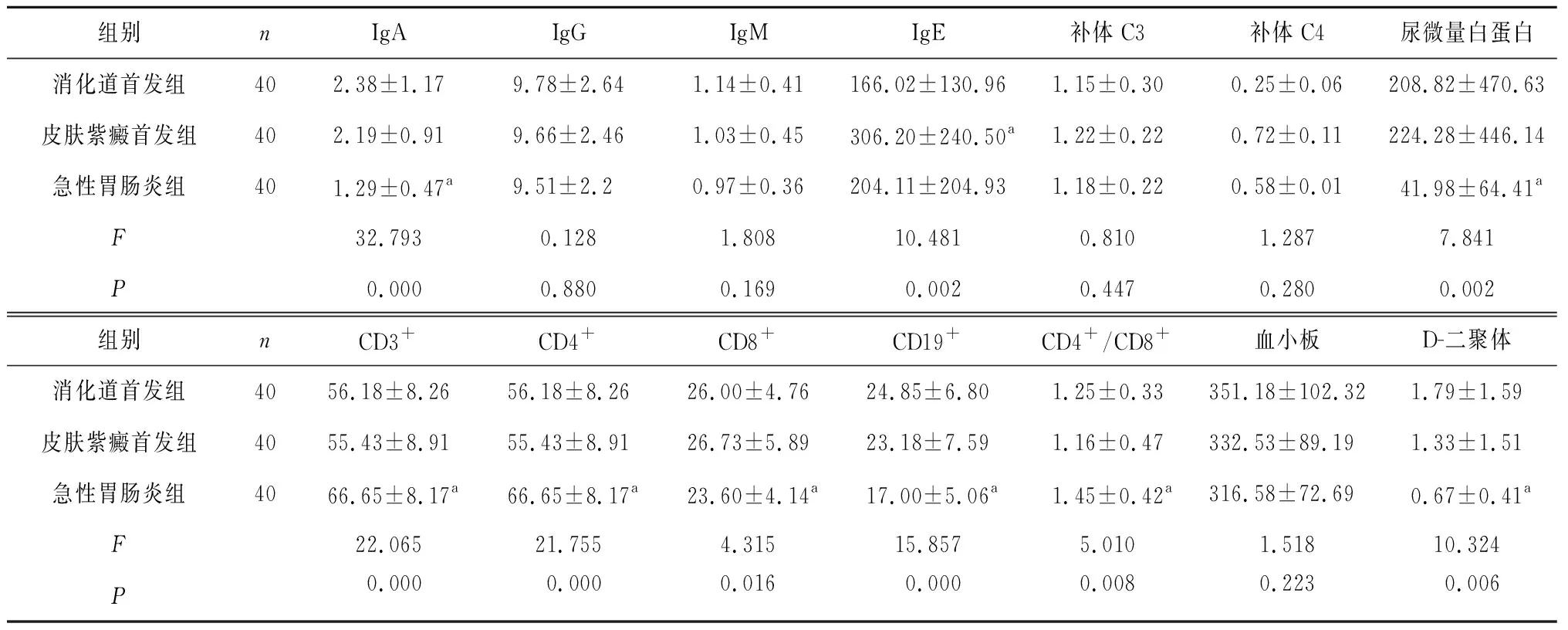
表1 三组患儿实验室检测指标比较
注:与其他两组比较,aP<0.05。
本研究结果显示,以消化道症状为首发的HSP组患儿和以皮肤紫癜为首发的HSP组患儿的CD3+、CD4+、CD4+/CD8+均低于急性胃肠炎组患儿,而CD8+、CD19+均高于急性胃肠炎患儿,差异有统计学意义(P<0.05)。根据细胞表面抗原的不同将T淋巴细胞CD3+分为CD4+和CD8+T细胞,根据功能不同将T淋巴细胞分为辅助(Th),抑制(Ts)和细胞毒性T细胞(Tc),CD4+分子存在于Th细胞表面,CD8+分子存在于TS和Tc细胞表面。CD19+是B淋巴细胞的标志。Th细胞进一步可分为Th1、Th2细胞,研究发现Th2过度活化与HSP的发病有关[12]。Th2活化后可诱导B细胞转化为浆细胞,导致体液免疫占优势,从而产生大量的免疫球蛋白,进而形成免疫复合物,进一步激活补体引发血管炎。综上所述,HSP患儿体内存在细胞免疫功能减低及失衡,体液免疫占优势。
本研究结果显示,两组紫癜患儿的D-二聚体水平均高于急性胃肠炎组患儿(P<0.05),但两组紫癜患儿的D-二聚体水平无明显差异(P>0.05),与朱玲玲等[13]的研究一致。HSP患儿存在继发性纤溶亢进,可能为免疫复合物沉积损伤血管内皮细胞,激活纤溶系统,从而使D-二聚体水平升高。本研究结果表明,两组过敏性紫癜患儿的尿微量白蛋白均高于急性胃肠炎患儿(P<0.05),而两组紫癜患儿的尿微量白蛋白无明显差异(P>0.05),与邢二庆[14]的研究结果一致。与急性胃肠炎发病机制不同,HSP系全身性小血管炎,免疫复合物沉积于肾脏,从而使肾小球滤过膜受损,造成尿微量白蛋白增加。
综上所述,以消化道症状为首发的HSP患儿在皮疹出现之前容易误诊,联合检测血IgA、淋巴细胞亚群、D-二聚体、尿微量白蛋白有助于以消化道为首发的HSP患儿的早期诊断。

