基于乳腺癌耐药蛋白介导的中药-化学药物相互作用研究*
吴玲娜,詹 涛,夏春华
(南昌大学临床药理研究所 南昌 330006)
乳腺癌耐药蛋白(Breast Cancer Resistance Protein,BCRP)是一种重要的外排转运体,主要通过将各种外来毒性物质和内源性底物泵出细胞起到保护机体的作用。中药在我国使用历史悠久,在现代临床治疗中也广泛应用,有着不可或缺的地位。临床上许多药物包括中药组分为BCRP的底物或抑制剂,当它们联合使用时,将影响或改变联用药物的药代动力学,甚至导致严重的药物不良反应。如联合使用BCRP抑制剂GF120918能显著提高托泊替康在癌症患者中的口服生物利用度(从40%提高到97%)[1],有学者采用PBPK模型发现瑞舒伐他汀和替米沙坦联合应用可显著增加瑞舒伐他汀的体内暴露量,而位于肠道的外排转运体BCRP是导致此相互作用的主要原因[2]。相对于研究颇多的由BCRP介导的西药联合应用所发生的药物-药物相互作用,本文将对基于BCRP介导的中药-化学药物相互作用的研究进展加以综述并介绍BCRP的来源、结构、底物、抑制剂,以期为临床合理联合用药提供参考依据。
1 BCRP的简介
乳腺癌耐药蛋白(BCRP)是ABC转运蛋白超家族G亚家族蛋白的第二成员,因此使用HUGO命名法将基因符号ABCG2分配给BCRP。BCRP是一个半ABC转运体,有着独特的结构特征,包括只有一个核苷结合域(Nucleotide-binding domains,NBD)和一个膜跨域(Membrane-spanning domain,MSD),且 BCRP中的NBD先于MSD[3](图1)。结构的不同意味着其在转运机制上可能与P-糖蛋白(P-glycoprotein,P-gp)和多药耐药相关蛋白(Multifigure resistance-associated protein,MRP)有很大的不同。BCRP作为一种保护性外排泵主要分布于胎盘屏障、血脑屏障、血睾屏障、血视网膜屏障[4,5],在参与体内药物处置过程的器官中均显著表达。BCRP的组织分布存在种属差异。例如,BCRP在人肾脏中表达较少,而小鼠Bcrp1在小鼠肾脏中表达丰富[6]。
BCRP具有广泛的底物,包括生理化合物尿酸、磷酸化的核苷和核苷酸;化疗药物如米托蒽醌、喜树碱衍生物、甲氨蝶呤及酪氨酸激酶抑制剂伊马替尼、吉非替尼和尼罗替尼;其他药物如哌唑嗪、格列本脲、西咪替丁、拉米夫定、磺胺嘧啶和瑞舒伐他汀等[7,8]。总的来说,BCRP具有很广泛的底物特异性,基本重叠但又不同于P-gp或MRP。至今发现数百种BCRP抑制剂,主要是通过抑制其ATP酶活性、与底物发生竞争性抑制或在特定的结合位点抑制特定底物的外排等发挥作用。包括经典的FTC及FTC类似物Ko132、Ko134和Ko143[9],人们日常饮食中的黄酮类白杨素鹰和嘴豆芽素A等[10]。酪氨酸激酶抑制剂如伊马替尼、尼洛替尼不仅是BCRP的底物也是抑制剂[11]。此外,有人通过合成白藜芦醇、查尔酮等多种已知BCRP抑制剂的衍生物开发出高效和高度特异性的BCRP抑制剂[12]。BCRP抑制剂的开发是当今研究的一个热点,对于逆转肿瘤多药耐药有着非常迫切的意义。
2 常见中药及其成分对BCRP的影响及其介导的相互作用
2.1 银杏主要成分对BCRP的影响
银杏叶提取物中的主要活性成分包括:黄酮、萜内酯及有机酸。其中含量最多的是黄酮类,包括山奈酚、槲皮素、染料木素等。临床上常用于心脑血管疾病、呼吸系统疾病等的治疗。大量研究显示黄酮类化合物可影响BCRP的转运活性[13]。An等[14]发现山奈酚显著抑制BCRP介导的槲皮素外排。槲皮素是BCRP的一种底物,而山奈酚既是P-gp的底物,也是BCRP的底物和抑制剂。山奈酚可能通过竞争性或非竞争性抑制BCRP介导的槲皮素外排。另有研究显示,两种黄酮类化合物联用比单独一种对药物生物利用度影响更大。如鹰嘴豆芽素A与槲皮素和EGCG联合使用时,其静脉和口服曲线下面积均显著增加[15]。提示黄酮类化合物的组合使用可通过BCRP等外排转运体相互作用影响其生物利用度。Kristin等[16]研究显示,染料木素可以抑制由BCRP介导的格列苯脲的外排,而黄酮类也存在于许多食物中,因此妊娠糖尿病人应当注意该类物质的摄入以免影响药效。
2.2 姜黄主要成分对BCRP的影响
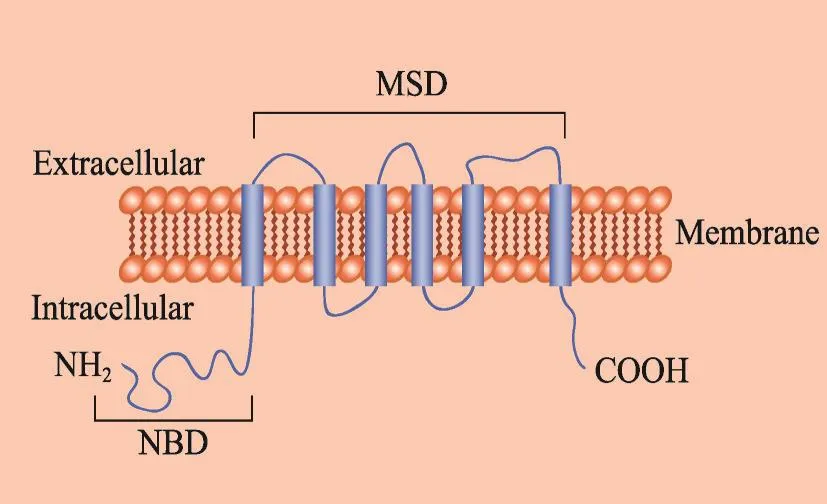
图1 BCRP结构示意图
姜黄素是从姜黄根茎中提取的多酚类化合物,具有预防和治疗多种疾病的价值,如抗氧化、抗炎、抗肿瘤等[17]。由于其具有多种治疗作用,姜黄素也是研究最广泛的化合物,但姜黄素生物利用度低、组织分布受限、半衰期短等问题限制了其临床应用。
许多研究显示,相对于主要外排转运体P-gp和MRP1,姜黄素与BCRP的相互作用更为紧密。Karibe等[18]采用磺胺嘧啶和瑞舒伐他汀作为底物,验证了姜黄素对食蟹猴胃肠道BCRP功能的抑制作用。结果显示,姜黄素预处理后显著提高磺胺嘧啶和瑞舒伐他汀的口服AUC、Cmax和生物利用度。而Liu等[19]研究显示姜黄素与短杆菌肽或乌本苷联合使用可显著降低过表达BCRP细胞内的ATP水平,导致ATP水平低于生存所需阈值,并选择性地杀死这些产生多药耐药的细胞。同时,姜黄素作用于多种信号通路如NF-κB STAT3,Nrf2,ROS和COX-2等,但其可能是通过作用于AHR信号通路对BCRP进行调控[20]。综上所述,姜黄素是一种很有应用前景的体内选择性抑制BCRP的候选药物,在逆转BCRP介导的肿瘤多药耐药上也有良好疗效。但是目前研究的着重点在于如何提高姜黄素的生物利用度以取得更好的临床治疗效果。研究人员也采用了多种方法,如优化姜黄素结构,开发出高效衍生物,改变剂型制备为纳米制剂,以及与其他药物联合使用阻断其代谢等。Shukla等[21]就发现当与麦角醇合用时,姜黄素的生物利用度可大幅度提高,其主要原因则是代谢酶和BCRP的抑制作用。
2.3 甘草主要成分对BCRP的影响
甘草主要有效成分包括甘草酸、甘草次酸及黄酮类等。其最大的特点是调和药性,有“无草不成方”之说。临床常应用于白癜风、麻疹、玫瑰糠疹及新生儿肝炎等[22]。
甘草常与大黄,芒硝组成方剂调胃承气汤。现代药理学研究证明调胃承气汤具有解毒、解热、调节胃肠道的作用。由于大黄的毒性,在使用时应注意其剂量及用药时长。Peng等[23]人利用caco-2细胞模型证明BCRP参与大黄酸转运,而加工过的甘草与大黄同时使用可以抑制调胃承气汤中大黄的毒性。这可能是甘草中的一些成分通过影响BCRP的外排活性而抑制大黄酸的转运从而达到“减毒”的作用。现有研究证实甘草酸及甘草次酸可以抑制BCRP。早在2001年,Matsuo等[24]人发现甘草酸与拉米夫定在乙肝治疗中会产生协同作用。实际临床病例证明,采用甘草酸和恩替卡韦联合使用比单独使用恩替卡韦显著减少乙肝病毒DNA复制和降低肝损伤率。Chen等[25]人采用小鼠/大鼠及HepG2细胞模型证明,甘草酸的主要活性代谢物甘草次酸通过抑制BCRP和MRP4增加肝脏细胞和亚细胞水平恩替卡韦的积累,但不影响恩替卡韦的血浆药代动力学,从而增强恩替卡韦的抗病毒活性。
2.4 人参主要成分对BCRP的影响
人参是一种珍贵的中药材,在我国已有几千年的临床使用历史。因此它也被称为草药之王。至今为止,对人参的植物学、化学、药理学和临床应用都有大量的研究。皂苷是人参中的主要成分,根据人参皂苷的化学结构特征将其分为三大类,即二醇型(Protopanoxadiol,PPD)(如 Rb1、Rb2、Rc、Rd、Rg3、Rh2)、三醇型(Protopanaxatriol,PPT)(如 Re、Rf、Rg1、Rg2、Rh1)和齐墩果酸衍生物[26]。Jin 等[27]采用米托蒽醌(Mitoxantrone,MX)作为底物,验证二醇人参皂苷(Rg3,Rh2,PPD)和三醇人参皂苷(Rg1,Rh1,PPT)对过表达BCRP的MCF-7细胞中MX浓度的影响。结果显示,Rh2、PPD、PPT显著增强了MX对过表达BCRP的人乳腺癌MCF-7细胞的细胞毒性,说明BCRP的外排活性受这三种皂苷的抑制,其抑制作用大小为PPD>Rh2>PPT。同时,Rg3为BCRP轻度抑制剂,而Rg1和Rh1无抑制作用。人参皂苷可能是通过抑制BCRP的ATP酶活性发挥作用。此外,Jiang 等[28]研究发现Rg1、Re和三七皂苷R1为BCRP的底物。提示在临床应用人参和其他药物联用时,应注意人参皂苷对BCRP的抑制作用及其可能引起的药物相互作用。
2.5 黄芪主要成分对BCRP的影响
黄芪是一种具有多种药理活性的传统中药,在我国至少两千多年的药用历史,素称“十方八芪”,常与其他药物配伍使用。黄芪的主要有效成分是皂苷、黄酮及多糖。临床上可用于小儿反复呼吸道感染、肝炎、病毒性心肌炎、冠状动脉粥样硬化等病症的治疗[29]。
Zhang等[30]首先采用HepG2细胞系统探讨黄芪及其三种主要有效活性成分黄芪甲苷(Astragaloside IV,AS-IV)、花 萼 素(Calycosin,CS)和 刺 芒 柄 花 素(Formononetin,FMNT)对人主要药物代谢酶及外排转运体的调控。结果显示,黄芪对多种代谢酶具有调控作用,且显著升高BCRP的表达水平,而单一活性成分AS-IV对BCRP有抑制作用。在此基础上,Lou等[31]人研究了这四种药物对BCRP的调控机制。他们发现黄芪及其主要生物活性单体可以通过激活Nrf2介导的信号通路诱导P-gp和BCRP的表达,显著提高P-gp和BCRP的外排活性,并增加细胞内ATP水平。
2.6 黄岑主要成分对BCRP的影响
黄岑主要成分是黄芩苷、汉黄芩苷、黄芩素等。黄岑的药理作用包括抗癌、保肝、抗菌抗病毒、抗氧化和抗惊厥等[32]。
Yu等[33]证明,黄岑可以通过调节BCRP和MRP2增加甲氨蝶呤(Methotrexate,MTX)在体暴露量和平均滞留时间。大鼠口服给药甲氨蝶呤(5.0 mg·kg-1)或黄岑(1.0或2.0 g·kg-1),结果显示,黄芩1.0或2.0 g·kg-1给药组均可显著提高甲氨蝶呤的Cmax、AUC和MRT。采用Caco-2细胞及转染细胞模型MDCKⅡ-BCRP表明黄岑激活了BCRP介导的甲氨蝶呤外排,而黄岑的血清代谢物-黄芩素和汉黄芩素的葡糖苷酸/硫酸盐则抑制了BCRP和MRP2介导的外排转运。提示在临床上应用甲氨蝶呤这种治疗窗窄毒性大的药物时,应注意与黄岑之间的药物-药物相互作用,确保安全合理用药。
2.7 土木香主要成分对BCRP的影响
土木香是菊科植物土木香Inula helenium L的干燥根,异土木香内酯和土木香内酯是土木香的主要活性物质,可改善肠易激综合征且具有抗胰蛋白酶体活性、抗微生物活性、抗炎症活性等[34]。异土木香内酯和土木香内酯的口服生物利用度低是限制其应用的主要原因之一[35]。有研究表明,外排转运蛋白BCRP和MRPs对于肠内异土木香内酯和土木香内酯的转运至关重要。Xu等[36]发现合用两种内酯可以显著地促进这两种物质在Caco-2细胞内的转运,进一步研究显示,异土木香内酯和土木香内酯都是BCRP和MRPs的底物,这可能是两种内酯合用更容易被吸收的原因。
2.8 虎杖主要成分对BCRP的影响
虎杖主要有效成分为白藜芦醇(Resveratrol,RES,白藜芦醇),具有广泛的药理活性,包括保护心血管系统、保护神经系统、增强性腺功能、抗衰老和预防癌症等[37]。Ebert等研究报道,RES强烈诱导Caco-2和MCF-7细胞中BCRP mRNA的表达。同时,通过ATP酶活性检测、囊泡转运、肠灌注、Bcrp1-/-敲除小鼠等[38-40]研究手段,均显示RES是BCRP的底物,且BCRP对RES体内生物利用度、组织分布和代谢中均起到重要作用。此外,Azza等[41]发现RES可以上调肾脏BCRP的表达降低MTX的肾毒性作用,提示应注意RES和甲氨蝶呤存在的潜在药物相互作用。
2.9 其他中药成分对BCRP的影响
橘皮中有效成分橘皮素、川陈皮素和达沙替尼联合使用可通过抑制BCRP的外排活性显著增强细胞内达沙替尼的浓度[42]。研究发现,丹参和熊果酸[43]可显著提高瑞舒伐他汀在大鼠中的全身暴露量,其中CYP酶和P-gp对瑞舒伐他汀的药动学无显著影响,主要是OATP、BCRP和NTCP参与了瑞舒伐他汀药动学的变化。Yin等[44]证明丹参酮IIA可显著上调BCRP(7.76倍)的表达,而这可能是其生物利用度低的原因。Jia等[45]研究则显示丹参对人BCRP无抑制作用。乌头生物碱是乌头中的主要成分之一,具有镇痛和抗炎作用,但也能引起严重的心律失常和神经毒性[46]。Wu等[47,48]研究显示BCRP介导乌头主要成分乌头碱、中乌头碱、次乌头碱的外排,其机制为乌头生物碱激活Nrf2介导的信号通路,显著提高BCRP的表达。此外,Tan等[49]人采用HEK293/WT和HEK293/ABCG2细胞模型等证明,小檗碱、南蛇藤素、鞣花酸、柠檬苦素、齐墩果酸、没食子酸丙酯和芥子酸均显示出对BCRP介导的外排转运有显著抑制作用,可能对BCRP的底物药物药代动力学产生影响,应警惕由此导致的不良反应的发生。
3 结论与展望
大量研究已显示,许多为BCRP底物或抑制剂的中药组分对其外排活性有显著影响,在临床用药过程中应密切关注BCRP介导的药物-药物相互作用,以减少或规避药物-药物相互作用带来的不良影响。此外,由于BCRP的过表达也是导致肿瘤多药耐药的重要原因之一,如何逆转BCRP介导的肿瘤多药耐药,也成为当前抗肿瘤治疗的迫切需求。从大量中药资源宝库中寻找与开发低毒、高效的BCRP抑制剂,将有可能为逆转BCRP介导的肿瘤多药耐药带来新的生机与希望。

