天然植物活性成分通过转录因子调节UGT的研究进展*
詹志坤,侯楚祺,刘文钦,唐 斓
(南方医科大学药学院 广州 510515)
尿苷二磷酸葡萄糖醛酸转移酶(UDP-glucuronosy ltransferase,UGT),属于糖基转移酶超家族,可催化人体中内源或外源化合物与尿苷二磷酸葡萄糖醛酸结合,在代谢解毒方面起着重要作用。根据序列的同源性,人类UGT超家族由22个功能性同工酶组成,分为4个基因家族:人染色体2q37上的UGT1,4号染色体上的UGT2,染色体5p13.2上的UGT3,和染色体4q26上的UGT8[1,2]。在这些家族中,UGT1和UGT2家族是最有效的药物代谢酶,主要存在于肝脏和胃肠道中[3]。UGT3家族主要存在于胸腺、睾丸和肾脏中,在肝脏和胃肠道中检测不到。此外,UGT3的糖底物被证明是UDPGlcNAc(N- 乙酰化 UDPGlcUA)和 UDPGal(其中UDPGlcUA的葡糖醛酸被半乳糖取代)而不是UDPGA[1,4]。先前的研究表明,UGT3家族在II相代谢中不起重要的作用。此外,UGT8A家族只有一种酶,即UGT8A1,它是UDP半乳糖神经酰胺半乳糖基转移酶,UDPGal作为其葡糖基供体。同样,UGT8也不参与药物代谢[3,4]。
植物化学物质作为一种独特而有效的防治疾病的药物已得到广泛的应用。世界卫生组织((World Health Organization,WHO)以及包括中国,日本,韩国和新加坡在内的亚洲国家政府鼓励将中药治疗纳入主要的医疗保健系统[5,6]。在过去的几十年中,随着对中药的进一步研究,植物化学物质越来越被西方国家所接受,并在世界范围内得到普及。中药种类繁多,用途广泛,可用于治疗心脏病,癌症,中枢神经系统和炎症等疾病[7]。植物化学物质可通过调节UGT活性引起药药相互作用,从而促进了对植物化学物质作用机制的研究。这些药物相互作用的重要原因之一是参与UGT转录的关键转录因子(transcription factors,TFs)可被植物化学物质所诱导。
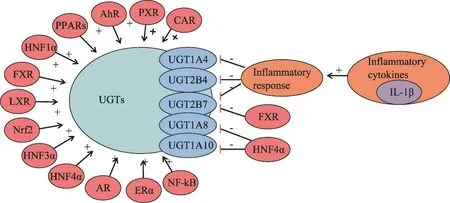
图1 文献综述了所选转录因子和UGT相关的遗传途径
到目前为止,大量研究表明,几种转录因子在植物化学物质对UGT的影响中起着重要作用。转录因子通过与特定的DNA序列结合来调控基因信息从DNA到信使RNA(mRNA)的转录,因此对基因表达调控至关重要。这些因子主要分为五个系列:①核受体家族,包括组成型雄甾烷受体(CAR,主要调节UGT1A1,UGT1A6,UGT1A9和UGT2B1)[8-15],孕烷X受体(PXR,参与激活UGT1A1,UGT1A3,UGT1A4和UGT1A6)[11,16-18],法尼醇X受体(FXR,主要参与UGT2B4和UGT2B7)[19,20],过氧化物酶体增殖物激活受体(PPAR,主要参与调节UGT1A1,UGT1A3,UGT1A4,UGT1A6,UGT1A9 和UGT2B4)[21-24],肝X受体(LXR,激活UGT1A3转录)[25]和NF-kB(调节UGT1A1的表达)[26];②碱性螺旋环螺旋(bHLH/PAS)蛋白家族,如芳烃受体(AhR,调节UGT1A1,UGT1A3,UGT1A4,UGT1A6和 UGT1A9基因)[27-30];③碱性亮氨酸拉链蛋白(bZIP)家族,包括核因子红细胞2相关因子2(Nrf2,参与UGT1A1基因表达)[31];④富含肝脏的TF家族,包括肝细胞核因子1α(HNF1α),肝细胞核因子3α(HNF3α)和肝细胞核因子4α(HNF4α)。这些因子也参与多种UGT转录调控,包括人UGT2B7,UGT2B17,UGT1A1,UGT1A3,UGT1A4,UGT1A8,UGT1A9,UGT1A10 和UGT2B15[32-40];⑤类固醇受体家族,主要包括雄激素受体(AR)和雌激素受体α(ERα),对人类UGT2B15和UGT2B17表达具有重要的调节作用[41,42]。
此外,疾病(特别是肝脏疾病和癌症)可以通过调节特定转录因子[例如白细胞介素-1β(IL-1β)][43]来降低代谢酶的表达和活性。然而,UGT在疾病中发生改变的机制尚不清楚。同时,UGT表达的差异有助于预测个体对药物的反应及某些癌症发展的倾向。
综上所述,需要进一步研究UGT基因转录的机制并确定导致其表达发生改变的关键因子,这将有助于了解植物化学物质调控UGT表达的机制。这些研究可为确定葡萄糖醛酸化变异原因提供框架,并有助于预测潜在的治疗或药物相互作用。
1 转录因子对UGT基因表达的调节
各种因素,包括内在因素,如遗传多态性、种族差异、酶-蛋白相互作用、生理和病理条件以及外部因素,如诱导剂和抑制剂,均可能影响UGT活性和表达。在正常生理条件下,细胞内表达的UGT处于稳态水平,这种稳态水平是防止正常细胞代谢过程中形成的内源性副产物和氧化应激所需的。然而,当有外源物入侵时,细胞需要增强其防御功能,从而导致UGT的表达和功能增加。据报道,植物化学物质通过诱导UGT表达引起中药相互作用[44]。通常,UGT基因表达的最重要调节途径是转录因子途径。基于文献,主要转录因子的功能总结在图1中。
1.1 CAR和PXR
1.1.1 CAR和PXR对UGT的调节
CAR(NR1I3)和PXR(NR1I2)是与外源生物代谢相关的最常见的转录因子,它们通过相应的配体激活导致药物代谢酶和转运体mRNA表达的增加。它们在本研究中一起讨论,因为它们具有相同的激活因子,靶基因诱导,并且可能是从共同的祖先进化而来[21]。然而,CAR和PXR具有不同的激活机制。例如,人PXR(hPXR)配体,如抗生素利福平和抗抑郁药贯叶金丝桃素,选择性地直接结合转录因子并迁移至细胞核,活性PXR异二聚体通过结合PXR反应元件以及类视黄醇-X受体(RXR)作为靶基因的启动子(图2)[45-47]。与此同时,CAR被苯巴比妥类诱导剂间接激活,例如抗癫痫药苯巴比妥,苯妥英和卡马西平。后一种诱导剂不直接与CAR蛋白结合,而是通过其苏氨酸38脱磷酸化机制触发其核易位[48-50]。最近,在UGT1A1转录的研究中发现了功能性CAR和PXR的结合域[48,49],人体内唯一负责胆红素葡萄糖醛酸结合的UGT亚型。之前有研究表明,PXR和CAR通过5'-启动子中的DR-3和NR-1元素调控UGT1A1转录[44,51]。此外,PXR还可以激活UGT1A3、1A4、1A6和1A9转录[21,47]。

图2 植物化学物质通过PXR激活调节UGT转录
1.1.2 植物化学物质通过CAR和PXR对UGT的影响
迄今为止,许多研究表明植物化学物质可以通过CAR和PXR调节UGT表达。Huang等[52]发现,前胡的主要活性成分(白花前胡甲素和白花前胡丙素)能够通过hCAR诱导UGT1A1的表达。Zhang等[53]发现,毛细管艾草提取物对无CAR小鼠UGT1A1的诱导作用非常弱,而其对野生型小鼠UGT1A1的作用相对增加,可加速消除UGT1A1的特异性底物胆红素。因此,许多植物化学物质可以通过CAR的转录调节来改变UGT的酶活性。
此外,许多研究表明植物化学物质也可以通过PXR转录因子调控UGT诱导。王等[54]利用体外模型研究了一些草药提取物通过hPXR途径对UGT1A1的作用,发现南五味子,白术和四川根茎提取物的诱导作用比阳性对照(利福平)高70%,表明这三种草药提取物可以激活hPXR并可能诱导UGT1A1表达。
1.2 FXR
1.2.1 FXR对UGT的调节
FXR(NR1H4)是一种核受体,主要由鹅去氧胆酸,脱氧胆酸和石胆酸及其牛磺酸和糖缀合物激活[55]。在配体结合方面,FXR主要通过将其伴侣蛋白RXR与启动子中的FXR反应元件结合来调节其靶基因的表达[56]。Barbier等[19]发现,FXR激动剂处理的肝细胞和HepG2细胞中,UGT2B4的mRNA、蛋白和活性比未处理的高得多。然而,Lu等[20]发现,在用hFXR转染的Caco-2细胞中,无论FXR配体是否存在,UGT2B7的mRNA表达均降低。结果显示FXR通过结合位于核苷酸-148和-134之间的负FXR-应答元件(GATCCTTGATATTA)进而负反馈调节Caco-2细胞中的UGT2B7基因表达。
1.2.2 植物化学物质通过FXR对UGT的影响
在以往的研究中,FXR被确定为中草药中某些活性植物化学物质的生物靶标。通过双荧光素酶测定法在转染培养的HepG2细胞中测试了一系列29个氧化丙烯酰化和氮杂丙烯基化的苯丙酸类作为FXR激动剂,并且使用内源配体鹅去氧胆酸作为对照药物。结果表明,三种植物化学物质即auraptene、nelumol A和nelumal A能够激活FXR核受体[57]。没药甾酮可以降低人体内的低密度脂蛋白胆固醇水平,已被证明可以阻断FXR与其共激活因子之间的相互作用,从而作为该受体的拮抗剂[58,59]。此外,齐墩果酸,一种用于治疗肝病的多种中药中所含的三萜类化合物,可在不改变其表达水平的情况下抑制FXR活性。这种抑制可以通过齐墩果酸在体外与FXR的配体结合结构域结合并阻断其与共激活因子SRC-3相互作用的能力来解释[59,60]。葡萄籽原花青素提取物也被报道在体内选择性地调节肠道FXR-靶基因的表达[61]。使用基于结构的药效团模型对中草药数据库进行虚拟筛选,发现灵芝的羊毛甾烷型三萜被认为是FXR激动剂配体[62]。
如上所述,植物化学物质显然是核受体(如FXR)的新配体的良好来源,系统筛选植物化学物质将丰富这些受体的药理作用。同时,植物化学物质对UGT的潜在调节机制也在前面进行了部分讨论。
1.3 PPARα
1.3.1 PPARα对UGT的调节
PPARα(过氧化物酶体增殖物激活受体α,NR1C1)是配体激活的转录调节因子,在肝脏,心脏,肌肉和肾脏中高度表达,调节线粒体和过氧化物酶体脂肪酸β-氧化和载脂蛋白合成[63]。配体结合后,PPARα通过与RXR二聚化并与PPAR反应元件(PPREs)结合来调节基因转录。研究表明,用PPAR激动剂处理人肝细胞可导致UGT1A9活性和表达增加[44]。瞬时转染和电迁移率漂移试验证实,PPRE位于UGT1A9启动子-719至-706 bp位置[22]。此外,用合成的PPAR激动剂孵育人肝细胞或肝母细胞瘤HepG2和Huh7细胞可使UGT2B4的mRNA表达水平增加[23]。此外,PPARα还参与许多UGT的调节,例如UGT1A1,1A4和2B7[24,50]。
1.3.2 植物化学物质通过PPARα对UGT的影响
在少数情况下,反式激活试验显示一些植物化学物质表现为PPARα的激动剂。桂皮皮质是一种从日本传统药物八味地黄丸分离的化合物,可用于治疗糖尿病,这个分子被发现可激活PPARα[59,64]。另一项研究从噻香中发现两种激活剂,噻香是一种用于治疗糖尿病和肝炎的中药。在提取后,两个倍半萜化合物,tirotundin和tagitinin A,在离体实验和活体实验中皆显示了激活PPARα和PPARγ的功能[59]。苦瓜提取物在离体实验和活体实验中也激活了PPARα和PPARγ[65,66]。进一步的分离纯化确定了活性化合物(9c,11t,13t-共轭亚麻酸)可以激活PPARα[67]。此外,一些研究发现[68],巴伐菌素,传统中药马齿苋果实中的天然产物,可以诱导小鼠PPAR的转录活性。鉴于PPARα对UGT的广泛调控,当这些植物化学物质诱导PPARα就必须考虑植物化学物质对UGT的诱导作用。他们可能通过诱导PPARα转录途径改变UGT的活性和表达,因此与其他药物同时服用会导致意想不到的药药相互作用。
1.4 LXR
1.4.1 LXR对UGT的调节
LXR(NR1H3)已被鉴定为“孤儿”核受体超家族成员。LXR家族包含两个亚型:LXRα和LXRβ。前者仅在肝脏、小肠、肾脏、脾脏和脂肪组织中表达,并在这些部位的脂质代谢中起重要作用。同时,LXRβ更广泛表达,但发现主要是在肝脏和脑[69,70]。Verreault等[25]证明LXRα活化剂可诱导人类肝细胞UGT1A3 mRNA水平和转基因小鼠人UGT1A。他们进行了一系列实验,包括定点诱变,电泳迁移率变动分析和染色质免疫沉淀实验,发现功能性LXRE在UGT1A3启动子中被鉴定。此外,LXRα被证实与SRC-1α和NCoR辅因子相互作用以调节UGT1A3基因,而不是与PGC-1β相互作用[25]。
1.4.2 植物化学物质通过LXR对UGT的影响
最近,从植物或草药中提纯的各种植物化学物质已显示出调节LXR活性。研究表明,岩藻甾醇可以刺激LXRα和LXRβ的转录活性,并以剂量依赖的方式激活共激活因子的募集[70,71]。已发现衍生自谷甾醇和菜子甾醇的YT-32[(22E)-ergost-22-ene-1Rα,3β-二醇],可直接与LXRα和LXRβ结合,并诱导LXRα与辅助因子的相互作用[70,72]。花青素是一种已知的存在于许多水果和蔬菜的天然黄酮,可调节细胞的脂质代谢。据报道,花青素可诱导LXRs的反式激活,并直接与LXRα和LXRβ的配体结合域结合,诱导LXRα和LXRβ的共激活肽的募集[70,73]。此外,桉树脑是从茶和草药中提炼出来的一种芳香化合物。桉树脑能促进LXRα和LXRβ的转录激活,并增加LXR靶基因的表达[70,74]。与之相反,来自传统中草药大黄(Rheum palmatum L.)的大黄酸是一种亲脂性蒽醌,已被证明可作为小鼠LXRα和LXRβ的拮抗剂[70,75]。
鉴于LXR与上述各种重要UGT的转录相关,这些具有LXR调节活性的天然化合物也可影响UGT表达。这可能解释了UGT通过LXR途径的植物化学调控机制。
1.5 NF-κB
1.5.1 NF-κB对UGT的调节
NF-κB是一种重要的信号转导,介导了一系列的反应。Fujiwara等[76]此前提出过一个观点,与配方奶喂养的婴儿相比,母乳喂养的新生儿中血清胆红素水平更高。他们进行了一项实验,并且得出结论,母乳会下调肠道UGT1A1的表达水平,导致高胆红素血症。另外,NF-kB失活可能是导致该基因抑制的原因。为了进一步探讨这一机制,他们最近研究了靶向缺失肠上皮细胞中的IKKβ 的hUGT1/IKKβ△IEC小鼠[26],结果表明氧化还原敏感的NF-kB途径对UGT1A1基因的肠表达水平至关重要。与对照组hUGT1/IkkbF/F小鼠相比,这一发现可能导致新生小鼠总胆红素积累增加。
1.5.2 植物化学物质通过NF-κB对UGT的影响
越来越多的证据表明植物化学物质可以调节NF-κB。Svehlikova等[77]的早期实验表明,在未分化的CaCo-2细胞[78](一种充分表征人类小肠未分化的细胞模型)中,植物化学物质,如芹菜素和萝卜硫素,可使NF-κB和mRNA的表达水平分别提高2.5倍和2倍。同时,Heiss[79]研究了植物化学物质萝卜硫素的调节机制。萝卜硫素是一种脂肪族异硫氰酸酯,也是著名的癌症化学预防剂。他们的研究结果表明,萝卜硫素可以抑制DNA和NF-κB的结合,但不会阻碍NF-κB易位至细胞核。此外,最近的研究[80]已经证明,几种活性植物化学物质可以通过阻断不适当的NF-κB活化进而对COX-2和其他表达发挥调节作用。另一份报告指出[81],从冻干的金银花中提取的植物化学物质可以抑制NF-κB核易位和磷酸化Akt。同时,大量证据表明,细胞外调节蛋白激酶和p38丝裂原活化蛋白激酶(MAPK)在细胞内信号级联响应大量外部刺激的NF-κB活化起着重要作用。抑制NF-κB活化的可能机制包括抑制单位IkBα的降解,从而阻碍NF-κB功能活性亚单位随后的核易位。

图3 植物化学物质通过AhR激活调节UGT转录
与UGT表达活化相关的信号通路尚未完全阐明。关于这个主题的研究是有限的。基于Svehlikova及其同事的实验[82],他们认为芹菜素对UGT1A1的诱导可能与NF-κB易位有关,其中一个原因是SN50(一种NF-κB易位抑制剂)增强了芹菜素对UGT的诱导作用。
1.6 AhR
1.6.1 AhR对UGT的调节
AhR是位于细胞质中的转录因子,属于碱性螺旋环螺旋(bHLH/PAS)蛋白家族[49],在内源性和外源性物质的代谢[83]、免疫反应以及细胞增殖和分化[84]中起重要作用。有研究表明,热休克和其他伴侣蛋白可与胞质溶胶中的AhR结合为非活性复合物;然而,当与配体结合时,AhR会采取各种行动,包括从伴侣分离,进入细胞核,最后与其伴侣蛋白Arnt(芳烃受体核转位蛋白)结合。然后,AhR-Arnt复合物与异种生物反应元件(XREs,它与靶基因的启动子结合)结合,诱导靶基因转录[47,84](图3),例如UGTs。所有UGT1A家族,以及UGT2B4、UGT2B15和UGT2B17,都被发现具有良好的AhR结合位点[85-88]。Ritter等[89]发现AhR也诱导人UGT1A1的活性。使用表达整个人类UGT1的AhR缺陷小鼠的研究表明,所有UGT1家族成员似乎都受到AhR的调节[90]。
1.6.2 植物化学物质通过AhR对UGT的影响
AhR可以介导对环境污染物(如二恶英)的反应,这些污染物对健康有许多不利的影响。Amakura等[91]利用AhR免疫分析法(一种基于AhR的二恶英生物测定法)初步筛选了大量植物化学物质对2,3,7,8-四氯二苯并-对二恶英(TCDD)诱导的AhR激活的抑制或激活作用。结果表明,胡椒碱和香豆雌酚对TCDD诱导的AhR激活显示出显著的抑制作用。此外,姜黄素、鼠尾草酚和辣椒素对AhR活化的抑制作用最小。相比之下,异黄酮如大豆苷元,具有二苯乙烯结构的白藜芦醇和一些类黄酮如柚皮素,橙皮素和黄芩素显示出激活AhR的能力[92]。Zhang等[93]证明高良姜素、染料木素、大豆苷元和薯蓣皂苷元在Hepa-1细胞中具有AhR的激动活性。木犀草素是MCF-7和HepG2细胞的AhR拮抗剂[94]。先前的研究表明[95]绿茶提取物对多环芳烃引起的癌症具有化学预防作用。为探讨该保护作用的有效成分,测定了绿茶儿茶素对AhR基因诱导的影响。表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)和表没食子儿茶素(epigallocatechin,EGC)是AhR转录最有效的拮抗剂。桑叶提取物成分花青素,也被发现以剂量依赖的方式抑制AhR的转化[96]。上述具有AhR调节活性的天然化合物可能通过调节AhR进而影响UGT表达。此外,已显示AhR介导的UGT1A1 5'-侧翼区290bp报告基因的反式激活参与了UGT1A1的白杨素调节,其中白杨素激活UGT1A1基因并增强其活性[97]。芹菜素和香叶木素对UGT1A1的诱导机制与白杨素的诱导机制相似。
1.7 Nrf2
1.7.1 Nrf2对UGT的调节
Nrf2是一种属于帽和领CNC(cap-‘n'-collar,CNC)转录因子家族成员,参与UGT和其他II相酶的转录[98]。在正常条件下,Nrf2被Keap1控制在胞浆中,导致蛋白酶体降解[99,100]。当Keap1与活性氧(ROS)和其他亲电试剂以及抗氧化剂反应时,Nrf2从Keap1解离下来。Nrf2从Keap1释放后,易位到细胞核中。一旦进入细胞核,Nrf2与Maf蛋白形成异二聚体,然后与顺式作用抗氧化反应元件(ARE)结合,刺激靶基因的转录[47,101-103](图4)。以往的研究表明,功能性AREs可诱导UGT1A1,UGT1A6,UGT1A7,UGT2B4,UGT2B7 和UGT2B17的转录[104,105]。Yuan等[106]报道了Nrf2通过激活Nrf2-UGT1A信号通路,在UGT1A,UGT1A8和UGT1A10的转录中起关键作用。

图4 植物化学物质通过Nrf2激活调节UGT转录
1.7.2 植物化学物质通过Nrf2对UGT的影响
一些植物化学物质,如EGCG,番茄红素和花姜酮(zerumbone,ZER)被认为直接破坏Keap1-Nrf2复合物,从而通过Nrf2信号途径诱导UGTs的转录[107-109]。花姜酮是从球姜中提取的含有共轭二烯酮结构的单环倍半萜类化合物,已被证明具有抗结肠癌和皮肤癌的特性。以往的研究表明,花姜酮可诱导Nrf2与II相酶基因的ARE结合的核定位,表明花姜酮是Nrf2/ARE依赖性解毒通路的潜在激活因子。这也与花姜酮增强几种Nrf2/ARE依赖性II相酶基因的表达的观察结果一致[109]。它可能的机制是花姜酮可以拮抗Nrf2和Keap1之间的相互作用,稳定Nrf2并导致其在细胞内快速积累。咖啡酸苯乙酯(caffeic acid phenethyl ester,CAPE)和姜黄素在肾上皮细胞中以浓度和时间依赖性方式刺激Nrf2表达。几项调查的可能机制是姜黄素(和CAPE,推论)可以促进Nrf2-Keap1复合物的失活,导致Nrf2与常驻AREs的结合增加[110]。此外,在瞬时转染的癌细胞中也发现了类似的现象,番茄红素可以反式激活与ARE序列融合的Nrf2基因的表达。最近对绿茶多酚的研究表明[111],EGCG和ECG通过MAPK途径有效诱导ARE介导的基因表达,包括II相解毒酶。通过比较5种多酚对MAPK的激活情况,EGCG对3种MAPK(ERK,JNK,p38)均具有较强的时间和剂量依赖激活作用,而EGC仅激活ERK和p38。
1.8 HNF1/3/4
1.8.1 HNF1α
(1)HNF1α对UGT的调节
众所周知,HNF1α参与多种UGTs的调节,包括人UGT2B7,UGT2B17,UGT1A1,UGT1A3,UGT1A4,UGT1A8,UGT1A9和UGT1A10以及大鼠的UGT1A7[32,34,35]。UGTs的调控机制越来越受到人们的关注。先前的研究表明[112,113],UGT1A8,UGT1A9和UGT1A10,以及Sp1和尾部相关的同源域蛋白2,均被HNF1α协调调控。通过使用生物信息学工具,Bélanger等[114]预测UGT1A1的近端启动子中存在几个假定的转录因子结合位点,并通过EMSA证明HNF1α会与UGT1A1的近端启动子结合。Oda等人的一系列实验表明[113],DNA高甲基化以及组蛋白的低乙酰化会阻碍HNF1a与UGT1A1的结合,从而抑制人肾脏中UGT1A1的表达。他们的另一个发现[115]是,DNA高甲基化是HNF1a和Cdx2结合过程中的障碍,会导致人肝脏中UGT1A10的表达下降。HNF1α基序的突变会导致HT29细胞中UGT1A1启动子活性降低,这个发现第一次说明了HNF1α在调节UGT1A1启动子中的作用。既往研究表明,大鼠UGT1A6基因通过远端启动子P1和近端启动子P2表达,这两个启动子均被组织特异性地调控。P2转录本在肝脏、肾脏和胃肠道中含量较高,而在其他组织中P1转录本占优势。UGT1A6在肝脏中的表达增加部分是因为P2转录单位对HNF1有作用,而这种作用是由位于P2启动子上游的HNF1结合位点介导的[116]。此外,UGT1A5外显子1上游的核苷酸序列是一个无效的启动子,这一结果可能解释了这种UGT亚型在人体组织中缺乏实质性表达的原因[34]。
(2)植物化学物质通过HNF1α对UGT的影响
丹参酮IIA是从丹参中分离得到的药理活性最强的植物化学物质之一,具有抗炎、抗癌、神经保护、降血脂等多种生物活性。Chen等[117]研究了丹参酮IIA在肝细胞中的降胆固醇作用。他们发现丹参酮IIA可以降低HNF1α与PCSK9启动子结合的能力。Ankaferd®血液阻滞剂(ABS)是一种活性植物化学物质,已被用作止血剂。Yilmaz[118]提供证据表明ABS可显着提高HNF1α的活化水平。
考虑到上述研究结果,我们可以得出结论,活性植物化学物质的丹参酮IIA和Ankaferd®血液阻滞剂在一定程度上通过HNF-1α来调节UGT1A8,UGT1A9和UGT1A10。然而,还需要进一步调查。
1.8.2 HNF3α
通过AR的雄激素信号传导对于人类的前列腺生长和功能至关重要。然而,前列腺内过多的雄激素信号传导与前列腺癌(prostate cancer,PCa)的发展和进程息息相关有关。鉴于雄激素及其代谢产物的葡糖醛酸化促进其排泄,UGT2B15和UGT2B17在降低细胞内雄激素浓度从而防止前列腺内雄激素过度信号传导方面发挥重要作用。HNF3α似乎通过与其同源反应的元件结合来作为靶基因调节区中的单体并增强其他转录因子的进入而充当转录促进因子。研究表明,HNF3α是PCa细胞系中UGT2B15和UGT2B17基因表达的主要调节因子。这项研究发现了UGT2B15近端启动子内的一个功能性HNF3α位点,该位点对细胞中基础UGT2B15基因转录活性很重要[37]。
然而,植物化学物质对这种转录因子的调控尚未见报道。鉴于HNF3α是UGT2B15和UGT2B17调节的关键转录因子,我们假设植物化学物质可能通过这种转录途径来调控这两种酶的表达。
1.8.3 HNF4α
(1)HNF4α对UGT的调节
HNF4α(NR2A1))是属于细胞核激素受体家族的转录因子,在肝脏、肾脏、胰腺和小肠中高表达[112],主要参与体内脂质和葡萄糖稳态的调节。HNF4α是肝脏中调节II相酶的重要反式激活因子[33]。Yueh[119]的实验表明HNF4α在肝UGT2B7的组成型表达中起重要作用,并且在染色质免疫沉淀测定中验证CAR对UGT2B7基因表达的抑制作用,其中TCPOBOP处理阻断了HNF4α与UGT2B7启动子的结合。此外,HNF4α可以与UGT1A9基因启动子中-372至-360位的顺式作用元件结合,从而激活UGT1A9的转录[120]。Lu等[40]还发现,HNF4α的缺失会显著降低几种肝脏II相酶的mRNA 表 达 ,包 括 UTT2A3,UGT2B1,UGT3A1和UGT3A2,这可能是由于HNF4α的缺失所导致的[121]。
(2)植物化学物质通过HNF4α对UGT的影响
Wang等[122]研究了黄连提取物非洲防己碱(columbamine,COL)在仓鼠和HepG2细胞中的抗高胆固醇活性和潜在分子机制。结果表明,COL可以激活转录因子FTF和HNF4α的mRNA和蛋白表达。启动子荧光素酶测定显示COL可诱导FTF和HNF4α的表达。此外,之前的一项研究表明[123],来源于黄连中的黄连胺通过诱导HNF-4α的表达,进而促进胆固醇分解和代谢,加速了胆汁酸的排泄,显示出较高的降脂活性。Wei等[124]提供的证据表明,人参皂苷CK是天然的二醇型人参皂苷在人肠道内的代谢产物,可通过激活腺苷-5'-磷酸激酶来降低肝脏糖异生。他们还研究了CK对2型糖尿病小鼠和HepG2细胞的作用机制,发现CK降低了肝脏和HepG2肝细胞中PEPCK和G6Pase的表达,同时,经过CK处理后,HNF4α的表达显著降低。
基于上述的实验结果,我们假设具有生物活性的植物化学物质,如抗高胆固醇血症的COL和具有显著药理作用的BBR和具有抗糖尿病作用的人参皂苷CK,可通过影响HNF4α进而对UGT2B7和UGT1A9产生显著影响。然而,还需要通过进一步的研究来验证这一假设。
1.9 AR
1.9.1 AR对UGT的调节
雄激素受体AR(NR3C4)是配体激活型转录因子,属于核激素受体超家族[125]。AR与雄激素配体结合后,与分子伴侣蛋白分离,二聚化,然后与靶基因的雄激素反应元件(androgen response elements,AREs)结合,募集转录共调节因子,并导致雄激素应答基因转录的刺激或抑制[126]。
目前,雄激素在前列腺癌的发生和发展中起着重要作用。近期研究结果表明[127],UGT2B15和UGT2B17在控制肿瘤内雄激素水平中介导二氢睾酮(DHT)代谢的受体控制作用,从而影响前列腺癌的进程。Zhang等[127]在一篇小综述中报道过UGT2B15和UGT2B17是LNCaP细胞雄激素反应的主要决定因素之一。同时,siRNA可以抑制UGT2B15和UGT2B17的表达,使葡萄糖醛酸化活性显著降低,导致细胞培养基中DHT水平增加和增殖反应增加[128]。重要的是,这些UGT基因通过AR因子途径调节并受DHT诱导的下调[41]。在他们的实验中,张等人表明DHT处理可能以时间和剂量依赖的方式阻碍LNCaP细胞中UGT2B15和UGT2B17的表达。然而,这种现象被氟他胺和比卡鲁胺竞争性地拮抗。
1.9.2 植物化学物质通过AR对UGT的影响
表油菜素内酯(epibrassinolide,EBR)是多羟基化甾醇衍生物和油菜素类固醇的生物活性化合物。Obakan等[129]发现,EBR与雷帕霉素联合作用可诱导前列腺癌LNCaP细胞凋亡并表达AR。上游mTOR抑制剂可阻止EBR诱导的细胞活力丧失和PARP裂解。同时,他们在非功能性AR的DU145细胞中也观察到了类似的结果。Xu等[130]成功应用高通量基因表达谱分析试验直接靶向AR基因以筛选天然产物文库,从而鉴定17β-羟基乙醇酰胺1-5,其中physachenolide D(5)对两种前列腺癌细胞系,即LNCaP和PC-3表现出较强的选择性体外活性。此外,Rahman[131]发现Hymenodictyon excelsum中的蒽醌和香豆素成分具有抗前列腺癌效应,并且对AR具有拮抗作用。鼠尾草酚是一种二萜类化合物,具有一系列抗癌、抗炎和抗氧化作用。所有这些作用都是通过调节不同的信号级联反应来介导的,包括雄激素和雌激素受体[132]。
然而,植物化学物质通过AR对UGT的调控作用尚不清楚。我们只能做出一些适当的假设,例如EBR可能通过AR调节UGT2B17。这方面还有待进一步研究。
1.10 Erα
1.10.1 Erα对UGT的调节
在早期的工作中[133],发现代谢酶(例如UGT酶)被诱导后,表达水平会增强,其中一个原因就是核受体和雌激素受体的合成增加。同样,Liu等[134]发现包括CAR,PXR 和 Erα(NR3A1)在内的三种转录因子是UGT转录最重要的反式调控因子(中位数和相关系数范围分别是:46%,6%-58%;47%,9%-58%;和52%,24%-75%)。最近,Neumann等[135]检测了捐助者肝组织 中 的 11种 肝 UGT 酶 ,即 UGT1A1,UGT1A3,UGT1A4, UGT1A5, UGT1A6, UGT1A9,UGT2B4,UGT2B7,UGT2B10,UGT2B15和 UGT2B17以及包括Erα在内的16种转录因子的mRNA表达水平。令人惊讶的是,他们发现在小孩肝脏中的Erα表达几乎与每个UGT基因都存在显著的相关性。对于Erα的作用机制,Hu等[42]揭示Erα,AR和FOXA1可以通过串联结合细胞系模型中的近端启动子协调提高UGT2B15和UGT2B17的表达。
1.10.2 植物化学物质通过Erα对UGT的影响
一些证据表明,Erα可以结合多种结构多样的配体,包括植物化学物质和合成物。植物雌激素(BEs)来源于多种植物中,已被广泛报道与ERs结合,在某些情况下类似于内源性雌激素,雌二醇(E2),可以通过雌激素组织和细胞诱导雌激素靶基因的表达以及靶标的表型变化[136]。与E2不同,Jiang等[137]报道BEs优先与ERβ结合;但是,BEs在高浓度(0.1μM或1μM)下可以完全激活Erα。为了进一步探索Erα在BEs作用中的功能,Gong等[138]在肝细胞中使用了四种常见的BEs,即染料木素,大豆苷元和大豆中的S-牛尿酚,以及甘草根中的甘草素进行基因调控研究。他们发现这四种BEs和E2可通过Erα途径刺激Erα染色质结合和靶基因表达。
越来越多的研究表明植物化学物质可以影响UGT。例如,Ismail[139]发现穿心莲和猫须草的提取物可在不同程度地抑制UGT2B15的活性。我们可以据此做出推论,即穿心莲、猫须草提取物可通过Erα途径抑制UGT2B15活性。
2 UGT的其他调节途径
除了转录因子途径,植物化学物质还可以通过其他方式调节UGT基因表达。曾等[140]发现用蛋白激酶抑制剂姜黄素处理LS174T细胞(可以高表达UGT1A的细胞系)可以削弱UGT1A对木犀草素葡萄糖醛酸化的催化效率,而它们不影响UGT1A的表达和翻译,这表明姜黄素可能通过抑制UGT酶的磷酸化来影响UGT的活性。
值得注意的是,肝脏疾病与UGT表达显着相关。Mario等[43]研究了炎症对肝病患者个体UGT亚型mRNA表达水平的影响。结果表明,高炎症评分样本中UGT1A4,2B4和2B7 mRNA表达显着降低。此外,UGT酶的mRNA表达的降低与炎症程度有关。这种结果可能与炎症样本中IL-1β mRNA水平升高有关,IL-1β是由浸润性炎症细胞释放的物质[43]。
3 未来展望
UGT是一个多功能的超基因家族酶类,负责众多内源性和外源性药物的葡糖醛酸化,在人体药物的清除中起着不可或缺的作用。以上我们讨论了几个关键的转录因子对UGT基因表达的调控影响。虽然还需要做进一步的研究,但我们已经开始识别UGT基因表达最重要的调控区域,与这些区域结合的转录因子可以介导人类UGT基因表达的改变。
植物化学物质作为传统的治疗药物,在中国和亚洲各国的疾病防治中发挥着不可替代的作用。此外,随着对植物化学物质的进一步研究,这类药物已逐渐被众多西方国家所接受,并作为一种重要的多组分治疗药物在世界范围内广泛流行。然而,许多植物化学物质,特别是草药中的酚类物质,是人体内UGT的底物。同时,UGT的催化效率可以被多种植物化学物质调节,从而导致药药相互作用。因此,了解植物化学物质通过转录因子调控UGT基因表达,将有助于治疗和预防药药相互作用。总之,植物化学物质转录因子诱导UGT酶表达的调控机制是复杂的,需要进一步研究。

