马兜铃酸体内代谢及致毒过程研究进展*
马虹莹,吴敬敬,葛广波,杨 凌**
(1.上海中医药大学交叉科学研究院 上海 201203;2.大连医科大学药学院 大连 116044)
马兜铃科中药材包括马兜铃属、细辛属、马蹄香属广泛应用于中成药制剂。但其马兜铃酸(Aristolochic acids,AAs)成分却有多重潜在毒副作用。长期食用或服用含AAs的食物、中药易使肾间质纤维化,引起急、慢性肾小管间质病变,造成不可逆肾损伤[1]。作为导致急性/慢性肾衰竭的原因之一,AAs被认为是巴尔干地区肾病的罪魁祸首[2,3]。现由AAs引起的肾间质性肾病和上皮恶性肿瘤统称为马兜铃酸肾病(aristolochic acid nephropathy,ANN),满足以下标准中的两条以上均属AAN患者:①肾脏组织学显示间质纤维化与皮质激素梯度;②有AAs的草药产品的消费史;③有AADNA加和物的存在(或具体p53基因的A:T→T:A的突变)[4]。此外,研究发现AAs可在无肾损伤的情况下诱导肿瘤生成,说明AAs的肾损伤和致癌作用是分离的。人肾小管上皮细胞AAs积累可通过促进线粒体的通透性转变直接引发肾损伤。AAs代谢中间产物马兜铃内酰胺氮离子能与DNA碱基环外氨基亲电结合,促使基因突变,从而诱发肿瘤[5]。由此发现AAs的致毒过程并非单一。
1 马兜铃酸I致毒过程概述
“马兜铃酸肾病”(AAN)是用来将包括任何形式的,由于摄入AAs而引起的间质性肾病。虽然大多数国家都禁止含有AAs的产品,但AAs在世界各地的传统草药治疗中仍然存在。其主要毒性成分马兜铃酸I(Aristolochic acid I,AAI)可直接损伤肾小管上皮细胞,尤其近端肾小管上皮细胞,导致细胞坏死或凋亡。其活性代谢产物会形成AAI-DNA加合物,这种脱氧核糖加和物会引起患者体内肿瘤抑制基因p53的突变[6],导致AAN和上尿路上皮癌消化道中的结肠腺癌和肝细胞癌。
1.1 马兜铃酸I依赖性肾损伤
AAI对肾小管上皮细胞的损伤,主要呈现淋巴细胞的浸润,大量间质细胞纤维化,肾小管萎缩,病变特征由表面皮层向深层进展。其中近端肾小管上皮细胞(Proximal tubule epithelial cells,PTEC)为AAI的主要靶细胞。但不同剂量AAI损伤肾小管、导致间质纤维化的机制并不相同:大剂量AAI在人肾小管上皮细胞中可以通过激活线粒体的渗透性直接引起急性肾小管上皮细胞坏死;长期小剂量摄入AAI(累积剂量大)则通过刺激人肾小管上皮细胞分泌(转化生长因子β,TGF-β)[10],促进肾小管上皮细胞向肌成纤维细胞的分化,导致肾小管损伤和肾间质纤维化。此外,实验证实有机阴离子转运蛋白(Organic anion transporters,OATs)对AAI在PTE的积累至关重要,在AAN小鼠模型中丙磺舒(一种促进尿酸排泄药物可以抑制OATs)的参与,可限制AAI的累积,预防急性肾小管坏死[11]。
1.2 马兜铃酸I介导的致癌过程
AAI作为为基因毒性的致癌物,其作用与生成DNA加合物发肿瘤相关基因的突变和活化有关。研究发现经AAI诱导的大鼠和小鼠体内的DNA加和物以dA-AAI为主,它会引起AT→TA特征型突变。这类基因突变高频率发生于经AA诱导的大鼠肿瘤组织的61位密码子的腺嘌呤基因上,是啮齿动物的AAI致癌过程中的关键病变。同样,AT→TA的基因突变发生于AAN患者的肿瘤抑制基因P53(Tumor suppressor gene p53,TP53)和在无限增殖Hupki(人类TP53敲入)成纤维细胞中[12]。在AAN患者的肾小管上皮细胞中可以通过定量AAI-DNA加和物来反应AAI的暴露量。上述DNA加和物(图1),尤其是dA-AAI已分别在马兜铃酸肾病和巴尔干地方性肾病患者泌尿道上皮组织中检测到[7,8]。目前AAI-DNA加合物已成为检测AAN的标志物[5,9]。在台湾等马兜铃植物应用较广的地区,发现AA的暴露量与台湾泌尿上皮癌的发生率呈正相关[13]。
通过微阵列研究发现[14],在人尿路上皮细胞癌中除TP53外,原癌基因MYC也会受到AAI暴露量的影响,可能与AAN相关的泌尿上皮肿瘤的发生发展过程相关。然而,这些基因尚未在AAN临床样本中发现,仍需进一步研究探索。
2 马兜铃酸I的体内代谢处置过程
AAI进入人体后,将经历代谢外排和活化产毒两种生物转化路径。因此了解AAI在体内的具体代谢转化路径,将为AAN的治疗起到重要的作用[14]。具有基因毒性的AAI-DNA加和物的结构形成需要一个带有非定域正电荷的还原性环氮鎓离子。因此,AAI的硝化反应是AAI诱导毒性的关键步骤。体外研究发现,在人和大鼠的肝脏或者肾细胞浆亚细胞组分中,有以下几种酶会对AAI的活化造成影响,首先是醌氧化还原酶醌氧化还原酶((NAD(P)H:quinone oxidoreductase 1,NQO1),其次是肝微粒体中细胞色素P450酶1A1/2[15]和肾微粒体中的CYP还原酶细胞色素P450氧化还原酶(CytochromeP450oxidoreductase,POR))16]。此外,高表达于泌尿组织的环加氧酶(Cyclooxygenase,COX)也对AAI具有生物活化效果。
2.1 胞质酶的活化:醌氧化还原酶(NQOI)
肝或肾细胞质中的NQOI会催化AAI产生还原性环氮鎓离子而形成AAI-DNA加合物。AAI也通过诱导NQOI肾活性加快自身代谢,进而增加体内的基因毒性[17]。双香豆素,一种NQO1抑制剂[18],在体外实验中会使NQO1催化生成的AAI-DNA加和物减少近99%,证实了NQO1对AAI-DNA加和物形成的重要性。此外,利用大鼠印记实验研究NQO1的组织分布发现,在肝和肾中NQO1的表达量会因AAI和AAII的诱导而上升,但在肺中并无此现象[19,20]。
2.2 微粒体酶对AAI的生物转化
由于在实验动物尿液和粪便排出物中均检测到了AAIa,且形成的DNA加和物中并没有AAIa的存在,且AAIa给药小鼠体内观察不到肾皮质的显著组织学变化,DNA加和物的生成量低于AAI给药小鼠的两个数量级。由此AAI在经CYP1A1/2去甲基化生成AAIa的过程被认为是AAI的解毒过程[21]。
同时微粒体酶CYP1A1/2和细胞色素P450氧化还原酶(CytochromeP450oxidoreductase,POR)可通过简单的硝基还原活化AAI[22]。体外重组人源酶和相关分析中发现,α-硫辛酸(POR抑制剂),并不会降低人肝微粒体中AAI-DNA加和物的生成[23]。相反,CYP1A1/2和CYP1A2抑制剂α-萘黄酮和呋拉茶碱对AAI-DNA加和物生成的过程有显著抑制效果[24,25]。说明在人肝微粒体中,AAI主要通过CYP1A1/2进行还原,POR起作用较小[22]。在人肝脏中,由于CYP1A1表达水平相对较低,因此对AAI的活化作用要比CYP1A2小。然而,人肾脏中CYP1A1对AAI的活化具有重要作用,一方面由于该酶在肾脏中表达,另一方面,AAI对该酶具有诱导效果[25]。
此外,人肾脏中CYP3A5酶也能够活化AAI,但其活化能力要低于CYP1A1和1A2[26]。人肾脏微粒体中前列腺素H合成酶、环加氧酶(Cyclooxygenase,COX)也能催化AAI-DNA加合物的形成,且COX活化AA的效率与COX-1有关。采用动力学方法研究NQO1和CYP1A1/1A2对AAI的活化能力强弱,发现NQO1与AAI有更好的亲和力,经NQO1催化生成AAI-DNA加和物产量最高时 AAI的浓度 K0.5为 17 μM[27]。与CYP1A1/2,POR和COX-1酶相比,AAI可很好的结合于的活性位点,催化形成AAI-DNA加合物所需AAI浓度最小;以催化AAI-DNA加合物形成时的NADPH表达水平作为参考,胞质中NADPH表达水平比微粒体中高两倍(表1)。以上结论说明,NQO1在体内催化AAI致毒中占据着关键地位。

表1 NQO1,CYP1A1/2,NADPH:CYP还原酶和COX-1对AA1活化过程的贡献[27]
2.3 马兜铃酸的代谢激活路径
活化产毒过程中,AAI具有致突变性和致癌性。AAI在体内首先被可被细胞质中的NQO1和/或CYP1A1/2将硝基还原为氨基后,通过分子内环化脱水生成有毒的内酰胺代谢产物(N-hydroxyaristolactam I,N-OHALI),该物质可进一步转化为具有亲电子性的带有移位正电荷的ALI正氮离子(aristolactam I ion)[28]。该化合物为同分异构体可在C7位置与DNA发生共价结合生成AAI-DNA加合物,分别为dA-AAI和dG-AAI(图1)[29,30]。这类脱氧核糖加和物具有器官特异性,以肾组织最多,可在动物和人体内蓄积,并在他们的整个生存期中持续存在。这种DNA加合物,可促进基因腺嘌呤(A)与胸腺嘧啶(T)的突变转换,即AT→TA,使肿瘤抑制基因P53突变失去正常功能,从而使细胞增殖增强、分化异常,最终导致肿瘤的发生[31]。有研究认为AA代谢活化形成DNA加和物的过程并不是AA诱导恶性损伤的唯一方式,它所引起的DNA损伤会导致蛋白质转录水平的细胞特异性转变,这也会造成相应的生理损伤[32-35]。
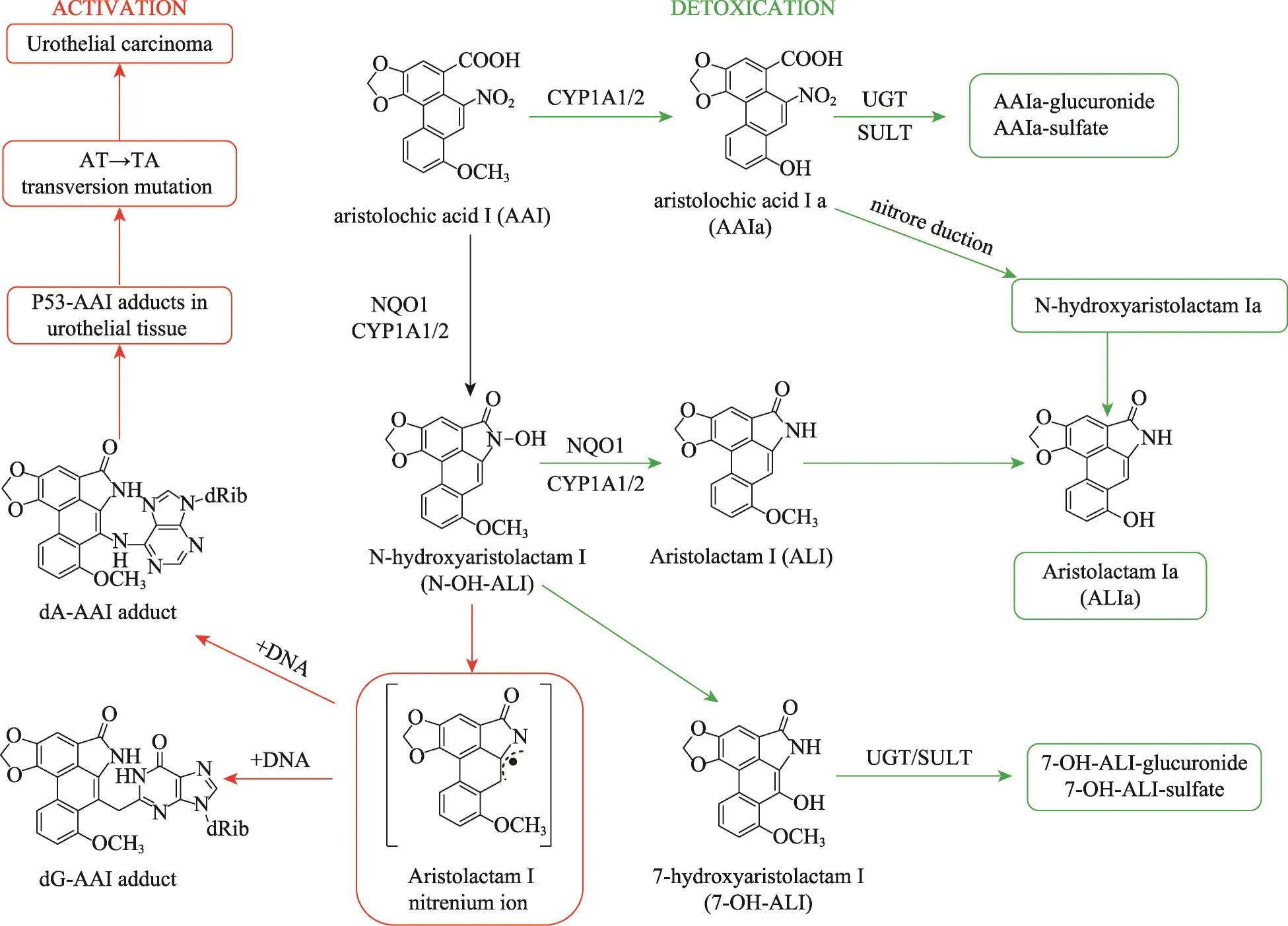
图1 马兜铃酸I(AAI)的活化与解毒途径
在啮齿动物尿液和粪便中发现大部分的AAI代谢物多以(葡萄糖醛酸、醋酸盐和硫酸酯类)轭合物形式存在。在肾脏灌注大鼠模型中发现,AAI在肾脏组织中可代谢为AAIa,AAIa-硫酸盐结合物,ALIa,ALI和ALIa O-葡萄糖醛酸结合物。其中AAIa是经CYP1A催化氧化脱甲基后,再经尿苷二磷酸葡萄糖醛酸基转移酶(UGT)或/和磷酸转移酶(SULT)催化以游离或结合物的形式被排出体外。而ALIa可通过两种代谢途径生成,一种途径是ALI去甲基,另一种途径是将AAI的脱甲基化到AAIa后还原为ALIa。实验证实经ALI给药的Wistar大鼠体内,DNA加和物的产量会降低近50倍,说明不但ALI的代谢产物ALIa无毒,其自身也是无毒产物产物[5]。
3 转运体在马兜铃酸肾毒性中的作用
除了代谢酶作用,AAN中AAI毒性选择性的表现在近端肾小管上皮细胞(proximal tubular epithelial cells,PTEC),提示存在某种特定的分子机制,可导致毒素的积聚于这些细胞。现研究发现有机阴离子转运家族(Organic anion transporter,OATs)在AAI致毒过程中发挥了重要作用[14]。OATs分布广泛、具有多种选择性,可以运输多种有机阴离子。在人类肾脏中,OAT1、OAT2和OAT3均位于肾上皮细胞基底外侧膜,介导从血液到细胞质的物质运输。其中OAT1和OAT3主要表达与肾脏,而OAT2主要表达与肝,少量表达与肾。表达与肾脏的OAT4分布于肾近端肾小管上皮细胞(Proximal Tubular Epithelial,PTEC)的细胞膜中,作为一种不对称的有机阴离子交换器,在阴离子吸收过程中发挥作用,可同时排泄多种阴离子药物和外源化合物。
而AA的阴离子性质恰好易与该蛋白结合,实验发现Hek293细胞人OAT1,3和4的表达,会造成AAI的累积,而在羧苯磺丙胺(OATs典型抑制剂)的作用下AAI的积累量会降低[14],实验已证实:AA给药老鼠,经羧苯磺丙胺治疗后,会显著减少AAI-DNA加和物的形成减少肾小管坏死,淋巴细胞浸润,管状萎缩和纤维化。此外,AAI是人和小鼠OAT1和OAT3的高倾合性底物,与人OAT4的结合能力较弱。推测AAI在PTEC中通过OAT1和OAT3的流入比通过OAT4流出要多,也就解释了在PTEC中有毒的AAI积累。虽然,OATs对AAN发病机制的潜在影响目前还不清楚。但可考虑将抑制OATs作为AAN的潜在安全治疗途径。
为了进一步研究器官-器官间的交互作用,Chang[36]等人利用微流控器官芯片,研究肝代谢是否会改变AAI诱导的肾毒性。细胞毒性实验证明,与直接注入AAI于肾器官芯片相较,经肝器官芯片代谢后的AAI会造成更严峻的肾细胞死亡。说明经肝代谢后AAI造成的肾损伤会显著增强,即肝脏代谢AAI所引起的整体效果是生物激活而非解毒。当用NQO1的抑制剂双香豆素(10 μM)共培养肝细胞后,会降低由AAI诱导的肝损伤近39%[36],但将双香豆素直接浸泡于肾器官芯片,对AAI的毒性并无明显效果,得出NQO1在肾脏中直接激活AA-I产毒属次要作用,说明人肝细胞内NQO1通过形成N-OH-ALI对AAI的肾毒性非常 重要。
相比而言,硫酸盐共轭ALI代谢物(N-OSO3-ALI)对人体肾脏细胞有直接的毒性,这一作用并不会由肝脏代谢改变。经微流控器官芯片构建的生物系统中研究发现AAI的硫酸盐共轭ALI的代谢物(N-OH-ALI)是经肝脏转移到肾脏的有毒物质。其中,N-OH-ALI无毒性,而N-OH-ALI经SULTs形成结合性代谢产物NOH-ALI为AAI的肾毒性代谢产物。人类SULT1A1和SULT1B1对于激活AA-I和N-OH-ALI[37,38]至关重要。且N-OH-ALI,是一种不稳定的化合物,在水介质中有大约40分钟的半衰期,很容易形成DNA加和物。OATs的抑制剂羧苯磺丙胺可减弱N-OSO3-ALI的肾毒性,是因为N-OSO3-ALI为水溶性不能直接扩散通过细胞膜,必须通过膜运输才可引发肾毒性。动物和体外实验均证实有机阴离子转运蛋白(OATs)参与AAI器官选择毒性和肾消除。此外,N-OSO3-ALI可由肝膜转运蛋白MRP3(Multidrug resistance proteins 3)和MRP4(Multidrug resistance proteins 4),从肝脏的肝细胞转移到血液中。基于器官芯片的研究可以得出肝脏代谢酶从整体上增加了AAI的肾脏毒性。人肝NQO1和SULT协同代谢AAI形成高肾毒性产物N-OSO3-ALI,然后通过MPRs转运体转运出肝脏进入血液,后通过OATs重吸收进入肾脏造成肾损伤(图2)。
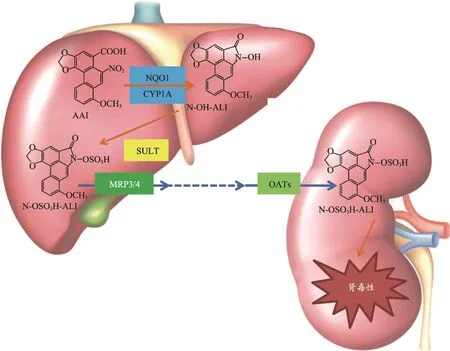
图2 转运蛋白在AAI致毒过程中的作用
4 马兜铃酸肾病的易感机制
AAI肾毒性不仅是中草药使用面临的问题,也是巴尔干地方性肾病(Balkan endemic nephropathy,BEN)的重要致病因素之一。其中的A:T→T:A TP53基因基因突变为马兜铃酸的特征型突变[39]。遗传背景及个体病理生理状况在AA肾毒性易感机制中具有重要作用。因此了解马兜铃酸肾病发生和易感机制,对于预防和干预AAN具有重要意义。
4.1 AAI生物转化代谢酶的遗传多态性
据研究,台湾有超过一半以上的上泌尿道癌(upper urinary track carcinomas,UTUC)病人肾皮质中均有马兜铃酸DNA加和物的存在,进一步证实马兜铃酸DNA加和物可作为马兜铃酸肾病的标志物[40]。虽然,TP53是UTUC患者的特异突变类型,可证明AAI会引起UTUC,但AAI相关的UTUC疾病中只存在将近25%的TP53突变(A:T→T:AT),所以将TP53作为UTUC标志物仍具有一定的局限性。研究还发现:AAI致H-ras基因突变作用发生在5/6肾切除慢性肾衰竭大鼠,而接受AAI的正常大鼠则未发生。提示遗传背景及个体病理生理状况在AAI肾毒性易感机制中具有重要作用。在以上AAI代谢酶中,据报道人NQO1的基因多态性对BEN患者至关重要。NQO1*2(C609T)型NQO1可促进BEN患者上尿路移行细胞恶性肿瘤发展。并且在BEN高风险患者体内会发现CYP3A5*1等位基因G6989[41]。
CYP1A2也有高度遗传多态性,编码基因位于第15号染色体,有7个外显子和6个内含子,由其转录的mRNA总长31210 bp,至少存在4个功能基团核苷酸多态性,主要在肝脏中表达,个体间表达变异程度可达40倍。CYP1A2的个体间差异为2.96-73倍。这种基因差异,引起了个体对AA的不同耐受程度。AAN的易感性除了个体差异,在AAI的偏好和氧化的速率上人类/大鼠CYP1A1和1A2还存在明显的种属差异。其中人类CYP1A1比人CYP1A2对AAI O-去甲基化更有效。
4.2 个体组织氧含量(CYP1A1/2)
由于CYP1A1/2同时参与AAI的活化产毒和代谢解毒过程,人体组织氧浓度会影响AAI在还原活化和氧化解毒两条代谢路径中相对分配比例。利用分子对接,将小分子AAI柔性对接到蛋白质大分子CYP1A1和CYP1A2的活性位点发现,在厌氧条件下,CYP1A1和CYP1A2可以连接AAI作为配体;在富氧情况下,AAI应为CYP1A1和CYP1A2的经典底物,这里需要一分子氧来帮助AAI的甲氧基团去甲基化生成AAIa[42]。说明除CYP1A1和CYP1A2的体内分布,组织中的氧含量会影响体内CYP代谢酶参与的AAI硝基还原活化和氧化解毒的平衡[43]。此外,小分子AAI相对CYP1A1和CYP1A2催化位点的移动的情况同样会影响AAI的代谢。
4.3 药物药物相互作用
药物之间的协同与竞争效应,及药物药物相互作用也会影响AAI的肾毒性。药物间可通过竞争代谢酶和转运蛋白,增加肾脏对低浓度药物或毒素损伤的易感性,也是AA可能易感因素之一。
5 小分子荧光探针揭示马兜铃酸代谢酶活性的潜在价值
遗传背景及个体病理生理状况在AAI肾毒性易感机制中具有重要作用,代谢酶的活性会直接影响AAI在个体内的转化路径和致毒剂量,因此对活体中代谢酶活性的测定会对马兜铃酸的临床使用具有指导性的意义。而受环境因素、遗传因素和疾病等影响,大分子蛋白在组织分布和个体表达存在很大差异,均会会影响AAI在人体的代谢行为的差异。因此,我们需要可以灵敏的、特异的反映代谢酶活性的评价手段。目前的免疫组化方法和蛋白质组学技术,不但耗时耗财,更为重要的是,这些方法只能评价代谢酶的蛋白含量,无法评价其 催化活性,而代谢酶的催化活性才与其代谢能力直接相关。
而小分子探针底物具有选择性高、灵敏度好、操作简单等优势,借助于荧光成像技术研究者能够对活细胞/活体中各种,如离子、有机小分子、生物大分子等目标物进行定位,可从分布、含量、活性等诸多领域原位以及实时观测。现已有CYP1A小分子荧光探针底物NCMN[44]和UGT1A1荧光探针NCHN[45]等已被证实可测定混合体系中目标酶的代谢活性,且拥有良好的检测灵敏度和选择性。而这些荧光探针的在精准医疗中的推广和应用,可帮助解决对有毒中药马兜铃酸的医学使用误区,因人而治,从而制定出配伍严谨的方药趋利避害,达到治疗作用。
6 研究展望
马兜铃酸虽具有肾毒性和致癌毒性。由于部分含马兜铃酸药物的不可替代性,仍有较多人群因服用AA制剂导致AAN。近年来国内外学者临床观察均发现AAN患者个体间易感性存在显著差异。随着实验技术手段的提高,已找出参与AAI活化的关键代谢酶NQO1和CYP1A和转运体OATs,但仍有大量未知区域,如II相代谢酶UGT等在AAI体内代谢的具体参与状况等。近来药物代谢酶特异性荧光探针的研发和微流控-器官芯片的发展,无疑为AAs体内代谢过程和作用机制的研究带来更便捷和有力手段。通过探针底物与酶反应后代谢产物荧光值得强弱,直观反应代谢酶的生物活性;器官芯片的成熟,将帮助我们消减种属差异。以上技术手段应用于马兜铃酸致病机制的研究,将帮助我们深入认识马兜铃酸体内代谢及致毒过程,为马兜铃酸的中药复方配伍提供建议,为马兜铃酸肾病提供新的治疗途径。

