多位点序列分型在新疆人间布鲁氏菌病临床分离株遗传进化研究中的应用
李 博,岳锡宏,崔步云2,黎 唯,刘志国3,尚修建
布鲁氏菌病(Brucellosis,布病)是由布鲁氏菌(Brucella)属细菌侵入机体引起的传染-变态反应性人兽共患传染病,该病不仅严重危害人类健康,且对畜牧业、旅游业、国际贸易的快速发展起到极大的负面影响[1-2]。目前,我国31个省、市、自治区都有布病人畜间流行的报道,截止2015年10月,新疆报告新发病例7 564例,第1次位居全国各省区报告新发病数的第1位,人间布病疫情防控形势极为严峻[3]。
研究人间布鲁氏菌分离株的种群结构和遗传特征是深入了解布病流行机制和菌株遗传进化关系的重要手段,可为布病流行疫区制定有效的防控措施提供科学依据。多位点序列分型(Multiple-locus sequence typing,MLST)是一种通过对研究对象的多个管家基因进行测序,经核苷酸序列逐一比对,发现差异,从而区分细菌型别的分型方法,MLST因具有良好的分辨能力,且分型结果明确,易于不同实验室之间的比较,而被广泛用于细菌分型和遗传特征研究[4]。本研究为了解新疆人间布鲁氏菌的种群特征和遗传进化,选取分离自7个地州人间布病的24株布鲁氏菌和布鲁氏菌标准参考菌株16M(羊种)、544A(牛种)、1330S(猪种)进行MLST分型,选择致病性强的羊种、牛种、猪种、绵阳附睾种等14种生物型代表菌株作为参考株,运用平均连锁聚类法(UPGMA)分析分离株与参考株之间的亲缘关系,同时收集过往研究的186株全国不同地区布鲁氏菌分离株MLST结果,探讨新疆人间布鲁氏菌的种群结构和遗传特征,掌握人间布病流行的优势菌型。
1 材料与方法
1.1菌株信息 24株人间布鲁氏菌病临床分离株系2015、2016年分离自新疆伊犁州、乌鲁木齐市、石河子市、昌吉州、博州、塔城、阿勒泰地区,且全部为羊种3型布鲁氏菌。分离株由中国疾病预防控制中心传染病所布病室分离、鉴定和保存。
1.2仪器与试剂 96孔梯度PCR仪(Sigma 德国),水平电泳槽、电泳仪(北京君意东方电泳设备有限公司)、凝胶成像仪(GelDoc-It310 北京天美科学仪器有限公司);分子生物学试剂、引物合成均由北京擎科新业生物技术有限公司提供。
1.3基因组DNA提取 将试验冻干菌株接种于布鲁氏菌琼脂斜面上进行复苏,经纯培养、抑菌实验以及噬菌体裂解实验鉴定后,收集菌体。采用热灭活方式灭活细菌,然后使用北京天根生物科技有限公司基因组DNA提取试剂盒提取菌株基因组DNA。提取的基因组DNA于-20 ℃保存备用。
1.4引物设计 选择布鲁氏菌9个基因片段作为MLST靶标基因,靶标基因分别为:7个管家基因(gap、aroA、glk、dnaK、gyrB、trpE、cobQ),1个外膜蛋白基因(omp25)和1个基因间区(int-hyp)。靶标基因、引物序列、基因位置和扩增长度等信息可参考文献[5]。
1.5PCR扩增体系与程序扩增体系 Super Mix 20 μL、引物(10 μmol/L)0.5 μL、DNA 1 μL、去离子水18 μL。扩增程序:95 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min。
1.6PCR扩增产物检测与测序 PCR扩增产物用1.5%琼脂糖凝胶电泳检测,检测结果与预期扩增长度一致的样品进行纯化、双向测序并拼接。测序由北京擎科新业生物技术有限公司完成。
1.7序列分析 运用MEGA 6.0软件对分离株的靶标基因测序结果与布鲁氏菌MLST标准等位基因序列进行比对,确定分离株ST基因型。应用BioNumerics 7.5软件进行分离株、标准株、参考株平均连锁聚类法(UPGMA)分析,获得各菌株间亲缘进化关系。
2 结 果
2.1分离株分布特征 临床分离株均分离自新疆布病患者,实验室表型检测均为羊种3型布鲁氏菌。2015年分离7株,2016年分离17株;石河子市4株,乌鲁木齐市2株,昌吉州8株,博州2株,塔城地区3株,阿勒泰地区1株,伊犁州4株。详见表1。
2.2MLST等位基因及ST型比对结果 临床分离株的9个等位基因型均相同,且序列型均为ST8型;3株布鲁氏菌标准参考菌株(16M,544A,1330S)序列型分别为:ST7型,ST1型,ST14型。详见表2。收集由中国疾病预防控制中心传染病所布病室、乌兰察布市地方病防治中心[6]提供的186株全国不同地区布鲁氏菌分离株MLST分型结果,结果显示ST8型是我国主要流行的布鲁氏菌,在新疆、内蒙古、河北、黑龙江、宁夏、陕西、青海、山东、辽宁、四川、广东、上海、海南等省、区均有分布,且以北方地区为主。详见表2。
表1 分离株分布特征Tab.1 Distribution of isolatedBrucella
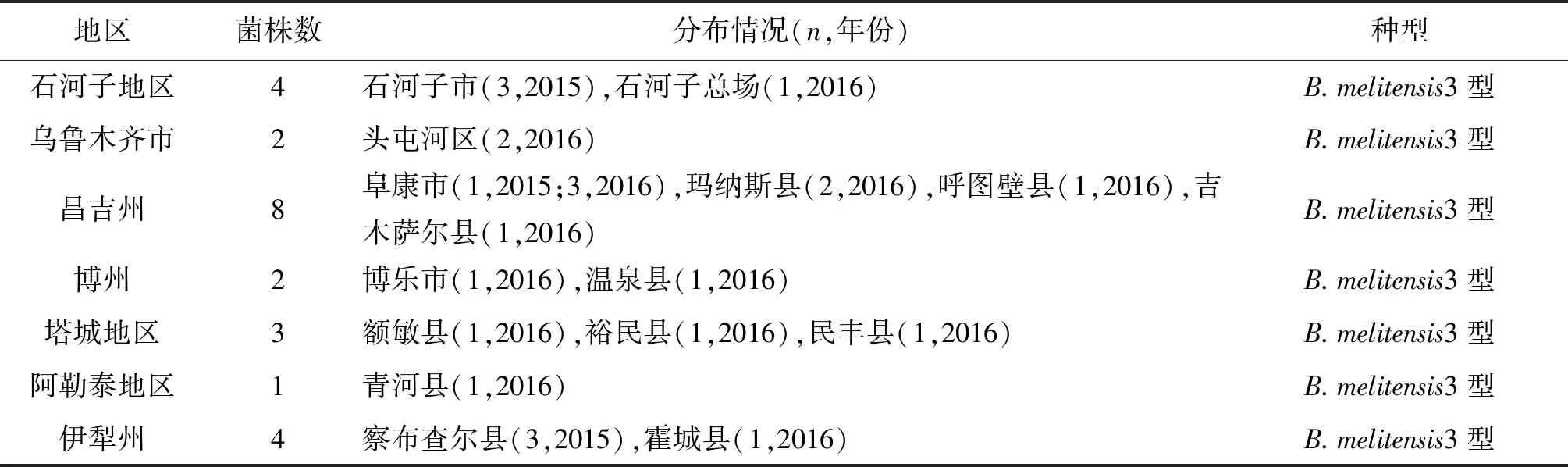
地区菌株数分布情况(n,年份)种型石河子地区4石河子市(3,2015),石河子总场(1,2016)B.melitensis3型乌鲁木齐市2头屯河区(2,2016)B.melitensis3型昌吉州8阜康市(1,2015;3,2016),玛纳斯县(2,2016),呼图壁县(1,2016),吉木萨尔县(1,2016)B.melitensis3型博州2博乐市(1,2016),温泉县(1,2016)B.melitensis3型塔城地区3额敏县(1,2016),裕民县(1,2016),民丰县(1,2016)B.melitensis3型阿勒泰地区1青河县(1,2016)B.melitensis3型伊犁州4察布查尔县(3,2015),霍城县(1,2016)B.melitensis3型
表2 分离株MLST分型结果Tab.2 MLST result of isolated strains
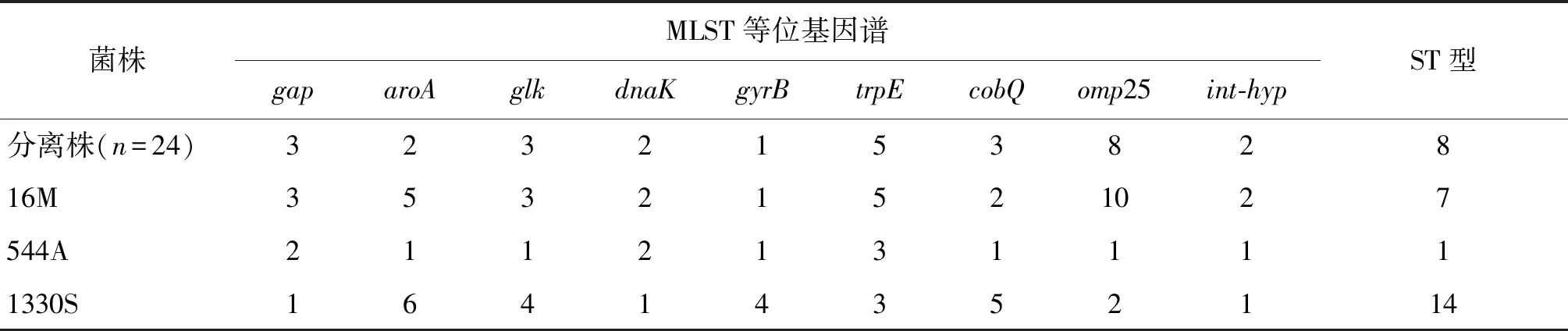
菌株MLST等位基因谱gaparoAglkdnaKgyrBtrpEcobQ omp25int-hypST型分离株(n=24)323215382816M35321521027544A21121311111330S16414352114
表3 全国不同地区布鲁氏菌分离株MLST分型结果Tab.3 MLST results of isolated strains from different provinces in China
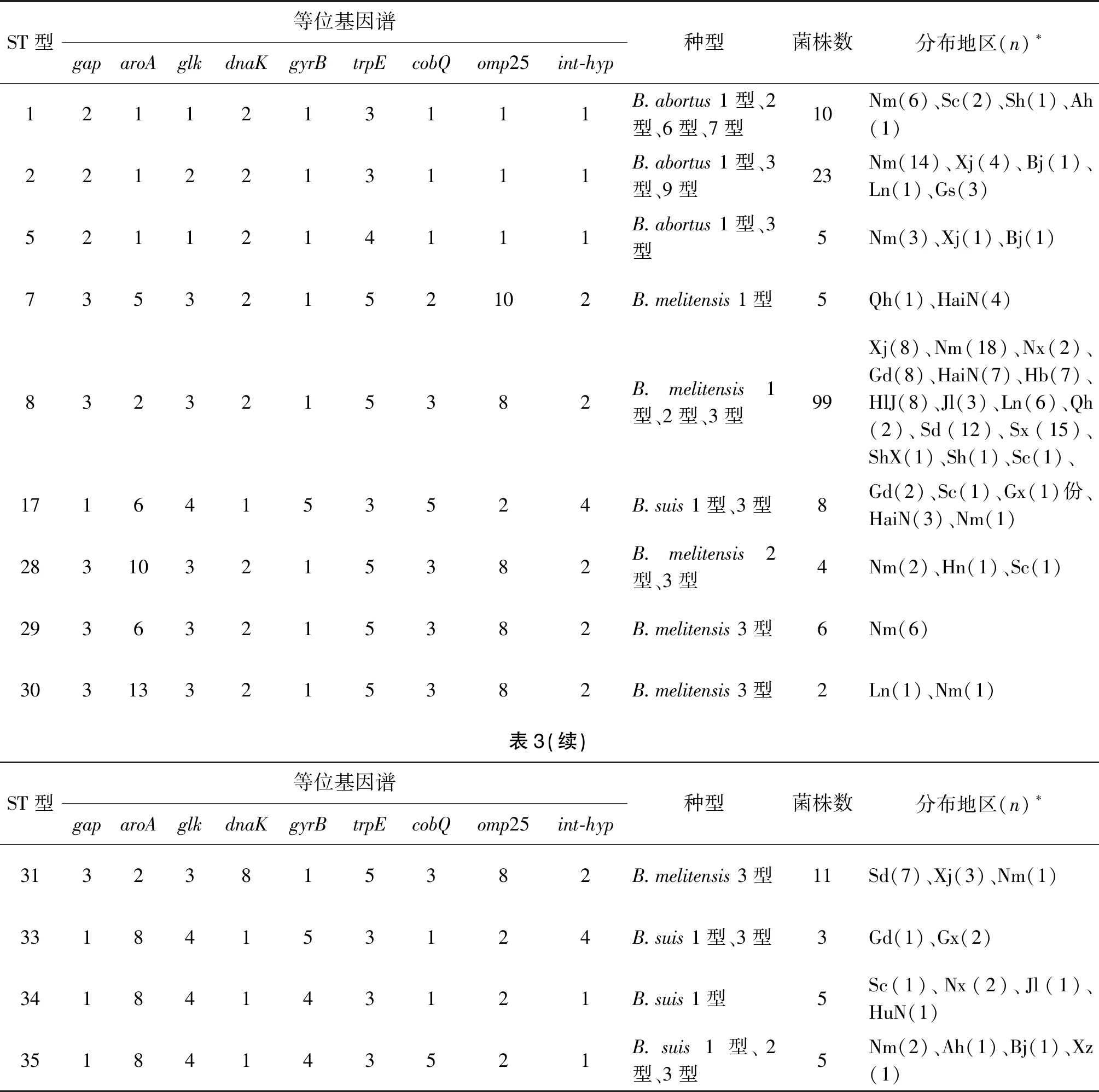
ST型等位基因谱gaparoAglkdnaKgyrBtrpEcobQ omp25int-hyp种型菌株数分布地区(n)∗1211213111B.abortus 1型、2型、6型、7型10Nm(6)、Sc(2)、Sh(1)、Ah(1)2212213111B.abortus 1型、3型、9型23Nm(14)、Xj(4)、Bj(1)、Ln(1)、Gs(3)5211214111B.abortus 1型、3型5Nm(3)、Xj(1)、Bj(1)73532152102B.melitensis 1型5Qh(1)、HaiN(4)8323215382B.melitensis 1型、2型、3型99Xj(8)、Nm(18)、Nx(2)、Gd(8)、HaiN(7)、Hb(7)、HlJ(8)、Jl(3)、Ln(6)、Qh(2)、Sd(12)、Sx(15)、ShX(1)、Sh(1)、Sc(1)、17164153524B.suis 1型、3型8Gd(2)、Sc(1)、Gx(1)份、HaiN(3)、Nm(1)283103215382B.melitensis 2型、3型4Nm(2)、Hn(1)、Sc(1)29363215382B.melitensis 3型6Nm(6)303133215382B.melitensis 3型2Ln(1)、Nm(1)表3(续)ST型等位基因谱gaparoAglkdnaKgyrBtrpEcobQ omp25int-hyp种型菌株数分布地区(n)∗31323815382B.melitensis 3型11Sd(7)、Xj(3)、Nm(1)33184153124B.suis 1型、3型3Gd(1)、Gx(2)34184143121B.suis 1型5Sc(1)、Nx(2)、Jl(1)、HuN(1)35184143521B.suis 1型、2型、3型5Nm(2)、Ah(1)、Bj(1)、Xz(1)
“*”:Xj:新疆、Nm:内蒙古、Sc:四川、Sh:上海、Ah:安徽、Bj:北京、Ln:辽宁、Gs:甘肃、Qh:青海、HaiN:海南、Nx:宁夏、Gd:广东、Hb:河北、HlJ:黑龙江、Jl:吉林、Sd:山东、Sx:山西、ShX:陕西、Gx:广西、Hn:河南、HuN:湖南、Xz:西藏
2.3新疆分离株、标准株、参考株的进化关系分析 24株临床分离株与羊种2型、3型同属ST8型克隆群,该克隆群与羊种ST7、ST9、ST10、ST11、ST12的亲缘关系较近,而与牛种、绵羊种、猪种各ST型处于不同分枝,遗传距离较远;羊种、猪种、绵羊种的各ST型高度集中,并且处于同一进化分枝,表明同种不同生物型的布鲁氏菌亲缘关系较近,不同种布鲁氏菌的亲缘关系较远;B.abortus66与其他牛种菌的遗传距离较远,呈现出一定的遗传多样性,结果见图1。

图1 分离株、标准株与参考株的MLST聚类分析Fig.1 Cluster analysis of isolates,standard strains and reference strains on the MLST
3 讨 论
布鲁氏菌6个生物种和19个生物型因其致病力不同,造成对人体致病性的差异,其中羊种布鲁氏菌致病力最强,牛种、猪种菌致病力次之,这3种布鲁氏菌是导致人和动物间布病传播的重要病原体[7-8]。因此,掌握布鲁氏菌分离株的生物种型即成为有效控制和治疗人间布病的重要手段和前提条件。传统表型分类方法是根据分离培养物是否需要CO2,H2S是否产生,以及染料抑菌、单相特异性血清凝集试验和噬菌体裂解等特点进行布鲁氏菌种型鉴别,但该方法耗时长、操作繁琐、干扰因素多和生物安全风险大,造成其无法满足突发布病公共卫生事件的应急处置需求。近年来,随着分子生物学技术的不断发展,AFLP、PFGE、HOOF和Rep-PCR等分型技术被广泛用于布鲁氏菌基因分型和遗传进化研究[9-11],但从实际应用来看,上述技术因布鲁氏菌基因组高度保守、不同生物种型间的同源性较高,导致分辨率低,从而难以区分菌株之间的亲缘关系。
MLST技术可直接测定多个管家基因的核苷酸序列,根据序列测定结果确定一个等位基因编号,试验菌株的各等位基因编号按照一定顺序排列,形成菌株等位基因谱,等位基因谱代表了一组核苷酸序列信息,进而能够准确记录菌株在基因水平上的差异。1998年,Maiden等[12]首次将该MLST技术应用到脑膜炎奈瑟菌分型,该技术以准确、分辨率高、可重复性好等优点,被广泛地应用于其他病原微生物的分型。Whatmore等[13]运用MLST方法对布鲁氏菌7个看家基因和2个非看家基因进行扩增,通过确定等位基因谱,将30个国家、地区的160株布鲁氏菌分为27个ST型,且各ST型与传统表型分型的结果基本一致。Chen YF等[14]对中国60株布鲁氏菌进行MLST分型,新发现9个ST型。上述研究表明MLST技术可作为研究布鲁氏菌基因分型的重要手段,通过区分菌株间的进化关系,达到追踪溯源的目的。
本研究结果显示24株分离株均为ST8型,与先前分离自新疆的羊种菌进化程度相同,表明新疆主要流行ST8型羊种布鲁氏菌,流行菌株种型单一,菌株的管家基因、外膜蛋白基因遗传较保守。收集、分析不同地区186株布鲁氏菌MLST结果,发现我国布鲁氏菌同样以ST8型菌流行为主,且以北方地区为重点流行区域,新疆人间布鲁氏菌与内蒙古、宁夏、河北、山东、青海、辽宁、陕西、四川、上海等地的分离株为同一型别,在进化树中处于同一分支,揭示了新疆人间流行株可能是由内蒙古、宁夏、河北、山东等地引进的繁育羊所携带,通过人与羊密切接触,导致了输入性感染和流行。而本研究中各临床分离株MLST分型高度聚集的结果却与既往研究存在一定差异,一方面是随着新疆畜间防控的不断深入,染疫动物净化、免疫接种措施的广泛实施,促使牛种布鲁氏菌流行得到较为有效的控制,由早期以牛、羊种布鲁氏菌为主的流行模式逐渐转变为以羊种布鲁氏菌流行为主。另一方面是不同基因分型方法的应用造成了差异结果,且MLST方法可能存在一定的局限性,对同种不同生物型的布鲁氏菌较难区分。同时,研究结果揭示了MLST分型方法虽然能够在种的层面鉴别布鲁氏菌,但却不能有效区分各生物型,同种不同生物型可被聚为一类ST型,且局部地区的少量样本(分离株)难以被区分,因而MLST分型方法只能作为布鲁氏菌分子分型的补充手段。
本研究选取的临床菌株分离自伊犁州、乌鲁木齐市、石河子市、昌吉州、博州、塔城和阿勒泰地区,上述地区覆盖了新疆北部全部行政区域,作为新疆主要畜牧养殖地,7个地(州、市)的人间布病发病率多年居全疆前列[15],霍城、额敏等县在近年存在不同程度的人间布病暴发流行,因此研究结果具有一定的代表性和参考价值,且与相关研究结果一致,均表明ST8型布鲁氏菌在国内具有广泛的分布,尤其在北方地区普遍流行[6,16-17]。羊种布鲁氏菌是一种强致病性病原菌,能引起广泛的动物间流行,并对人感染构成极大威胁[18],根据研究结果,新疆人间布病感染源主要是染疫羊只,做好羊布病的防控是防范人间布病流行的关键。动物间应加强输入羊的检诊检疫、强化感染羊的管控,做好羊的疫苗免疫和净化工作;人间布病防控应加强重点防控人群的宣传教育,遵循早诊断、早治疗、足量、足疗程的治疗原则,强化“三位一体”、医防结合建设;检测实验室应推广ELISA、实时荧光定量PCR和MLVA、全基因组测序等检测、分型技术,以有效应对突发公共卫生事件的应急处置。
利益冲突:无
引用本文格式:李博,岳锡宏,崔步云,等.多位点序列分型在新疆人间布鲁氏菌病临床分离株遗传进化研究中的应用[J].中国人兽共患病学报,2019,35(5):411-415,439.DOI:10.3969/j.issn.1002-2694.2019.00.042

