牛种布鲁氏菌2308强毒株dsbG基因缺失突变株的构建与初步评价
3
布鲁氏菌病是一种由布鲁氏菌(Brucella)引起的流行范围广的人兽共患传染病之一,是《中华人民共和国传染病防疫法》规定的乙类传染病[1]。人类感染布鲁氏菌病主要表现为波状热、盗汗、关节炎,甚至导致不孕不育等;公畜感染易引起睾丸炎,怀孕母畜感染易导致流产[2]。布鲁氏菌病在世界各地都有发生,给畜牧业发展和人类健康带来了严重威胁。因此,对该病的研究受世界各国学者的高度重视[3]。
布鲁氏菌是兼性胞内寄生的革兰氏阴性菌,呈球形或短杆状,菌体长0.6~1.5 μm,宽0.5~0.7 μm,其主要寄生于巨噬细胞和胚胎滋养层细胞[4-5]。近年来,对布鲁氏菌毒力因子的研究已成为国内外学者研究的重点,布鲁氏菌无经典的毒力因子,其毒力与侵入宿主细胞、抵抗宿主细胞杀伤作用以及胞内生殖有关[6]。
DsbG是最早显示具有一般分子伴侣活性的周质蛋白之一,这种陪伴蛋白质折叠的能力可能增加DsbG作为蛋白质二硫键异构酶的有效性[7]。本研究小组前期利用蛋白质组学研究发现;DsbG在布鲁氏菌毒力株2308和疫苗株RB51之间的表达存在差异,因此,本研究以布鲁氏菌2308毒力株的dsbG基因为基础,以布鲁氏菌2308作为研究对象,利用抗性替代构建差异表达蛋白DsbG的基因突变株,研究其遗传稳定性和生长状态,并研究其在HPT-8细胞中的存活和繁殖能力,为探索布鲁氏菌潜在毒力因子奠定基础,为进一步揭示布鲁氏菌感染与怀孕母畜流产之间的分子机制提供理论依据。
1 材料和方法
1.1 材 料
1.1.1菌株和细胞 牛种布鲁氏菌2308毒力株购自中国兽医药品监察所;RB51疫苗株由中国农业大学吴清民教授惠赠;pUC19K载体由北京军事医学科学院惠赠;人胚胎滋养层细胞(HPT-8)由石河子大学动物科技学院人兽共患传染病实验室保存;大肠埃希菌(Escherichiacoli, DH5a)、pMD19-T simple载体购自TaKaRa公司。
1.1.2试剂 DMEM培养基、胎牛血清购自Gibco公司;硫酸庆大霉素购自河南辅仁怀庆制药有限公司;0.22 μmol/L滤器购自美国Milipore公司;细胞培养板购自COSTAR公司;BrucellaBroth培养基和BrucellaAgar培养基购自美国BD公司;质粒小提取试剂盒和dNTP购自Tiangen Biochemical Technology Co., Ltd.;其他试剂均为国产分析纯。
1.2 方 法
1.2.1引物设计与合成 利用Primer Premier 5.0软件设计相应引物,送华大基因合成,引物序列见表1。
表1 引物和序列Tab.1 Primer and sequences
primerPrimer sequences (5′-3′)dsbG-N-FTGTAGGCAGCAGGATTGATGAdsbG -N-RGACATTCATCCCAGGTGGCAGATATCG-GTCGCGCCCGGCTGdsbG -C-FTCTGGGGTTCGAAATGACCGGCCGATAAT-ACCGCTCGCTATdsbG -C-RTGATGCTGACAGGCACGAAdsbG-I-FTTACTTCTTTGCAGCGTCCCdsbG -I-RTTGGTTGCGCATGGTATCGGdsbG -E-FAGGCAGCAGGATTGATGAGGdsbG -E-RAACAGATGAAGCCGGGAACKan -FGCCACCTGGGATGAATGTCKan -RCGGTCATTTCGAACCCCAGA
1.2.2布鲁氏菌dsbG突变株自杀载体的构建 以牛种布鲁氏菌2308的DNA为模板,以dsbG-N-F和dsbG-N-R为引物扩增dsbG基因的N端同源臂和以dsbG-C-F和dsbG-C-R为引物扩增其C端同源臂,以pUC19K质粒为模板,以Kan-F和Kan-R作为引物扩增卡那霉素抗性片段。通过融合PCR技术,对dsbG基因的N端同源臂、卡那霉素抗性片段和C端同源臂进行融合扩增。回收融合片段产物并连接到pMD19-T载体上,转化到DH5a感受态细胞中,通过PCR鉴定,并送生工生物工程股份有限公司进行测序。
1.2.3布鲁氏菌dsbG突变株的构建 将质粒pMD-DK-Kan电转化到2308感受态细胞中,活化后涂于带卡那霉素抗性的布鲁氏菌固体培养基,于37 ℃恒温培养箱中倒置培养48~72 h,挑取单个细菌,分别用卡那霉素替换目的基因的内、外部鉴定引物进行PCR鉴定,获得2308ΔdsbG突变株。
1.2.4布鲁氏菌2308ΔdsbG突变株的遗传稳定性检测 将初步筛选获得的布鲁氏菌2308ΔdsbG突变株反复传代培养10代后,通过内、外部检测引物对2308ΔdsbG突变株进行PCR鉴定和遗传稳定性检测。回收外部引物获得的基因片段送至华大基因测序。
1.2.5布鲁氏菌亲本株和突变株生长曲线测定 布鲁氏菌2308、RB51和2308ΔdsbG突变株在相同起始浓度下,于37 ℃,170 r/min条件下培养。间隔2 h取样1次,检测OD600的变化,直到细菌进入平台期,并绘制2308、RB51和2308ΔdsbG突变株的生长曲线。
1.2.6布鲁氏菌侵染HPT-8细胞形态学观察 分别用对数生长期的布鲁氏菌2308、RB51和2308ΔdsbG突变株按200∶1感染复数侵染HPT-8细胞,24 h后弃去培养液,用PBS漂洗3次,并与含有50 μg/mL庆大霉素的液体培养基共孵育60 min,以杀死胞外的布鲁氏菌,用倒置显微镜观察细胞的形态学变化。
1.2.7布鲁氏菌粘附侵袭实验 分别使用布鲁氏菌2308、RB51和2308ΔdsbG突变株按200∶1感染复数侵染HPT-8细胞,并在5% CO237 ℃环境中共孵育10 min、20 min、40 min、60 min、90 min和120 min后,用PBS漂洗3次,除去未粘附的细菌,再与含有50 μg/mL庆大霉素的DMEM培养液共孵育60 min以杀死胞外菌。用0.2% Tritonx-100裂解细胞,稀释后涂于布鲁氏菌固体培养基。3~5 d后,通过计算CFU,比较2308、RB51和2308ΔdsbG突变株的粘附侵袭能力。
㊸ E.H.Gombrich,“ An early seventeenth-century canon of artistic excellence:Pierleone Casella's elogia illustrium artificum of 1606”,Journal of the Warburg and Courtauld Institutes,vol.50,1987,pp.224-32.
1.2.8布鲁氏菌胞内繁殖实验 分别用布鲁氏菌2308、RB51和2308ΔdsbG突变株按200∶1的感染复数侵染HPT-8细胞,60 min后,用庆大霉素杀死胞外菌,分别在0 h、4 h、8 h、12 h和24 h弃去培养液,PBS漂洗3次。用0.2% Tritonx-100裂解细胞,稀释后涂于布鲁氏菌固体培养基,3~5 d后,通过计算CFU,比较并分析布鲁氏菌2308、RB51和2308ΔdsbG突变株的胞内繁殖能力。
1.2.9统计学分析 利用SPSS Statistics 17.0分析软件对实验数据进行统计学分析,P<0.05为有统计学意义。
2 结 果
2.1布鲁氏菌dsbG基因突变株的构建
2.1.1dsbG基因同源臂及卡那霉素抗性基因的扩增 以金属浴灭活的布鲁氏菌2308为模板,PCR扩增dsbG基因的上、下游同源臂序列,分别获得约为500 bp(图1A)和399 bp(图1B)的片段;以pUC19K质粒为模板,扩增卡那霉素抗性片段,获得大小约为1 093 bp的片段(图1C);获得条带大小与预期值相符。

A: M,DNA marker;1,阴性对照; 2~3,dsbG-N PCR产物B: M,DNA marker;1,阴性对照; 2~3,dsbG-N PCR产物C: M,DNA marker;1,阴性对照; 2~5,Kan PCR产物图1 dsbG基因同源臂及卡那霉素抗性基因的PCR扩增Fig.1 PCR amplification of the dsbG gene homology arm and kanamycin resistance gene
2.1.2dsbG基因同源臂和卡那霉素抗性基因的融合 通过融合PCR技术将上述3个基因片段进行融合扩增,获得大小约为1 992 bp的基因片段,其与dsbG基因上下游同源臂片段和卡那霉素抗性基因片段预期叠加相符(图2)。
2.1.3布鲁氏菌dsbG突变株载体的构建及鉴定 将pMD19-T载体连接到融合片段上,并转化至DH5a感受态细胞中,获得同源重组载体pMD19-T-ΔdsbG-K(1 992 bp), PCR验证结果与叠加片段大小相同(图3)。
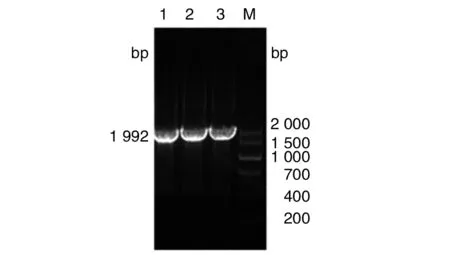
M: DNA marker; 1~3: dsbG-N-K-C 融合PCR产物图2 dsbG-N-K-C融合PCR扩增 Fig.2 dsbG-N-K-C fusion PCR amplification

M: DNA marker;1: 阴性对照;2~4:pMD19-T-ΔdsbG-Kan PCR产物图3 同源重组载体pMD19-T-ΔdsbG-Kan 的菌液PCR鉴定Fig.3 Identification of pMD19-T-ΔdsbG-Kan was amplified via PCR
2.2布鲁氏菌2308ΔdsbG基因突变株的初步筛选及鉴定 使用dsbG-N-F和Kan-R鉴定引物分别对2308ΔdsbG突变株和2308亲本株进行扩增,结果显示: 2308ΔdsbG突变株可扩增出预期大小相符(1 593 bp)的特异片段,而2308亲本株扩增为阴性,如图4所示:表明抗性基因正确替代了dsbG基因。

M: DNA marker;1: 阴性对照;2: 2308对照;3~5:检测菌液图4 2308ΔdsbG的筛选鉴定Fig.4 Screening and identification of 2308ΔdsbG
表2 检测引物及片段长度
Tab.2 Detection primer and fragment length

检测引物敲除前大小/bp敲除后大小/bpdsbG internal detec-tion primerdsbG-I-FdsbG-I-R7530dsbG external detec-tion primerdsbG-E-FdsbG-E-R1 4001 740
结果显示:构建的基因缺失株在缺失前后所扩增的片段与理论值相符,外部引物获得基因经测序后比对序列,同源性为100%,表明成功获得了2308ΔdsbG基因缺失株,并且在连续培养10代后未观察到回复现象,即2308ΔdsbG突变株可进行稳定遗传,如图所示(5A、B)。

A:M,DNA maker; 1,阴性对照; 2,S2308; 3,PMD19-T-ΔdsbG-Kan 质粒对照;4~13,S2308ΔdsbG基因突变株B:1,阴性对照; 2,S2308; M,DNA maker; 3~12,S2308ΔdsbG基因突变株图5 布鲁氏菌S2308ΔdsbG的遗传稳定性检测Fig.5 Genetic stability detection of Brucella S2308ΔdsbG
2.4突变株和亲本株的生长曲线分析 绘制布鲁氏菌2308、RB51和2308ΔdsbG突变株的生长曲线(图6)。从生长曲线可以看出,这些菌株的生长趋势相似,并且同一时间点菌液浓度仅存在细微差异。

图6 布鲁氏菌生长曲线Fig.6 Growth curve of Brucella strains
2.5胚胎滋养层细胞形态学观察 布鲁氏菌2308、 RB51和2308ΔdsbG突变株侵染HTP-8细胞后,使用倒置显微镜观察侵染前后的细胞形态变化。如图7所示:我们观察到正常细胞呈多边形,培养48 h后成片状或簇状生长,用布鲁氏菌2308侵染后的细胞呈圆形、皱缩现象较为严重,间隙变宽,有少量的细胞脱落和碎片。然而用RB51和2308ΔdsbG突变株侵染后的细胞易出现聚合现象,边界模糊,并伴有轻微脱落。
2.6布鲁氏菌的粘附侵袭能力 不同时间点的布鲁氏菌2308、RB51和2308ΔdsbG突变株侵入HPT-8细胞的数量有所差异。如图8所示:随着时间延长,进入细胞的布鲁氏菌数量逐渐增加,各菌株约在60 min后侵入细胞的数量接近饱和不再增加。2308ΔdsbG突变株在每个时间点的粘附侵袭能力显著低于亲本株2308和疫苗株RB51(F=1.201,P<0.05)。

A:2308组;B:RB51组;C:2308ΔdsbG组;D:PBS组图7 胚胎滋养层细胞侵染前后的变化Fig.7 Change of the trophoblast cell infected with different Brucella

注:*代表P<0.05图8 布鲁氏菌对胚胎滋养层细胞的粘附侵袭能力Fig.8 Invasive ability of Brucella in HPT-8
2.7布鲁氏菌的胞内繁殖能力 布鲁氏菌2308、RB51和2308ΔdsbG突变株在HPT-8细胞内具有不同的生存复制能力。如图9所示:侵染后各时间点2308ΔdsbG突变株的胞内存活能力显著低于亲本株2308和疫苗株RB51(F=8.627,P<0.05)。

注:*代表P<0.05图9 布鲁氏菌的胞内存活能力Fig.9 Intracellular survival ability of Brucella
3 讨 论
布鲁氏菌虽无典型的毒力因子,如外毒素、质粒、菌毛、荚膜等,但它具有较强的致病性,特别是对怀孕母畜,常引起怀孕母畜流产[8]。主要原因是布鲁氏菌对怀孕母畜胎盘具有较强的亲嗜性,胎盘中的赤藓醇有助于布鲁氏菌生长,而布鲁氏菌能够侵入胚胎滋养层细胞,胚胎滋养层细胞是母体和胎儿联系的纽带,一旦受损,就会导致怀孕母畜流产, 这可能是布鲁氏菌能够引起怀孕母畜流产的发病机制之一,其具体分子机制还需做进一步研究[9]。前期本课题组对2308强毒株和RB51疫苗株的差异蛋白组学进行研究,发现了多个差异表达蛋白,如DsbG等,RB51疫苗是通过2308强毒株体外传代筛选后获得的弱毒疫苗株,其与2308强毒株的差异表达蛋白对毒力因子的挖掘具有重要意义。
已有研究表明,氧化还原物是布鲁氏菌的关键毒力因子之一,如cydB、narG和norE等;Dsb蛋白家族是可溶性的巯基二硫键氧化还原酶[10]。Dsb蛋白质不仅在调制细菌分泌中发挥作用,而且影响着膜蛋白质折叠过程中二硫键的形成和重排[11]。DsbG是Dsb蛋白家族的成员之一,有二硫键异构酶和分子伴侣活性。有研究表明DsbG在催化折叠或部分折叠蛋白质的二硫键重排中占优势[11]。在细胞周质中,DsbG在新易位蛋白的氧化方面优先于DsbA或DsbC的氧化。因此对布鲁氏菌dsbG基因功能的探索有助于明确其在毒力和致病性中的作用。
在本研究中,我们成功构建了2308ΔdsbG突变株,发现dsbG基因的缺失影响布鲁氏菌对宿主细胞的致病性。布鲁氏菌可侵入胚胎滋养层细胞,并引起其形态发生改变;对不同时间段进入胚胎滋养层细胞内的布鲁氏菌数量进行分析发现,dsbG基因缺失后,进入细胞内的布鲁氏菌数量显著低于亲本株,说明该基因可能是调控布鲁氏菌侵入胚胎滋养层细胞的关键分子之一,如需确定该基因所发挥的具体功能,还需在细胞实验(如小鼠巨噬细胞)和动物实验进行进一步的探索和研究。本研究选用胚胎滋养层细胞对布鲁氏菌dsbG基因进行研究,有利于布鲁氏菌流产机制的阐述,也为进一步解析布鲁氏菌的致病机制和新型疫苗的开发奠定了基础。
利益冲突:无
引用本文格式:杨宁宁,徐明国,张欢,等.牛种布鲁氏菌2308强毒株dsbG基因缺失突变株的构建与初步评价[J].中国人兽共患学报,2019,35(5):370-375.DOI:10.3969/j.issn.1002-2694.2019.00.047

