噬菌体展示布鲁氏菌蛋白文库构建及差减筛选融合蛋白
布鲁氏菌病(简称布病)是由布鲁氏菌引起的一种人兽共患病,感染动物表现睾丸炎、不孕、不育、流产等症状,人类感染为波浪热、关节炎、脾脏肿大,也可引起生殖系统障碍[1-2]。布病严重影响动物生产性能和产品品质,对畜牧业的生产和健康发展带来重大损失。近年来在我国北方部分地区、特别是牧区出现上升趋势,严重影响畜牧业发展和农牧民身体健康[3-4]。该病治疗效果较差,以预防为主。故建立快速、准确诊断方法是控制、净化布病的必要手段。
目前布病的检测方法主要有病原学检测、血清学检测及分子生物学检测。现以血清学方法最为成熟,常用的方法有平板凝集(RBT)、试管凝集(SAT)、补体结合实验(CFT) 、ELISA等。其中RBT由于操作简单,但敏感性、特异性均不高,而广泛地被用作现场的大规模初筛性试验;SAT虽然能用于定性检测,但主要检测血清中的IgM, 由于IgM在血清中存在时间较短、含量也不如IgG高等原因,导致该方法敏感性、特异性也不高;CFT也能用于定性检测,但由于操作繁琐、耗时长也不常被采用。ELISA由于其快速、操作简单,在国际贸易中被世界动物卫生组织(OIE)规定为检测布病的指定方法,被公认为是一种比较有前途的方法。但是血清学方法检测的是菌体表面的脂多糖(lipopolysaccharide, LPS),布鲁氏菌的LPS与伤寒沙门氏菌、副伤寒沙门氏菌、霍乱弧菌、小肠耶尔森菌O∶9等存在相似结构,故在诊断中存在假阳性[5]。因此,新型诊断抗原的研制是建立ELISA方法的关键。
布鲁氏菌表面蛋白具有较强的免疫原性,而且在布鲁氏菌各个种间具有高度的保守性,以表面蛋白作为诊断抗原不容易和其他细菌,如大肠杆菌、小肠耶尔森菌等发生交叉反应,减少假阳性[5-7]。很多表面蛋白,如omp25、 omp28、omp31和bp26都曾被用做诊断抗原研究,但究竟哪个/些表面蛋白的特异性强、敏感性高,目前仍在探索。
由于噬菌体展示技术可以构建大容量文库并具有高通量筛选等特性,本研究利用噬菌体展示技术构建布鲁氏菌蛋白文库,通过差减筛选,选择具有良好特异性、亲和力及反应原性的表面蛋白,为确定诊断用抗原奠定基础。
1 材料与方法
1.1材料 TG1大肠杆菌(广州碧云天生物有限公司);羊型布鲁氏菌16M株(标准热灭活,本室保存);辅助噬菌体VCSM13(海军总医院周丽君教授惠赠);噬菌粒载体pYW01(梅西大学Jasna教授惠赠)。 VCSM13及pYW01经测序鉴定,序列全部正确。
Taq Master Mix、细菌基因组提取试剂盒、胶回收试剂盒、DNA Marker(康为世纪公司);T4 DNA ligase、末端快速补平试剂盒、SmaI内切酶、虾碱性磷酸化酶(NEB公司);超声波细胞粉碎仪(新芝SCIENTZ-IID型);电转仪(BIO RAD公司)。噬菌粒载体pYW01引物由长春库美生物科技有限公司合成,上游引物5′- AACATATGAAATACCTGCTGCCGAC-3′,下游引物5′- TCTTCCTCAGAGATCAGCTTCTGCT-3′。
1.2 噬菌体展示布鲁氏菌16M株基因组文库构建
1.2.1布鲁氏菌16M株基因组提取及基因组片段化 以布鲁氏菌16M株菌液(经热灭活)为模板,利用细菌基因组提取试剂盒提取16M株基因组,具体操作按试剂盒进行。
将超声条件设定为输出功率40%,每次超声3 s,间隔6 s,超声次数为10下,超声DNA总体积约500 μL,将基因组DNA随机打断。利用胶回收试剂盒对线性片段回收,以除去小于200 bp大于3 000 bp的片段。
1.2.2破碎基因组片段末端补平 将细菌基因组超声片段进行随机片段末端平齐化,体系如下:DNA随机片段38 μL、T4 DNA polymerase 1 μL、10×T4 DNA polymerase reaction buffer 5 μL、dNTP Mixture 2 μL、H2O 4 μL,11 ℃反应20 min,70 ℃灭活10 min。补平后利用胶回收试剂盒对其进行纯化,准备连接。
1.2.3酶切质粒pYW01及去磷酸化SmaⅠ单酶切噬菌粒载体pYW01,体系如下:10× buffer 5 μL、SmaI 1 μL、pYW01 30 μL,Water 14 μL。25 ℃,反应5 h。然后利用虾碱性磷酸酶(rSAP)直接进行去磷酸化,以防止载体自连,即直接在酶切反应结束后的体系中加入rSAP 1.5 μL,37 ℃温育60 min后65 ℃热灭活20 min。去磷酸化后胶回收试剂盒进行纯化,准备连接。
1.2.4感受态细胞制备 取1 mL TG1母液接种到200 mL新鲜的LB培养液中,37 ℃,170 r/min 振荡培养2.5 h,使OD450达到0.7左右。冰浴30 min,4 000 r/min,4 ℃离心20 min,弃上清收集菌体。用含有10%甘油的无菌水洗涤菌体2次。最后用400 μL 10%甘油无菌水重悬细胞沉淀,分装,每管100 μL,-80 ℃保存备用。
1.2.5连接 利用T4 DNA ligase将末端补平的布鲁氏菌16M株基因组超声片段和酶切质粒pYW01(去磷酸化)以4∶1比例(摩尔比)进行连接,体系如下:DNA随机片段12 μL、pYW01 1 μL、T4 DNA ligase 1 μL、10×ligation buffer 2 μL、H2O 4 μL。22 ℃连接1 h 后70 ℃热灭活5 min。
1.2.6电转化 将连接产物20 μL电转化至100 μL 感受态细胞中。(冰浴条件下,将连接产物和感受态细胞用枪头缓慢混合均匀)电转化条件为:1 mm电击槽、电压1 800 V、电阻200 Ω、电容25C,同时将2 μL 噬菌粒载体pYW01转入100 μL TG1中作为对照,以检测感受态转化效率。电转完成后立即加入900 μL LB液体培养基,震荡活化45 min(37 ℃,170 r/min),此即为噬菌体展示布鲁氏菌16M株基因文库。
1.3基因文库容量计算及随机性检测 取上述10 μL连接菌液用LB液体培养基稀释至100 μL,均匀涂布于LB固体培养基(20 μg/mL氯霉素)37 ℃过夜培养。观察各平板菌落形成数量,以公式计算库容量(cfu/mL)=菌落数×稀释倍数×10。
随机挑取菌落,LB液体培养基(20 μg/mL氯霉素)摇动约6 h,取菌液行PCR,鉴定文库插入效率。 PCR体系如下:上、下游引物各0.5 μL,Taq Master Mix 5 μL,菌液1 μL,用水补足体积至10 μL。 Touch-down PCR运行程序:94 ℃ 1 min, 94 ℃ 30 s, 65 ℃ 30 s,72 ℃ 30 s, 72 ℃ 10 min。 其中退火温度从65 ℃依次降落到50 ℃,温度每降落一度运行两个循环,最后50 ℃运行10个循环,共计40个循环,1%琼脂糖电泳检测结果。
1.4 噬菌体展示布鲁氏菌16M株蛋白文库构建
1.4.1辅助噬菌体滴度检测 10 μL辅助噬菌体VCSM13 用LB液体培养基10倍稀释,稀释成10-1~10-1010个稀释度。分别取100 μL(10-6、10-8、10-10)稀释辅助噬菌体和新鲜培养的宿主菌(TG1)100 μL混合均匀后,加入5 mL软琼脂混匀后快速倒入已预热的LB固体培养基中(20 μg/mL氯霉素),37 ℃倒置培养12~16 h。具体操作按照文献进行[8],噬菌体滴度(pfu/ mL)=斑数×稀释倍数×10。
1.4.3纯化噬菌体蛋白文库 上述培养物,室温4 000 r/min 离心10 min;弃上清,用100 mL LB培养基重悬沉淀,加入卡那霉素使其终浓度达到50 μg/mL,37 ℃培养过夜;次日将菌液 4 000 r/min 离心 20 min,将上清转移至无菌离心管内,分别加入1/4 体积的PEG8000- NaCl溶液,剧烈摇晃后,4 ℃过夜放置,沉淀噬菌体;4 ℃,10 000 r/min 离心 30 min;弃上清,用 3 mL PBS 重悬沉淀,即为辅助噬菌体包装后的展示蛋白文库,0.22 μm滤膜过滤除菌即得到纯净的噬菌体悬液。
1.4.4测序鉴定蛋白文库 利用质粒小提试剂盒提取此悬液质粒DNA,电转化至TG1感受态细胞,条件同1.6.2。将转化菌液涂布于含氯霉素的LB平板上,37 ℃过夜培养,随机挑取20个单克隆送公司测序。将测序序列与GenBank中16M株序列比对,鉴定蛋白文库。
1.5 差减淘选
1.5.1差减筛选 将噬菌体展示文库作为流动相,将M5免疫羊血清作为固定相。将免疫血清包被在孔内,加入噬菌体展示蛋白文库,二者进行吸附。以未被吸附的噬菌体展示文库作为流动相,阳性血清作为固定相。提前将阳性血清包被在孔内,加入免疫血清未吸附的噬菌体展示蛋白文库,进行淘选。对差减淘选的噬菌体文库进行2轮富集。
1.5.2扩增阳性克隆,测序 ① 对淘选到的阳性克隆进行扩增:挑取每个单克隆转接至新鲜2×YT液体培养基中,37 ℃振荡培养过夜。再转接TG1菌液中,培养至OD=0.4左右后,加入辅助噬菌体VCSM13d3(MOI=1∶100)超感染,以扩增单个阳性克隆噬菌体文库。② 用质粒小量抽提试剂盒提取重组质粒,操作方法按说明书进行。③ 对阳性重组质粒进行Touch-down PCR鉴定,分析插入片段大小;对鉴定阳性的质粒送公司测序。
1.6噬菌体阳性克隆筛选 竞争ELISA、Western-blot评价阳性克隆的亲和力、特异性及反应原性,筛选具有良好抗原性的噬菌体阳性克隆。① 提取LPS,按试剂盒操作进行;② 竞争ELISA评价阳性克隆的亲和力:以筛选到的噬菌体融合蛋白包被,以提取16M株LPS作为竞争相,检测阳性克隆的亲和力;并利用prism软件分析阳性克隆亲和力;③ Western-blot评价阳性克隆的特异性及反应原性,DS-PAGE检测:取纯化后的噬菌体融合蛋白进行SDS-PAGE电泳,同时以辅助噬菌体VCSM13作为阴性对照。转膜:剪下和凝胶大小吻合的6 张3M滤纸和1张PVDF膜(戴手套操作),PVDF膜先在甲醇溶液中浸泡15 s,转入去离子水中漂洗后,连同3M滤纸转入半干转印缓冲液中,浸泡30 min。将胶用去离子水冲洗后,也放在半干缓冲液中平衡。然后将胶、膜、滤纸制成三明治,注意每一层都不能有气泡,否则影响转印效果。叠好后,根据膜的大小,来确定转印时电流的大小(具体条件的设定参考仪器说明书)。本试验采用200 mA电流下转印60 min。
免疫检测:转印完成后将膜用丽春红染色,看胶上的目的条带是否转到膜上;然后用蒸馏水漂洗膜,用10%马血清封闭1 h后,用PBS洗涤3次,每次5 min;然后用新鲜配置的一抗(阳性血清)室温封闭膜70 min,再用PBST漂洗3次,每次5 min;用新鲜配置的二抗(兔抗羊血清)封闭膜35 min,洗膜3次,操作同上,然后再用PBS洗涤1次,3 min;用DAB染色3~5 min至膜上的条带清晰后,用蒸馏水终止反应。
应采取多种营销方式共同发展,将传统与新的自媒体营销手段结合,相互促进。武当山旅游景区在建立自媒体平台的基础上更加应该注重的是推广,让更多人知道景区官方的微博以及微信公众号。还可以通过发传单等传统营销方式推广一下自媒体营销方式,二者相互作用,合作发展。
2 结 果
2.1羊型布鲁氏菌16M株基因组提取及超声破碎结果 羊型布鲁氏菌16M株(标准热灭活)基因组提取结果见图1。从图中可见DNA提取浓度较高;经OD260/280分析,基因组纯度也达到要求。取DNA约500 μL进行超声裂解,结果见图1。琼脂糖凝胶电泳显示,基因组裂解后随机片段大小集中分布在0.3~2 kb之间。
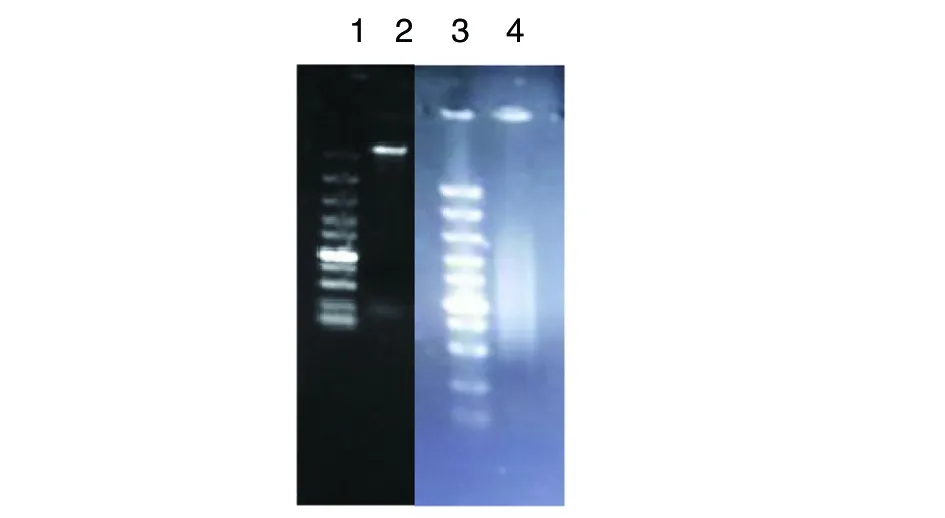
1:Marker从上到下大小依次为100 bp,250 bp,500 bp,750 bp,1 000 bp,1 500 bp,2 000 bp,3 000 bp,5 000 bp,10 000 bp;2:马尔他布鲁氏菌16M株DNA提取结果;3: Marker;4:基因组DNA超声裂解结果图1 布鲁氏菌基因组及超声破碎电泳检测结果Fig.1 Result of DNA extraction and cleavage
2.2酶切噬菌粒载体pYW01结果 提取载体质粒pYW01,经1%琼脂糖凝胶电泳显示条带大小与预期质粒大小相符(图2)。质粒经测序(长春库美生物有限公司)表明,提取结果正确。经SmaI单酶切后,在目的位置发现单一条带(图2)。 对其进行去磷酸化后,准备连接。
2.3构建羊型布鲁氏菌16M株全基因组文库 取100 μL转化后菌液涂板,经37 ℃过夜培养后,有菌落在含氯霉素的LB平板上长出,证明重组噬菌粒载体pYW01成功电转至TG1感受态细胞。菌落大小、形态一致。经计算库容量约为108pfu/ mL,达到建库要求。
随机挑取17个单菌落,利用Touch-down RCR程序鉴定插入文库的片段,结果见图3。结果表明,插入片段具有较好随机性,且插入片段大小分布在0.2~3.0 kb间。

1:Marker从上到下大小依次为100 bp,250 bp,500 bp,750 bp,1 000 bp,1 500 bp,2 000 bp,3 000 bp,5 000 bp,10 000 bp;2:提取噬菌粒pYW01;3:SmaI单酶切噬菌粒pYW01图2 提取质粒pYW01及SmaI单酶切结果Fig.2 Result of plasmid extraction and SmaI enzyme digestion
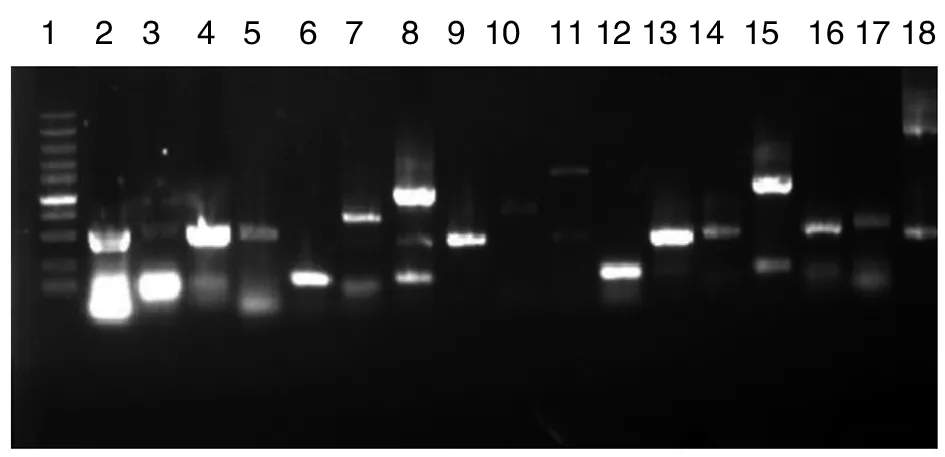
1:Marker从上到下大小依次为100 bp,250 bp,500 bp,750 bp,1 000 bp,1 500 bp,2 000 bp,3 000 bp,5 000 bp,10 000 bp;2~18:PCR鉴定结果图3 1%琼脂糖电泳检测全基因文库中插入片段结果Fig.3 Insert fragments of the library
2.4构建羊型布鲁氏菌16M株蛋白文库 基因文库经辅助噬菌体VCSM13感染后,即可包装成蛋白文库。经PEG纯化后,对原始蛋白文库电转化增殖,37 ℃过夜培养,即为增殖的蛋白文库。随机挑取LB平板上20个单克隆送公司测序。将测序结果与16M株序列比对,基因同源性达到98%以上。结果表明,成功构建羊型布鲁氏菌16M株表面蛋白文库。
2.5差减淘选,扩增阳性克隆,测序 利用免疫血清及感染血清对噬菌体展示蛋白文库进行差减淘选、两轮富集后,得到37个阳性克隆。每轮富集结果见表1。
表1 每轮淘选后阳性克隆数Tab.1 Number of positive clones each round of panning

第一轮(pfu/mL)第二轮(pfu/mL)富集率噬菌体投入量2.0×1072.0×107-洗脱物滴度1.0×1043.0×105300×
对阳性克隆进行扩增,提取质粒进行Touch-down PCR鉴定,分析插入片段大小;对鉴定阳性的质粒送公司测序。经Blast,筛选出6个噬菌体融合蛋白,结果见表2。
表2 阳性噬菌体融合蛋白Tab.2 Positive phage fusion protein

ACCESSIONlocus_tagproductAE008917BMEI1242hypothetical membrane spanning proteinCP007763DK63_1291hypothetical proteinCP007763DK63_1023outer membrane autotransporter barrel domain proteinCP007763DK63_628glutamate racemaseCP007763DK63_1659outer membrane autotransporter barrel domain proteinAE008918BMEII0036outer membrane protein oprf(an outer membrane porin)
2.6竞争ELISA评价阳性克隆的亲和力 以筛选到的噬菌体融合蛋白包被,以提取16M株LPS作为竞争相,检测阳性克隆的亲和力,以辅助噬菌体VCSM13d3作为对照,结果表明,以融合蛋白BMEI1242、DK63-1291、BMEII0036亲和力最强见图4。且经统计学分析,3个融合蛋白之间差异没有统计学意义(F=0.038 22,P>0.05)。
2.7Western-blot评价阳性克隆的特异性及反应原性 以布鲁氏菌病阳性血清为一抗,进行Western-blot分析各个阳性克隆的特异性及反应原性,以VCSM13d3为阴性对照,结果见图5。结果表明,这6个噬菌体融合蛋白均具有较好的反应原性及特异性,而与辅助噬菌体不发生发应。
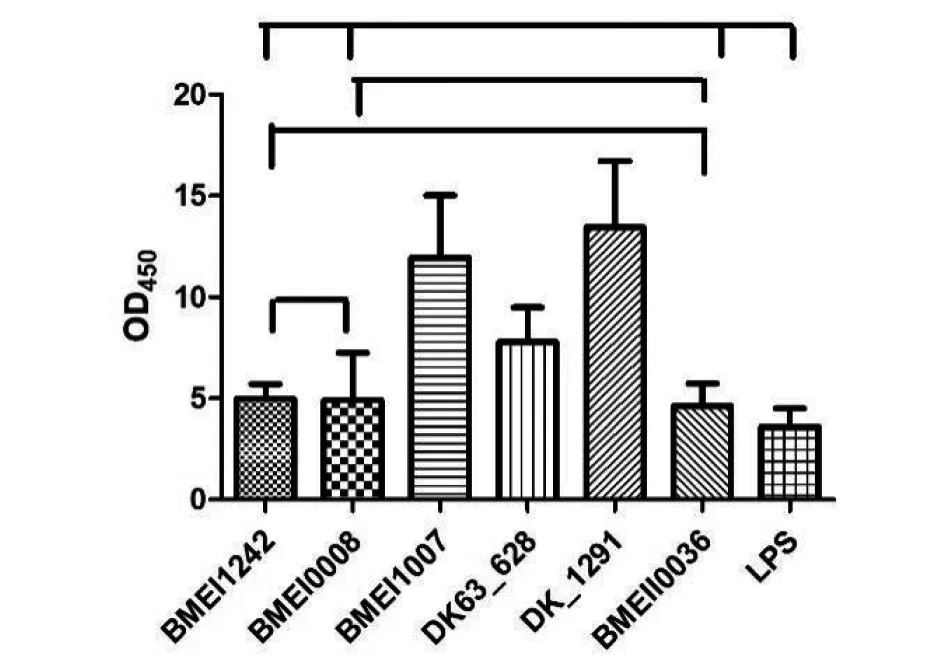
图4 噬菌体融合蛋白c-ELISA结果Fig.4 Result of c-ELISA of phage-fusion proteins

1:低分子量蛋白Marker; 2:BMEII0036; 3:DK63_1659; 4:DK63_628; 5:DK_631023; 6:DK63_129; 7:VCSM13d3; 8:BMEI124图5 感染/阳性血清的 Western-Blot 结果Fig.5 Result of Western-Blot
3 讨 论
布鲁氏菌病新型诊断抗原的研究主要集中在两个方面。LPS作为传统的诊断抗原,一直不断被试图改造[9-12]。LPS含有M和A两个表位,其中A表位是引起交叉反应的主要原因,而这两个表位还不能被分离[13]。因此新合成的LPS只含有M 表位或者含有被改造的A表位。但化学方法合成的LPS在生物学活性上,可能会大大降低。本研究通过利用噬菌粒载体pYW01及辅助噬菌体VCSM13构建了噬菌体展示布鲁氏菌表面蛋白文库,使目的蛋白能与噬菌体的pⅢ蛋白融合,共同展示在噬菌体表面。后续利用靶分子即可对文库进行高通量筛选,并且该技术还可以将基因型与表型联系起来。因此,噬菌体展示技术在肿瘤标记物的识别、新型抗毒血清治疗、疫苗候选株筛选、药物开发、蛋白质组学研究等方面得到广泛应用[14-17]。本研究所用噬菌体展示系统,是Jasna教授等人于2013年构建,该系统能降低外源蛋白对于宿主菌(大肠杆菌)的毒性,提高展示效率等特性[18]。此系统用于构建布鲁氏菌表面蛋白文库还是首次,为布鲁氏菌新型诊断抗原的筛选奠定基础。
致谢本研究得到梅西大学Jasna Rakonjac教授,海军总医院周丽君教授的无私帮助。
利益冲突:无
引用本文格式:王阔鹏,于凌娇,刘倩宏,等.噬菌体展示布鲁氏菌蛋白文库构建及差减筛选融合蛋白[J]. 中国人兽共患病学报,2019,35(5):376-381.DOI:10.3969/j.issn.1002-2694.2019.00.056

