早期免疫肠内营养对胃癌患者术后免疫状态和预后的影响
李永旺,云托亚,乌新林
(1.呼和浩特市第一医院外二科,内蒙古 呼和浩特 010030; 2.内蒙古医科大学附属医院胃肠外科,内蒙古 呼和浩特 010030)
胃癌是临床常见恶性消化道肿瘤,患者普遍存在营养不良情况,胃癌根治术是该病的重要治疗手段。但手术创伤及手术应激反应会导致全身炎症反应,使患者机体免疫功能低下,表现为白细胞介素10(IL-10)、肿瘤坏死因子α(TNF-α)水平升高,γ干扰素(IFN-γ)及白细胞介素2(IL-2)水平降低,且免疫球蛋白A(IgA)、免疫球蛋白M(IgM)及免疫球蛋白G(IgG)水平普遍过低。胃癌根治术后并发症较多,如肠梗阻、肠粘连、胃食管反流及倾倒综合征等,会加重患者机体负担,使预后不良[1-2]。肠内营养和肠外营养是改善手术患者免疫功能的重要途径,目前我国肠内营养应用率较肠外营养低,在营养支持起始时间、营养配方上还存在争议。一些研究结果发现,与标准肠内营养比较,早期肠内营养能更快促进胃肠道功能恢复,降低并发症发生率。目前,术后早期肠内营养是调节机体能量代谢、提高免疫功能和调节手术所致免疫抑制的重要手段,在国外应用广泛[3]。免疫肠内营养是富含谷氨酰胺、精氨酸及核苷酸等的营养支持方法,能显著改善免疫功能,促进愈合,降低并发症发生率。目前,早期免疫肠内营养在我国胃癌根治术领域应用少,其效果有待深入研究。本研究探讨了早期免疫肠内营养对胃癌患者术后免疫状态和预后的影响,现报告如下。
1 资料与方法
1.1 资料来源
选取2015年1月至2017年5月呼和浩特市第一医院收治的拟行胃癌根治术的患者76例。纳入标准:患者及其家属均签署知情同意书;经组织病理学、临床特征及细胞学等诊断为胃癌,并符合胃癌根治术指征;年龄18~75岁;营养风险评估工具(2002NRS)得分≥3分;术前未使用影响血清蛋白水平的药物和免疫增强佐剂[4-5]。排除标准:急诊手术、新辅助化疗或放疗、合并慢性心血管疾病及代谢性疾病者;感染者;肿瘤细胞远处转移者;合并其他严重内科疾病者[6-7]。以随机数字表法分为观察组和对照组,每组38例;分组人员不参与后续研究,患者及医疗、护理人员对治疗方法差异不知情。观察组患者中,女性20例,男性18例;平均(58.32±3.12)岁;体质量(18~27) kg/m2,平均(23.12±2.14) kg/m2;平均卡氏评分(73.20±2.12)分;TNM分期:Ⅰ期7例,Ⅱ期12例,Ⅲ期10例,Ⅳ期9例。对照组患者中,女性19例,男性19例;平均(56.69±2.98)岁;体质量(19~28) kg/m2,平均(23.51±1.92) kg/m2;平均卡氏评分(72.08±1.92)分;TNM分期:Ⅰ期9例,Ⅱ期13例,Ⅲ期9例,Ⅳ期7例。两组患者基线资料的均衡性较高,具有可比性。本研究获得医院伦理委员会批准。
1.2 方法
观察组患者行早期免疫肠内营养,对照组患者行全肠外营养。两组患者均根据体质量,静脉注射复方氨基酸和谷氨酰胺,每日给予20~30 kcal/kg能量(脂肪与碳水化合物供能比为1 ∶ 2);根据标准体质量提供非蛋白热量104.6 kJ/(kg·d)。在此基础上,对照组患者于术后1 d经中心静脉置管给予脂肪乳氨基酸(17)葡萄糖(11%)注射液1 440 ml,与相应剂量胰岛素配制,1日1次,每日使用本品至少12 h,至少治疗5 d。观察组患者于术后24 h内经鼻肠管给予肠内营养乳剂(TPF-T)(规格:500 ml),第1日给予1/2的全量(全量为2 000~3 000 ml),根据耐受情况(腹泻、腹胀及呕吐等情况)决定是否在第2日追加至全量,至少治疗5 d。营养支持中严格监测患者的血糖水平,确保随机抽查血糖<11.1 mmol/L,若超出该范围及时给予适量胰岛素控制,在达到最大剂量前,缺乏的能量均由肠外营养制剂提供。
1.3 观察指标
术前1 d及术后8 d抽取患者空腹外周血5 ml,采用放射免疫分析法检测IFN-γ、TNF-α、IL-10及IL-2水平,试剂盒均为人细胞因子检测试剂盒,由武汉华美生物工程有限公司提供。采用免疫散射比浊法检测营养状态指标,包括血清总蛋白(TP)、血清前白蛋白(PA)及白蛋白(ALB)水平。采用美国Beckman Coulter公司800全自动特定蛋白分析仪和配套试剂检测外周血IgA、IgM及IgG水平。采用流式细胞仪检测CD8+、CD4+,计算CD4+/CD8+,检测自然杀伤细胞(NK细胞)及自然杀伤T细胞(NKT细胞)水平。观察两组患者并发症发生情况及1年无进展生存情况。
1.4 统计学方法

2 结果
2.1 两组患者手术前后免疫细胞亚群水平比较
术前1 d,两组患者CD8+、CD4+、CD4+/CD8+、NK细胞及NKT细胞水平的差异均无统计学意义(P>0.05)。术后8 d,观察组患者CD4+、CD4+/CD8+、NK细胞及NKT细胞水平明显高于治疗前及对照组治疗后,差异均有统计学意义(P<0.05);CD8+水平与治疗前及对照组治疗后的差异无统计学意义(P>0.05),见表1。

表1 两组患者手术前后免疫细胞亚群水平比较Tab 1 Comparison of levels of immune cell subset between two groups before and after operation
2.2 两组患者手术前后IgA、IgM及IgG水平比较
术前1 d,两组患者IgA、IgM及IgG水平的差异无统计学意义(P>0.05);术后8 d,观察组患者IgA、IgM及IgG水平明显高于对照组,差异均有统计学意义(P<0.05),见表2。
2.3 两组患者手术前后营养状态指标水平比较
术前1 d,两组患者TP、PA及ALB水平的差异均无统计学意义(P>0.05);术后8 d,观察组患者上述指标水平明显高于对照组,差异均有统计学意义(P<0.05),见表3。
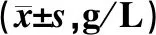
表2 两组患者手术前后IgA、IgM及IgG水平比较Tab 2 Comparison of IgA, IgM and IgG levels between two groups before and after operation g/L)
2.4 两组患者手术前后炎性因子水平比较
术前1 d,两组患者IL-10、TNF-α及INF-γ、IL-2水平的差异均无统计学意义(P>0.05)。术后8 d,观察组患者IL-10、TNF-α水平明显低于对照组,IFN-γ、IL-2水平明显高于对照组,差异均有统计学意义(P<0.05),见表4。
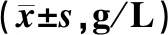
表3 两组患者手术前后营养状态指标水平比较Tab 3 Comparison of indices of nutritional status between two groups before and after operation g/L)
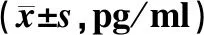
表4 两组患者手术前后炎性因子水平比较Tab 4 Comparison of inflammatory factor levels between two groups before and after operation pg/ml)
注:与术前1 d比较,*P<0.05
Note: vs. 1 day before operation,*P<0.05
2.5 两组患者术后并发症发生情况及1年无进展生存情况比较
观察组患者术后并发症发生率明显低于对照组,术后1年无进展生存率明显高于对照组,差异均有统计学意义(P<0.05),见表5。

表5 两组患者术后并发症发生情况及1年无进展生存情况比较[例(%)]Tab 5 Comparison of incidences of postoperative complications and 1-year progression-free survival rates between two groups [cases (%)]
3 讨论
肠外营养支持经中心静脉输注营养液,吸收好,安全性较高,在我国应用广泛,但部分研究结果显示,该方法容易引发感染,刺激血管,延迟胃肠功能恢复,进一步引发导管相关性败血症、血管性静脉炎和肝损伤等,长期肠外营养可能导致患者胃肠功能紊乱、肠道菌群失调,引发肠源性感染等相关疾病[8-9]。肠内营养支持能降低感染及并发症发生率,更有效地控制血糖,减少或预防细菌易位,成为越来越多医院首选的营养支持方式。早期肠内营养是在患者入院或外科手术后48 h内进行,能减少并发症,促进肠道功能恢复;而免疫肠内营养富含免疫增强营养物质,能进一步增强患者的免疫功能,促进伤口愈合,提高肠道屏障功能,因此备受关注[10]。
CD4+、CD8+、CD4+/CD8+、NK细胞及NKT细胞水平是临床常用免疫功能指标。当患者处于营养不良状态、肠道免疫功能被破坏的情况下,细胞介导的免疫反应受损,表现为CD4+、CD8+变化,部分患者术前有CD4+/CD8+降低甚至倒置现象,提示机体免疫功能被严重抑制[11]。CD4+、NKT细胞水平在抑制肿瘤转移和生长方面具有重要作用,是免疫功能强弱反应的重要指标;NK细胞完全活化需要一些表面受体与配体结合,CD27和CD28是免疫细胞表面共刺激分子,免疫细胞活化伴随其表面活性标志物水平升高及细胞表面共抑制分子动态变化[12-13]。本研究中,术后8 d,观察组患者CD4+、CD4+/CD8+、NK细胞及NKT细胞水平明显高于治疗前及对照组治疗后,差异均有统计学意义(P<0.05),提示早期免疫肠内营养更利于免疫恢复,促进肠道功能恢复。考虑是因为免疫肠内营养剂中富含RNA、精氨酸及ω-3不饱和脂肪酸,患者处于精氨酸、谷氨酰胺缺乏状态,机体免疫功能低下,通过补充免疫性营养制剂能改善这种状态;其中补充的谷氨酰胺是肠道内参与免疫反应细胞的能量来源,可促使肠道分泌型免疫球蛋白水平提高,维持肠道上皮完整性,预防肠黏膜萎缩等并发症[14-15]。本研究中,观察组患者术后并发症发生率明显低于对照组也与此有关。IgA、IgM及IgG水平过高提示可能存在感染,过低提示存在免疫功能低下。胃癌患者本身存在营养不良、免疫功能低下的情况,根治术带来的创伤导致其免疫功能进一步降低,IgA、IgM及IgG水平普遍过低。本研究中,观察组患者IgA、IgM及IgG水平明显高于对照组,差异均有统计学意义(P<0.05),提示观察组患者的免疫功能得到提高,即早期免疫肠内营养有利于改善胃癌根治术患者术后免疫功能。此外,本研究观察了炎性因子IL-10、TNF-α、IFN-γ及IL-2水平的变化。IL-2主要来自活化T细胞,是免疫系统中有重要作用的细胞因子,能激活免疫细胞,促使B细胞及T细胞增殖和分化,提高免疫细胞对肿瘤细胞的杀伤力;IFN-γ能在适应性和固有性免疫杀伤病毒及胞内细菌感染中发挥重要作用,具有较强抗肿瘤机制;IL-10参与免疫反应和炎性反应,是抑制免疫和促进炎症的细胞因子[16-17]。根治术引发营养不良、应激反应、肠道黏膜损伤及菌群易位等,导致促炎因子释放,造成术后患者免疫功能抑制和并发症的发生,为残留恶性肿瘤细胞生长提供条件,导致术后复发[18-19]。本研究中,术后8 d,观察组患者IL-10、TNF-α水平明显低于对照组,IFN-γ、IL-2水平明显高于对照组,差异均有统计学意义(P<0.05),提示早期免疫肠内营养更能改善患者免疫功能,缓解轻微炎症反应,改善预后。其原因可能为ω-3不饱和脂肪酸影响花生四烯酸代谢,从而调节免疫功能,缓解炎症反应[20]。并发症的发生情况是评估患者术后生活质量的重要指标。本研究中,观察组患者术后并发症发生率明显低于对照组,术后1年无进展生存率明显高于对照组,差异均有统计学意义(P<0.05),提示观察组患者术后并发症更少,生活质量更高,预后更好。上述研究结果证明了早期免疫肠内营养更有利于胃癌根治术患者的术后预后。此外,观察组患者TP、PA及ALB水平明显高于对照组,差异均有统计学意义(P<0.05),提示观察组患者营养状态改善程度优于对照组。这与早期免疫肠内营养改善患者免疫功能,缓解炎症反应,改善患者营养状态,减少并发症,促进伤口恢复,促进机体自身抗肿瘤作用等有关。
综上所述,早期免疫肠内营养能改善胃癌患者术后的免疫功能和营养状态,减少并发症的发生,提高1年无进展生存率。

