临床药师对危重症患者营养支持治疗的药学监护
芦 梦,商永光,唐 崑
(1.中日友好医院药学部,北京 100029; 2.中国医学科学院阜外医院药剂科,北京 100037)
现以1例危重症伴肺部感染,因各种原因导致恶心、呕吐等胃肠道不适而调整营养支持的患者为例,探讨伴胃肠道反应的危重症患者营养支持治疗方案的合理性,为临床医师提供参考,以优化用药方案。
1 病例资料
某58岁女性患者,身高160 cm,体质量55 kg,体质量指数21.5 kg/m2。患者咳嗽、咯痰2个月余,加重伴发热、呼吸困难1个月。1个月前,患者出现咳痰量多,色黄夹血丝,伴喘息、汗多,胸部CT检查提示双肺感染较前明显进展、双肺广泛实变,予以美罗培南、帕拉米韦和莫西沙星治疗;患者仍有发热,体温最高39.2 ℃,白细胞计数3.23×109/L,将抗菌药物改为头孢哌酮舒巴坦、万古霉素和伏立康唑;胸部CT检查提示肺部病灶较前稍有吸收,但仍有间断发热,2018年3月12日就诊于中日友好医院急诊。患者无高血压病、糖尿病、心脏病和脑血管病病史;无家族遗传病史;纳差、睡眠可,大小便正常,2个月内体质量降低5 kg。入院时实验室检查:白细胞计数2.94×109/L,中性粒细胞百分比87.7%,血红蛋白122 g/L,总蛋白41 g/L,白蛋白定量28 g/L,血清钾离子浓度3.2 mmol/L,血清钠离子浓度134 mmol/L。入院诊断:发热,肺部阴影原因待查;Ⅰ型呼吸衰竭;白细胞计数降低;电解质紊乱,低钾血症、低钠血症;肝功能异常;低蛋白血症。
2 主要治疗经过
3月12日,患者入住重症加强护理病房(intensive care unit,ICU),医师予以磷酸奥司他韦胶囊、注射用伏立康唑、左氧氟沙星氯化钠注射液及注射用头孢哌酮舒巴坦钠抗感染治疗,同时口服枸橼酸钾颗粒对症治疗。入院第2日,患者血红蛋白109 g/L,血清钠离子浓度133 mmol/L,白蛋白定量26 g/L;医师考虑患者进食差,处于营养不良状态,予以肠外营养(parenteral nutrition,PN)支持。入院第3日,由于患者可自主经口进食,为保证患者肠道黏膜的完整性及屏障功能,防止肠道细菌移位加重感染及PN可能导致的导管相关感染,医师停用PN,改为予以肠内营养混悬液500 ml(1.5 kcal/ml)。入院第5日,由于患者联合应用多种抗感染药治疗后仍持续发热,不能排除结核分枝杆菌感染,故加用异烟肼、利福平和乙胺丁醇三联试验性抗结核治疗;患者血红蛋白101 g/L,血清钠离子浓度132 mmol/L,营养支持方案不变。入院第9日,患者呕吐明显,呕吐物潜血试验为阳性,不除外急性胃黏膜损伤,予以禁食水及经外周静脉置入中心静脉导管的PN;后复查呕吐物潜血仍为弱阳性,继续禁食水;由于抗结核药及抗菌药物应用10 d后仍有发热,故考虑非感染性发热,停用抗菌药物;为预防应激性溃疡,给予注射用兰索拉唑;患者血红蛋白88 g/L,血小板计数289×109/L,血清钠离子浓度128 mmol/L,白蛋白定量23 g/L。入院第16日,患者白蛋白定量31 g/L,钾离子浓度4 mmol/L,钠离子浓度132 mmol/L,试喂糖水后,能耐受,故恢复流质饮食,患者食欲良好,停止全胃肠外营养(totalparenteralnutrtion,TPN)支持,转入普通病房继续治疗。患者入住ICU期间的营养支持治疗分为3个阶段,见表1。
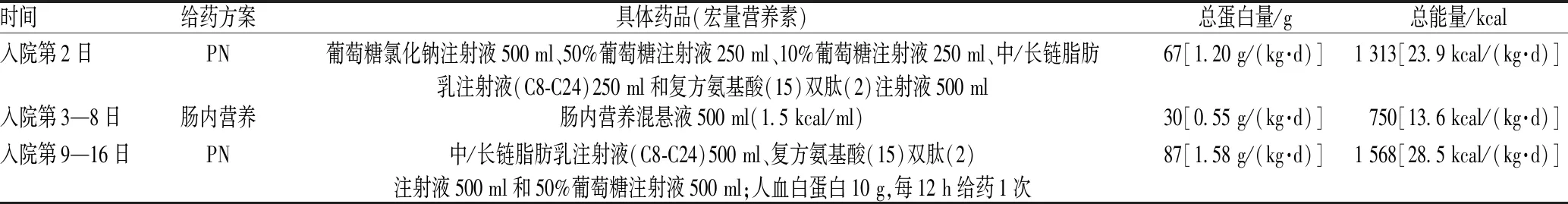
表1 患者肠外、肠内营养支持治疗方案Tab 1 Parenteral and enteral nutrition support treatment
3 营养风险筛查
根据营养风险筛查评分简表(nutritional risk screening,NRS)2002[1]对患者进行营养风险筛查,NRS 2002是目前最常用、多个国家指南推荐的营养风险筛查工具[2]。分为3个部分:营养状态评分、疾病状态评分及年龄评分,总分为7分;其中,2个月内体质量降低>5%为中度,记2分;慢性病急性发作为轻度,记1分;年龄>70岁记1分。临床药师通过问诊及与医师沟通后认为,该患者2个月内体质量降低5 kg(即8%),故记2分;以社区获得性肺炎收入院,入院诊断为急性呼吸窘迫综合征,故记1分;年龄59岁,故记0分。该患者NRS 2002评分为3分,有营养风险,但并非所有有营养风险的患者均要立即进行营养治疗。由于目前患者一般状况良好,可自主进食,临床药师建议暂时不予以营养支持。患者入院时总蛋白41 g/L,白蛋白定量28 g/L,故临床药师建议在半流质饮食或普通饮食的基础上增加蛋白质的摄入,尤其是优质蛋白质,以满足患者目前以分解代谢为主的应激状态。同时,监测患者营养相关指标水平,如白蛋白、前白蛋白、血红蛋白、血脂指标和电解质,关注患者进食情况与胃肠道反应,及时调整营养支持方案,若每日能量及蛋白质不足可再增加口服或管饲的肠内营养补充。
4 讨论
4.1 ICU患者的营养支持
4.1.1 营养支持的时机与途径:针对无法自主进食的危重症患者,相关指南推荐在入院24~48 h内启动肠内营养[3],只有对肠内营养有绝对禁忌证或不能达到目标需求量的患者会选择给予补充性PN,但给予补充性PN的时机仍存在争议。目前欧洲指南推荐,患者经肠内营养摄入能量不足目标量的60%,2 d后即可给予补充性PN;加拿大指南推荐,若预计患者ICU停留时间短或营养风险低,强烈不建议早期补充性PN[4];美国指南也认为,若患者在入住ICU时无蛋白质性热卡能量不足,则可在入住ICU 7 d后、肠内营养无法满足每日需求量的情况下给予补充性PN。本案例中,患者入住ICU时可自主经口进食,既往营养状况一般,食欲不佳。相关指南建议,营养风险较低及基础营养状况正常、疾病较轻(如NRS 2002评分≤3分)的患者,即使不能自主进食,入住ICU的第1周内也不需要特别给予营养治疗。故临床药师建议,由于目前该患者胃肠道功能良好,若无法经口进食满足每日所需能量,则可尝试管饲肠内营养。患者之后出现疑似上消化道出血的症状,医师予以禁食、TPN支持治疗。临床药师认为,由于目前患者营养状况差,血红蛋白及白蛋白水平低,且肺部感染能量消耗增加,故可以直接给予TPN支持而非禁食补液观察几日后尝试肠内营养。
4.1.2 营养支持所需的能量和配方:根据指南推荐,一般营养支持所需能量为20~25 kcal/(kg·d),蛋白质为1.2~2 g/(kg·d),糖脂比为5 ∶ 5,非蛋白质性热卡 ∶ 氮为(100~200) ∶ 1。该患者TPN配方中蛋白质总量符合要求,但能量偏高,临床药师建议可将中/长链脂肪乳注射液(C8-C24)减少至250 ml。同时,临床药师注意到医师选择的是复方氨基酸(15)双肽(2)注射液。目前,针对谷氨酰胺在危重症患者中的应用仍存在争议。当机体处于全身炎性反应等危重状态时,谷氨酰胺参与多种应激反应过程,维持肠道屏障的功能,但其是一种重要的条件必需氨基酸,故需要额外补充。研究结果证实,肠黏膜及免疫细胞的主要能量来源并非葡萄糖,而是谷氨酰胺(占肠道能量的70%);且谷氨酰胺能促进肠上皮细胞的增殖,在正常和病理状态下均能保护细胞,防止细胞凋亡[5]。在应激状态下,机体组织细胞对谷氨酰胺的利用量增加,若不能经饮食补充足够的谷氨酰胺,将产生谷氨酰胺相对缺乏的情况。含有适当剂量谷氨酰胺的PN制剂可以增加肠绒毛高度、降低肠黏膜通透性以及增强肠免疫功能,防止细菌移位,维持肠黏膜屏障;相关实验模型也证实谷氨酰胺可以调节肠道通透性和紧密连接蛋白的表达[6]。虽然有上述理论基础,但大量多中心、随机对照临床研究及事后观察性研究结果均表明,静脉输注谷氨酰胺在改善危重症患者的住院感染率和病死率方面并无明显优势,甚至有可能增加危重症患者的死亡概率[7-8]。故目前相关指南指出,除颅脑创伤与外科ICU围术期患者外,一般不推荐使用谷氨酰胺。而且,复方氨基酸(15)双肽(2)注射液价格较贵,从经济性考虑,临床药师也建议将其更换为复方氨基酸注射液(18AA)即可。
4.1.3 营养支持过程中发生胃肠道反应的监护点:在肠内营养支持的过程中,可能会出现腹胀、消化不良、恶心、呕吐、腹泻甚至误吸等不良反应。为减少误吸风险,口服或管饲肠内营养时,最好保证床头抬高至少30 °,患者取半卧位,防止反流,服用或输注完毕后仍需维持此体位20~30 min。同时,要注意肠内营养的速度,应从慢到快,首日20~50 ml/h,根据耐受情况,可逐步增至80~100 ml/h。该患者在应用肠内营养支持治疗时,应可经口自主服用,故可建议患者从小剂量开始,1次50 ml,以“少食多餐”的方式缓慢服用[9-10]。胃残余量(GRV)增多理论上可作为肠内营养不耐受的指标之一,但2018年之前的国内外很多指南及共识已不推荐频繁监测患者的GRV来判断肠内营养是否耐受[11]。一些研究认为,监测GRV组与不监测GRV组患者呼吸机相关肺炎的发生率无明显差异。但是,2018年欧洲肠外肠内营养学会的《危重症患者营养支持治疗指南》并不推荐因此而放弃监测GRV,因为对于危重症患者,预防呕吐及误吸对最终的临床结局可能有很大的影响;而且,上述研究中,不监测GRV组中有41.8%的患者发生了呕吐,而测量GRV组中仅26.5%的患者发生了呕吐,两组的差异有统计学意义(P=0.02)。因此,最起码对于肠内营养开始期间和(或)肠内营养期间出现胃肠道不适的患者,还是建议进行GRV监测。
4.2 患者出现胃肠道反应的原因分析
4.2.1 药物的应用:患者进食差,营养状态不好,有低血钾症状,故医师予以补钾治疗,选择枸橼酸钾颗粒。由于患者有恶心的症状,口服的钾制剂对胃肠道有一定的刺激,会加重患者胃肠道症状,故临床药师建议将口服钾制剂改为氯化钾注射液。医师针对患者肺部感染应用的抗菌药物中,抗结核药的胃肠道反应最常见,部分患者会出现重度胃肠道不适,表现为通过损伤胃黏膜而导致厌食、恶心、呕吐及上腹部不适,且与异烟肼合用时不良反应会加重[12-13]。由于患者应用该抗菌药物方案后感染并未好转,且胃肠道反应较大,影响患者足量营养摄入,故药师建议停用抗结核药,以保证患者充足的营养支持。
4.2.2 黏膜损伤与应激性溃疡:在未接受预防应激性溃疡治疗的ICU患者中,明显消化道出血的发生率可能高达5%[14];如果不进行处理,消化道出血平均发生时间为入院14 d后。与应激性溃疡相关的出血危险因素包括机械通气、凝血病、急性肾损伤、肝衰竭和疾病严重程度[15]。危重症早期,由于交感神经系统兴奋及儿茶酚胺释放,导致胃肠道血管收缩,胃黏膜血流灌注显著降低,最佳的液体复苏可维持血液动力学稳定性,从而改善内脏灌注,早期提供肠内营养,可能有助于预防应激性溃疡的发生[16]。该患者入院时血红蛋白122 g/L,出现呕吐物潜血阳性时血红蛋白88 g/L,血红蛋白水平降低>20 g/L,符合应激性溃疡的临床表现,患者入住ICU后持续的上消化道隐性出血加重了胃肠道反应,导致进食不佳,为保证患者每日的能量及蛋白质的需求,医师给予了TPN支持。临床药师建议,患者肠道黏膜受损,当活动性出血症状减轻或消失后,应尝试滋养型的肠内喂养,以促进肠道黏膜的修复,维持肠道黏膜的完整性。
总之,在危重症患者营养支持过程中,最重要的就是保证肠道黏膜屏障的完整性[17]。这一点与肠内营养的给予互为因果,只有当给予一定的肠内营养时,肠道黏膜才能不受损伤,肠道菌群才不易发生细菌移位;而只有当肠道黏膜完好时,才能保证肠内营养的吸收更充足[18]。但临床上常因各种原因延迟甚至不启动肠内营养而是用TPN代替肠内营养,这就需要临床药师的参与,协助医师合理选择营养支持的方式。同时,药物引起胃肠道不耐受的情况极为常见,尤其是危重症患者用药复杂且常处于应激状态,更需要临床药师在工作中对各种发生胃肠道反应的情况进行细致分析,并采取有效的应对措施,真正达到个体化营养支持的目的。

