膜性肾病组织中足细胞自噬体数量、自噬相关蛋白表达变化及其意义
陈生晓,林晓明,甘艳,高飞,尹纪来
(1中国人民解放军联勤保障部队第928医院,海口571159;2海南医学院第一附属医院)
膜性肾病是临床上肾病综合症的主要类型,病理特征为大量免疫复合物在肾小球基底膜上皮细胞下弥漫、沉积,造成基底膜增厚[1]。膜性肾病根据病因可分为特发性膜性肾病(IMN)和继发性膜性肾病(SMN)两种。IMN指与抗磷脂酶A2受体抗体相关的膜性肾病,占膜性肾病总数的80%;SMN大多由自身免疫性疾病、乙型肝炎病毒(HBV)感染、药物、肿瘤等明确病因所引起[2,3]。足细胞分布于肾小球基底膜外侧,与肾小球基膜、血管内皮细胞共同组成血液滤过屏障。足细胞损伤、缺失与膜性肾病患者蛋白尿的发生及肾小球硬化密切相关,而自噬参与了该过程[4]。自噬是真核生物特有的保护机制,可消化并循环利用大分子物质、受损细胞器等,为维持肾小球及肾小管稳态的关键机制。研究发现,膜性肾病、糖尿病肾病、肾组织缺血再灌注损伤等病理过程均与自噬有关[5,6],但自噬在肾病进展中的作用尚不清楚。本研究观察了IMN和SMN足细胞中自噬体数量及自噬蛋白Beclin-1、微管相关蛋白轻链3(LC3)表达变化,探讨足细胞自噬与膜性肾病的关系。
1 资料与方法
1.1 临床资料 选择2015年9月~2017年10月于本院经肾穿刺活检确诊为膜性肾病且有透射电镜检查结果的患者114例,留取活检病灶组织标本。其中IMN患者92例(IMN组),男56例、女36例,年龄(48.13±11.72)岁,合并水肿66例、镜下血尿64例、肾病综合征62例;SMN患者22例(SMN组),男7例、女15例,年龄(30.08±9.26)岁,合并水肿16例、镜下血尿19例、肾病综合征13例。SMN患者包括狼疮肾炎Ⅴ型16例、HBV感染相关肾炎3例、不典型膜性肾病3例。IMN组、SMN组患者均行肾活检术,并用光镜、免疫荧光、电镜行常规肾脏病理学检查。另选择因外伤、输尿管肿瘤等其他原因行肾切除手术的患者30例为对照组,术中留取正常肾组织标本。对照组中,男17例、女13例,年龄(36.25±3.16)岁。本研究经本院伦理委员会批准进行,标本采集符合《世界医学协会赫尔辛基宣言》。三组性别、年龄、24 h尿蛋白量(24 h UP)、尿酸(UA)、白蛋白(Alb)、血肌酐(Scr)差异有统计学意义(P均<0.05),其余指标差异无统计学意义(P均>0.05)。见表1。

表1 三组24 h UP、UA、估算肾小球滤过率(eGFR)、总蛋白(TP)、Alb、Scr、尿素氮(BUN)水平比较
注:与对照组比较,*P<0.05。
1.2 足细胞自噬体观察及计数 肾脏活检组织用10%甲醛固定,石蜡包埋。组织蜡块预冷后以4 μm厚度行连续切片,每个蜡块制备5~7张切片,于60 ℃条件下烤片2 h。切片用二甲苯脱蜡、不同浓度的乙醇水化;苏木素染色5~10 s,水冲洗;1%盐酸乙醇分化5~10 s,水冲洗;伊红溶液染色1~2 min;常规脱水透明;中性树胶封片;在光镜下观察。取1 mm3大小的肾皮质浸入含2.5 %戊二醛、2 %多聚甲醛的磷酸缓冲液中,固定2 h;PBS冲洗;梯度乙醇、丙酮脱水;丙酮包埋液包埋;依次置于37、45、60 ℃烘箱中固化;以50~60 nm厚度超薄切片;在透射电镜下观察并拍照。每例患者选择5~7个足细胞进行观察,记录足细胞胞质内自噬体数量,取均数。
1.3 肾脏组织中自噬相关蛋白检测 石蜡切片常规脱蜡、水化;胰酶修复抗原;浸入5%山羊血清中,37 ℃孵育20 min;浸入LC3或Beclin-1兔抗多克隆抗体(1∶100)稀释液中,37 ℃过夜;浸入FITC标记的羊抗兔抗体(1∶200)稀释液中,4 ℃孵育2 h;PBS漂洗,甘油封片,放入湿盒,于4 ℃避光保存。在荧光显微镜下观察并拍照,采用Image Pro plus分析各切片的荧光强度,表示目的蛋白相对表达量。

2 结果
2.1 各组足细胞自噬体数量比较 IMN组、SMN组、对照组足细胞自噬体数量分别为(2.63±0.94)、(2.58±0.52)、(3.22±0.86)个,IMN组和SMN组足细胞自噬体数量较对照组减少(P均<0.05)。
2.2 足细胞自噬体数量与膜性肾病临床病理参数的关系 IMN组、SMN组中,临床分期为Ⅱ期、24 h UP≥3.5 g/L、Alb≥30 g/L、eGFR≥60 mL/(min·1.73 m2)的患者足细胞自噬体数量分别少于临床分期为Ⅰ期、24 h UP<3.5 g/L、Alb<30 g/L、eGFR<60 mL/(min·1.73 m2)的患者(P均<0.05)。详见表2。IMN组、SMN组足细胞自噬体数量与24 h UP(r分别为0.172、0.154)、eGFR(r分别为-0.168、-0.182)、Scr(r分别为0.317、0.302)、BUN(r分别为-0.192、-0.171)均无相关性(P均>0.05)。
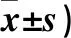
表2 足细胞自噬体数量与膜性肾病临床病理参数的关系(个,
注:与Ⅰ期患者相比,*P<0.05;与24 h UP<3.5 g/L者相比,#P<0.05;与Alb<30 g/L者相比,△P<0.05;与eGFR<60 mL/(min·1.73 m2)者相比,☆P<0.05。
2.3 各组肾组织中自噬相关蛋白表达比较 IMN组和SMN组肾组织中LC3、Beclin-1相对表达量低于对照组(P均<0.05)。见表3。

表3 各组肾组织中LC3、Beclin-1相对表达量比较
注:与对照组比较,*P<0.05。
3 讨论
膜性肾病发病较为隐匿,约1/3的患者会发展成终末期肾病,将终生需要接受治疗。肾病综合征与药物治疗引起的并发症可导致患者残疾甚至危及生命,因此对膜性肾病及时确诊与治疗尤为重要[7]。目前临床上主要依靠肾穿刺活检术对膜性肾病进行诊断,同时通过光镜、免疫荧光及电镜检查辅助评价肾小球病变情况,再结合发病因素筛查结果,若与抗磷脂酶A2受体抗体相关,则诊断为IMN;若继发于某些疾病、药物之后,病因明确,则诊断为SMN[8,9]。虽然诊断技术不断进步,但膜性肾病的发病机制仍不明确。
自噬是细胞内高度保守的降解机制,在酵母到人类等真核生物细胞内广泛存在,可降解长寿命蛋白、受损细胞器、氧化脂质体、入侵微生物等。自噬参与维持细胞内环境稳定与基因组完整,细胞自噬异常可导致恶性肿瘤、肾脏疾病等发生[10]。近期研究[11,12]表明,多种肾小球疾病肾活检组织足细胞自噬小体数发生变化,表明自噬可能参与肾脏疾病的发生发展过程,探究自噬作用过程可能为临床诊治肾脏疾病提供新思路。膜性肾病是肾小球疾病的常见类型,以免疫复合物沉积于足细胞基底膜为特征,病变部位主要在肾小球毛细血管袢,尤其是足细胞。足细胞作为肾小球血液滤过屏障的重要组成部分,其损伤、缺失是引发肾小球疾病和蛋白尿的主要因素。自噬在足细胞等终末分化细胞的生长与更新过程中发挥重要作用。有研究[13]显示,绿色荧光标记LC3转基因小鼠的肾小球足细胞区绿色荧光强度显著增强,表明足细胞存在较高的基础自噬活性。另有研究[14]发现,人足细胞同样存在基础自噬活性。本研究结果显示,对照组足细胞中也存在较多的自噬体,足细胞中LC3、Beclin-1表达较强,进一步验证了人足细胞存在基础自噬活性。
自噬相关蛋白LC3在进化过程中高度保守,包括Ⅰ型与Ⅱ型,LC3-Ⅰ定位在胞质内,其可与磷脂酰乙醇胺结合形成LC3-Ⅱ;LC3-Ⅱ定位在自噬体膜的表面,参与自噬体的形成,常被用于评估细胞自噬的程度[15]。Beclin-1主要在自噬体形成前期产生,参与调节其他自噬相关蛋白的定位[16]。有关研究发现,足细胞分化、损伤修复等过程中伴随有自噬现象[17]。微小病变肾病患者足细胞Beclin-1表达水平高于肾小球硬化患者,复检发现足细胞Beclin-1水平下降、自噬活性降低,则说明微小病变肾病已进展为肾小球硬化。有学者发现,Heymann肾炎小鼠模型足细胞损伤时,早期足细胞自噬开始活化,持续保持较高水平;随着病程进展,后期肾组织病变加剧、尿蛋白大量排泄,足细胞自噬活性反而降低,且有足细胞凋亡[18]。
本研究结果显示,IMN组和SMN组足细胞自噬体数量较对照组减少,LC3、Beclin-1相对表达量均低于对照组;且IMN组、SMN组临床分期为Ⅱ期、24 h UP≥3.5 g/L、Alb≥30 g/L、eGFR≥60 mL/(min·1.73 m2)的患者足细胞自噬体数量分别少于临床分期为Ⅰ期、24 h UP<3.5 g/L、Alb<30 g/L、eGFR<60 mL/(min·1.73 m2)的患者。上述结果提示IMN与SMN患者足细胞自噬体数量可能与疾病的进展程度有关,自噬与膜性肾病患者足细胞损伤过程密切相关,随着病情进展,足细胞自噬活性下降。本研究结果对膜性肾病的诊断及治疗相关研究有一定参考价值。

