健康老年人、老年急性脑梗死患者外周血Th17比例及IL-17、ET-1、VCAM-1、ox-LDL水平变化
付瑞,丁绍威,刘梦蝶,胡伟,黄开泉,胡超杰,李庆
(1安徽医科大学附属省立医院,合肥230001;2安徽中医药大学第一附属医院)
急性脑梗死(ACI)是一类危害性较高的神经系统疾病。动脉粥样硬化(AS)是血栓性脑梗死发生的主要原因之一[1]。由于群体的特殊性,老年人更容易突发ACI[2]。老年人身体存在一系列衰老改变,包括内分泌环境及免疫系统等的衰老改变。由于血管内皮细胞的衰老,调控血管平滑肌收缩和舒张的因子表达水平发生变化,进而影响了血管内环境平衡,最终导致血栓形成[3]。辅助性T细胞17(Th17)是2007年新发现的一类不同于Th1、Th2的CD4+辅助性T细胞,其可分泌多种细胞因子,其中白细胞介素17(IL-17)是Th17的主要效应因子,IL-17在炎症反应、自身免疫性疾病等的发病中发挥重要作用[4,5]。目前对Th17在衰老和ACI发生中的作用尚未完全阐明。本研究观察了健康老年人、老年ACI患者外周血Th17比例及血清IL-17、血管黏附分子1(VCAM-1)、血管内皮细胞衰老指标内皮素1(ET-1)、炎症标志物氧化低密度脂蛋白(ox-LDL)水平的变化,分析Th17比例及IL-17与VCAM-1、ET-1、ox-LDL的相关性,并探讨其临床意义。
1 资料与方法
1.1 研究对象 2017年5月~2018年4月在安徽省立医院神经内科住院的老年ACI[6]患者33例(老年脑梗组),男17例、女16例,均为初诊ACI患者。选取同期在院进行体检的不同年龄段健康人为对照,排除有心脑血管意外病史者,参照WHO推荐标准,青年(44岁以下)28人(健康青年组)、中年(45~60岁)29人(健康中年组)、老年(60岁以上)32人(健康老年组)[7]。各组性别比例差异无统计学意义。健康老年组空腹血糖、TG、LDL水平高于健康青年组和健康中年组,而老年脑梗组高于健康老年组(P均<0.05)。见表1。所有研究对象排除肿瘤、感染、全身免疫性疾病、严重肝肾疾病、血液系统疾病,未服用免疫抑制剂和非甾体类抗炎药。本研究经医院伦理委员会批准,研究对象均签署知情同意书。

表1 各组年龄、性别、血糖、血脂指标比较
注:与各组健康人群比较,★P<0.05;与健康老年组比较,△P<0.05。
1.2 外周血Th17检测 抽取各组5 mL全血用生理盐水稀释一倍后缓慢加到淋巴细胞分离液上层,550 r/min 4 ℃离心20 min,弃去上清,小心吸取中层细胞获得单个核细胞。再经PBS洗涤细胞2次后,加RPMI-1640完全培养基重悬细胞,计数后以2×106/mL接种到24孔板,每孔1 mL。加入混合型细胞刺激剂cocktail 2 μL,并用加样枪充分混匀细胞悬液,在37 ℃、5% CO2细胞培养箱中无菌培养4~6 h后将细胞收集到试管中,加PBS洗涤后1 200 r/min离心5 min,留取约100 μL液体。向管中加入FITC-CD4 5 μL,用涡旋震荡器震荡混匀,4 ℃避光孵育30 min;再在每管中加入适量PBS,1 200 r/min离心5 min,弃去上清液后加入细胞固定剂100 μL,震荡混匀后,4 ℃避光反应15 min;加入PBS,1 200 r/min离心5 min洗涤;弃上清,向每管加入100 μL细胞破膜剂,4 ℃避光反应5~10 min,向检测管中加入PE-IL17A 5 μL,对照管中则加相应的同型对照PE 5 μL,混匀,4 ℃避光孵育15~20 min;再次用PBS以1 200 r/min离心5 min洗涤,加500 μL的PBS重悬细胞,上流式细胞仪检测。检测调整流式细胞仪后,对淋巴细胞群进行设门,在淋巴细胞群中再对CD4+T淋巴细胞设门。每份标本获取设门内细胞数达到10 000个,使用Diva Software V6.1.3进行数据分析。
1.3 血清IL-17、ET-1、VCAM-1、ox-LDL检测 将抽取的全血放入非抗凝生化管,室温静置2 h待血清充分析出后以低速离心机3 000 r/min离心5 min,收集血清(溶血标本弃去),-80 ℃冰箱低温保存。采用ELISA法检测血清IL-17、ET-1、ox-LDL、VCAM-1,操作步骤按照试剂操作说明书进行,在酶标仪上检测其在450 nm波长处的OD值。每份标本做3个复孔,同时做标准曲线孔并设置空白对照孔和阴性对照孔。根据标准曲线孔的OD值与浓度得到标准曲线公式,对照标准曲线代入标本实测OD值换算出浓度值。
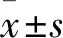
2 结果
2.1 各组外周血Th17比例比较 健康青年组、健康中年组、健康老年组和老年脑梗组的外周血Th17比例分别为0.96%±0.18%、1.47%±0.30%、2.38%±0.33%、4.09%±1.07%。老年脑梗组外周血Th17比例高于各组健康人群(P均<0.05);健康老年组外周血Th17比例高于健康青年组和健康中年组(P均<0.05)。见表2。
2.2 各组血清IL-17、ET-1、VCAM-1、ox-LDL比较 老年脑梗组血清IL-17、ET-1、VCAM-1、ox-LDL水平高于各组健康人群(P均<0.05);健康老年组血清IL-17、ET-1、VCAM-1、ox-LDL水平高于健康青年组和健康中年组(P均<0.05)。见表2。
2.3 各组Th17比例、IL-17水平与ET-1、VCAM-1、ox-LDL水平的相关性 各组外周血Th17比例与血清VCAM-1、ET-1、ox-LDL水平呈正相关(r分别为0.847、0.815、0.809,P均<0.01)。血清IL-17水平与血清VCAM-1、ET-1、ox-LDL水平亦呈正相关(r分别为0.770、0.715、0.744,P均<0.01)。见图1。

表2 各组人群外周血Th17比例和血清IL-17、ET-1、VCAM-1、ox-LDL水平比较
注:与健康青年组和健康中年组比较,★P<0.05;与健康老年组比较,△P<0.05。
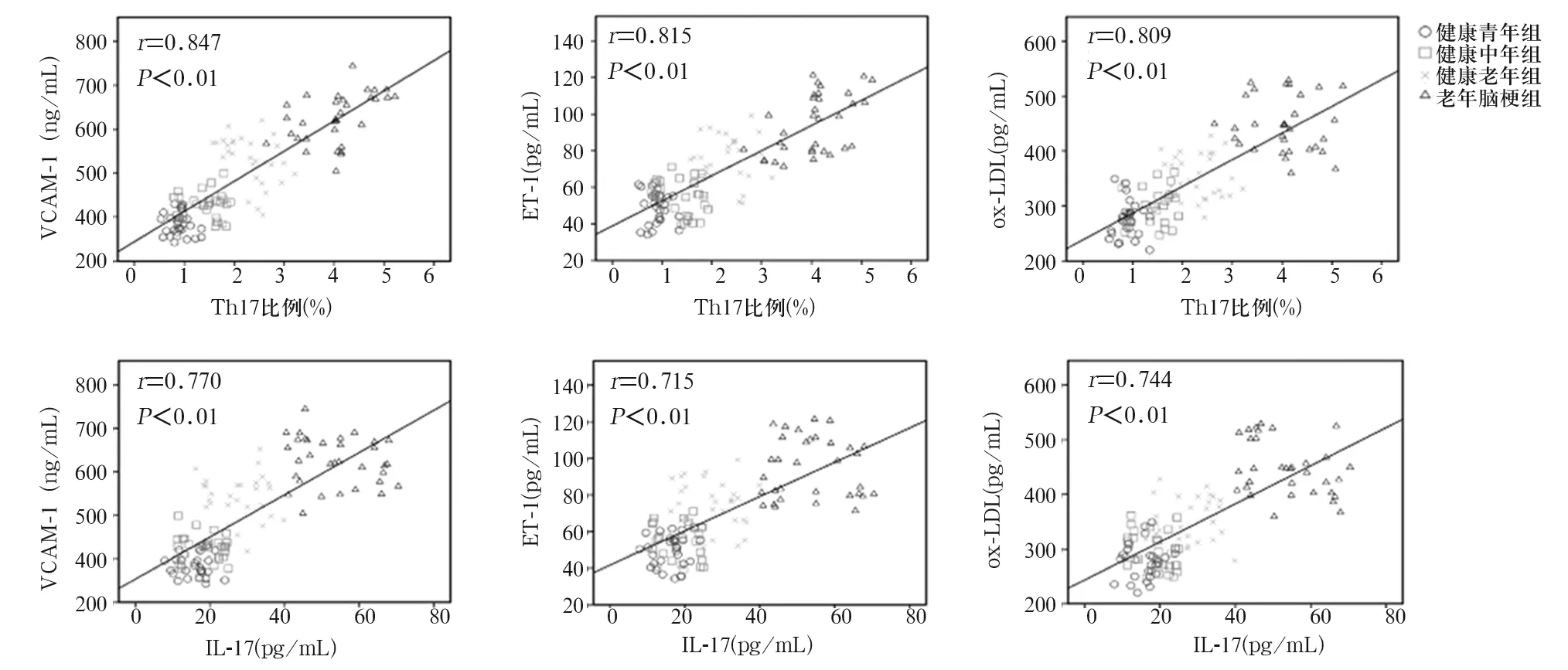
图1 外周血Th17比例、血清IL-17水平与血清VCAM-1、ox-LDL、ET-1水平的相关性
3 讨论
随年龄增长,机体的结构及组织代谢率等各方面指标都有所下降。有学者把机体的细胞免疫指标改变作为衰老的特征[8]。现有研究[9,10]曾报道老年人及小鼠体内Th17比例和功能改变情况。ACI的发生主要是由向脑部供应血液的动脉发生血栓导致,其主要病理学基础为AS及斑块的破裂。AS是心肌梗死、脑梗死等心脑血管疾病的病理基础。AS的病因学说有很多,包括内皮损伤、脂质代谢异常、炎症学说等,但具体发生机制尚未明确,其中,炎症学说日益受到学者的认可[11,12]。AS也被认为是一种炎症性疾病,T细胞作为重要的免疫细胞,在动脉粥样硬化发生发展中发挥重要作用[13]。
Th17是由初始T细胞在IL-6、转化生长因子β(TGF-β)等的诱导下分化而成[11]。临床研究中发现,在AS动脉斑块中有大量T细胞浸润,这其中就包含了Th17的存在。淋巴细胞分泌的细胞因子可促进血管内皮细胞分泌VCAM-1、ET-1等细胞因子和趋化因子[14],这些因子又促进斑块破裂形成血栓。Th17被认为是动脉粥样硬化的致病因素之一,参与粥样斑块破裂的炎症过程[15]。衰老与T细胞免疫有关,包括胸腺萎缩和T细胞亚群变化[16]。但Th17在衰老进程和ACI发生中的作用尚不明确。为了阐明Th17在衰老进程和ACI发生中的作用,我们检测了健康青年人、健康中年人、健康老年人及老年ACI患者外周血中的Th17。本研究发现,与健康青年人和健康中年人相比,健康老年人外周血Th17比例及血清IL-17、VCAM-1、ET-1、ox-LDL水平显著提高。同时,老年ACI患者外周血Th17比例及血清IL-17、VCAM-1、ET-1、ox-LDL水平均显著高于健康老年人、健康中年人和健康青年人。另外本研究还发现,外周血Th17比例、IL-17水平与VCAM-1、ET-1、ox-LDL均呈正相关。
内皮细胞的衰老和损伤是血管病变的初始事件[17]。血管内皮细胞衰老过程中,VCAM-1和ET-1的过度表达使得白细胞聚集并黏附在内皮细胞上,从而加剧了血管壁的破坏和组织缺氧的炎症反应[18]。本研究结果显示,老年人体内Th17表达增高与内皮细胞衰老有关,作为Th17的特异性因子,IL-17有可能诱导内皮细胞衰老,进而参与动脉粥样硬化和ACI发生。而ox-LDL为重要的致动脉粥样硬化因子。本研究发现,随着年龄增长,ox-LDL水平增高。健康老年人较健康青年人和健康中年人体内ox-LDL水平明显上升,而老年ACI患者ox-LDL水平又明显高于老年健康人群。这表明ox-LDL不仅在动脉粥样硬化、ACI发生中发挥重要作用,还与衰老密切相关。ACI病因复杂,脂质代谢障碍为其病变基础,但最重要的病理过程是巨噬细胞吞噬ox-LDL形成泡沫细胞并沉积在血管内膜。Th17分泌的IL-17能够诱导炎症因子和趋化因子分泌,加重局部组织损伤[19]。在本研究中,Th17比例、IL-17水平与ox-LDL水平呈正相关,提示在衰老或ACI过程中,Th17、IL-17与ox-LDL之间存在相互作用关系。本课题组前期研究也发现Th17参与ACI的发生[20]。
综上所述,健康老年人外周血Th17比例及血清IL-17、VCAM-1、ET-1、ox-LDL水平增高,在老年ACI患者增高更明显;而且,Th17比例、IL-17水平与VCAM-1、ET-1、ox-LDL水平均呈正相关。上述研究结果提示,Th17/IL-17可能在衰老及ACI的发生过程中发挥重要作用。

