人诱导多能干细胞体外多向分化能力的方法验证
冯顶丽,卓丽丹,芦 笛,李 红,郭红延
人诱导多能干细胞(induced pluripotent stem cells, iPSC)是由日本 Yamanaka 研究小组于2006 年首次成功创建[1],随后,国内外多家实验室通过转染外源特定的基因组合来诱导成体细胞向 iPSC的重编程。iPSC类似于胚胎干细胞,具备基因多样性,能自我更新并分化成为多种类型的组织和体细胞。另外,iPSC的诞生克服了胚胎干细胞在临床应用时涉及的移植免疫排斥与伦理问题,且成瘤率较低[2,3]。加之,与胚胎干细胞比较iPSC具有来源广泛的巨大优势,任何一个成体细胞经重编都有获得iPSC的潜能[4],遗传多样性和患者特异性细胞数量呈指数级增长,扩展的细胞库有利于新药在目标人群样本中的测试,从而有助于精准医学的发展[5]。另外,多能干细胞用于诱导产生人体功能性细胞和功能性类器官,构建研究模型。如iPSC经3D培养产生胆管细胞[6],心肌细胞[7],肾脏[8],胃[9],人体肠道器官[10],人肺类器官[11],神经构建体[12]等。这种潜能有利于对遗传性疾病的研究与治疗[13],因此具有重要的临床应用价值。iPSC具有向三胚层细胞分化的能力,本研究旨在验证诱导iPSC为中胚层的成骨细胞、成软骨细胞及外胚层神经细胞的技术方法。
1 材料与方法
1.1 材料 iPSC购自上海中国科学院干细胞库(干细胞库编号为SCSP-1302,细胞描述为将人皮肤细胞诱导成IPS细胞,重编程转录因子为OCT4、SOX2、KLF4、MFC)。mTeSRTM1 培养液 (Stem cell, 加拿大);Matrigel 基质胶 (BD, 美国);DMEM高糖基础培养液、DMEM/F12、胎牛血清(FBS)、Dispase、 B-27补充剂(50X)、N-2补充剂(100X)、MEM非必需氨基酸溶液100X (Gibco); ITS+1、抗坏血酸2-磷酸、β-甘油磷酸钠、碱性磷酸酶检测试剂盒、地塞米松、丙酮酸钠、L-谷氨酰胺、2-巯基乙醇(Sigma,美国);转化生长因子β1(PeproTech,美国);Y27632(APExBIO,美国);40 g/L多聚甲醛、甲苯胺蓝溶液(Solarbio,北京)。倒置显微镜(DSZ2000X,奥特光学,重庆)。
1.2 方法
1.2.1 iPSC的培养 使用DMEM-F12培养液按30∶1 比例稀释Matrigel 基质胶预先处理培养板,约2 h, iPSC复苏后培养在预先处理好的六孔板内,培养液为补充有10 mM Y27632(ROCK1抑制剂)的mTeSR1,置于37 ℃ 5% CO2的饱和湿度培养箱中培养,每日更换培养液mTeSRTM1,直到细胞生长至六孔板底面积的80%~90%,进行传代。
将生长至六孔板底面积的80%~90%的iPSC,PBS 冲洗 2 遍,用dispase酶消化并中和后,用移液管尽可能划成均匀小块状后,用刮板收集iPSC 悬浮于EB形成培养液中 (DMEM-F12培养液+2 mmol/L L-谷氨酰胺+0.2 mmol/L抗坏血酸-2-磷酸), 轻轻吹打5~10次使细胞克隆变为大小较均一的小细胞团,每 2 d 更换1次培养液,培养7 d。
将培养瓶中的EB球,用DMEM-F12 基础培养冲洗 2 遍后,更换MSCs 诱导培养液(DMEM高糖基础培养液+10% FBS+2 mmol/L L-谷氨酰胺+0.1 mmol/L 2-巯基乙醇+非必需氨基酸),将培养液和细胞的混合液吸至Matrigel 基质胶铺板的6孔板内,让其贴壁并增殖4~7 d,进行下一步操作,后续所有实验均重复3次。
0.25%胰酶消化细胞制成单细胞悬液,接种至6孔板内,并继续使用 MSCs诱导培养液培养细胞,当细胞达到90%后,0.25%胰酶消化细胞并按照1∶3的比例进行细胞传代培养。传代培养的细胞可用来进行流式细胞术表面标志物的鉴定及成骨、成软骨的鉴定。
1.2.2 流式细胞术鉴定细胞表面标志 胰酶消化iPS-MSCs 后重悬细胞分为5管,每管加入浓度为 2×105/100 μl细胞悬液后,300 g 离心7 min 后去上清,分别加入荧光标记小鼠抗人单克隆抗体CD29 CD105 CD34 CD45,对照管不做处理;室温下避光反应15 min,加入1 ml PBS混匀,以300 g离心7 min,洗涤3次。200 μl PBS液重悬,上机进行检测。
1.2.3 成骨诱导分化及检测 将诱导的MSCs 样细胞以8×104个/cm2的密度接种于6孔板,第 2天换成骨诱导液(α-MEM、15% 胎牛血清、0.1 μmol/L地塞米松、50 μmol/L维生素 C、10 mmoL/L β-甘油磷酸钠),每 3 d换液 1次。诱导期间每天在倒置显微镜下观察细胞形态变化。成骨诱导14 d后按试剂盒说明进行碱性磷酸酶(Alkaline phosphatase)活性检测,倒置显微镜观察染色细胞并拍照。
1.2.4 成软骨诱导 将3×105个iPS-MSCs细胞置于15 ml聚丙烯管中,以1200 r/min离心3 min,并重新悬浮于软骨形成培养液(高糖DMEM,10%FBS,1%ITS+1,1mM丙酮酸钠,50 μg/ml抗坏血酸2-磷酸,50 μg/ml脯氨酸,人10 ng / ml TGF-β1,100 nM地塞米松),旋松离心管盖,正立于37 ℃、5% CO2、湿度大于 95% 的培养箱培养。24 h 后,加入成软骨诱导体系 0.5 ml。每 3 d换液,诱导4周后,将细胞微球以 10%中性甲醛固定,送病理科进行石蜡包埋切片。切片用5% 甲苯胺蓝37 ℃染色 30 min,水洗、封片、拍照。
1.2.5 成神经细胞诱导 将EB 铺板,培养4 d的细胞以8×104个/cm2的密度接种于 6孔板,第 2天换成神经细胞诱导液[DMEM / F-12培养液,神经基础培养液,1%FBS,1×谷氨酰胺,1× N2添加剂,和1×B27添加剂],BDNF/GDNF 10 μg/ml诱导期间每天在倒置显微镜下观察细胞形态变化。
2 结 果
2.1 iPSC及诱导后细胞形态的变化 iPSC在Matrigel 基质胶上呈典型的克隆状生长,克隆呈集落状、隆起的圆形或者椭圆形,边界清晰,细胞团内细胞排列紧密,界限和形态不易区分(图 1A);将细胞团进行悬浮培养形成EB过程中,细胞团逐渐变大且变得致密,显微镜下为大小较为均匀的小球(图 1B);将EB球接种在6孔板后,细胞球在板内铺展生长,增殖速度加快,细胞之间排列更加致密,细胞呈现层叠生长(图 1C);单个细胞接板进行培养后,可见细胞体积逐渐增大,逐渐向集落周围伸展,随着培养天数的增多,向外伸展的细胞逐渐增多,并呈圆形或椭圆形平铺于培养板底,细胞排列紧密,胞质丰富(图1D)。
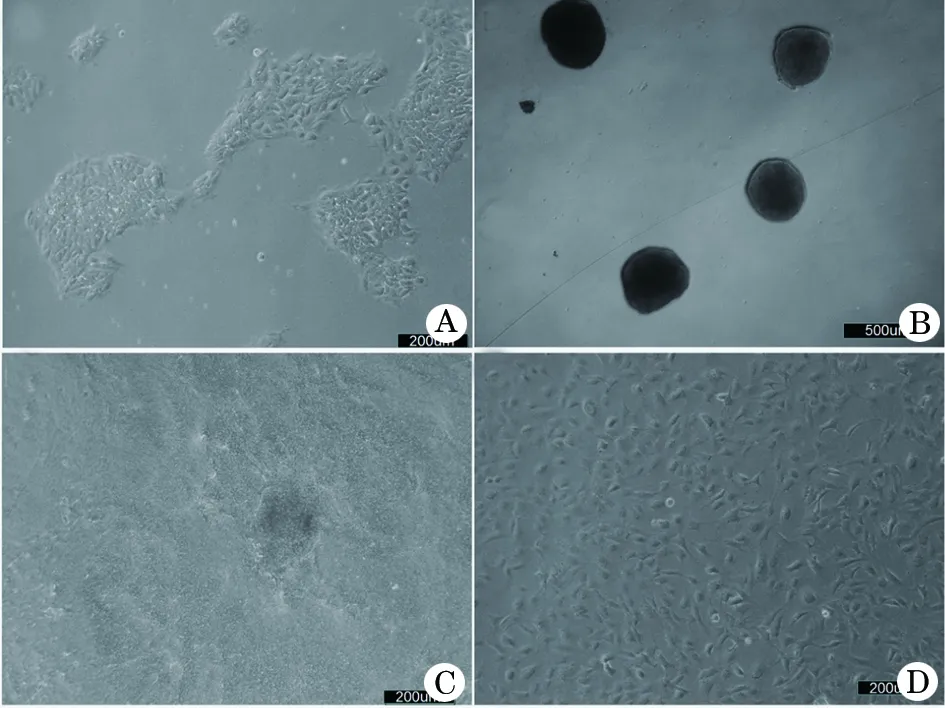
图1 iPSC向MSCs细胞分化过程中不同阶段细胞形态
2.2 细胞表面标志物的鉴定 流式细胞术结果显示,iPSC中 CD105、CD29表达阳性, CD34、CD45表达阴性,符合iPSC--- MSCs表面标志物表达结果(图2)。
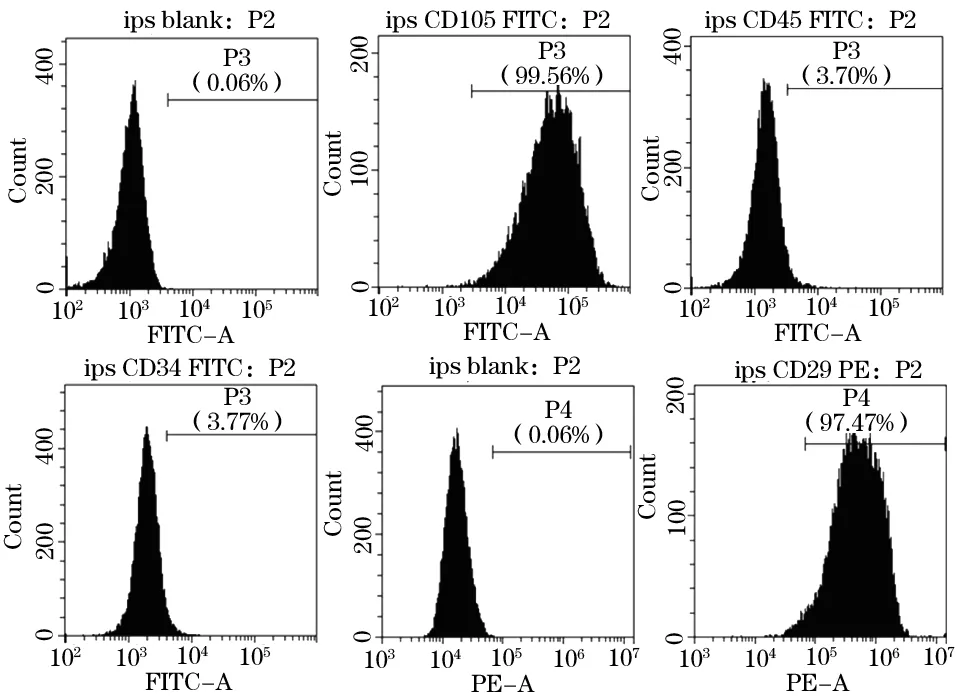
图2 流式细胞术鉴定 iPS-MSCs 细胞表面标志物
2.3 iPSC-MSCs分化能力的鉴定 (1)成骨诱导: iPSC-MSCs成骨诱导14 d倒置显微镜下可见较多细胞由梭形变为多角形和椭圆形,且胞体增大,突起增多,胞核变大变圆,胞质内出现较多颗粒。碱性磷酸酶染色示细胞细胞质内出现蓝色沉淀(图 3A)。(2)成软骨诱导: iPSC-MSCs 经成软骨诱导培养液培养4周后可见细胞团聚集成小球状, 切片经 1% 甲苯胺蓝染色后可见软骨基质呈蓝色(图3B)。(3)成神经细胞诱导:经贴壁培养可观察到神经纤维状突起呈放射状从克隆团周围伸出。维持培养,形态学改变的细胞数目增加,细胞分叉增多,呈现神经元样形态(图3C)。
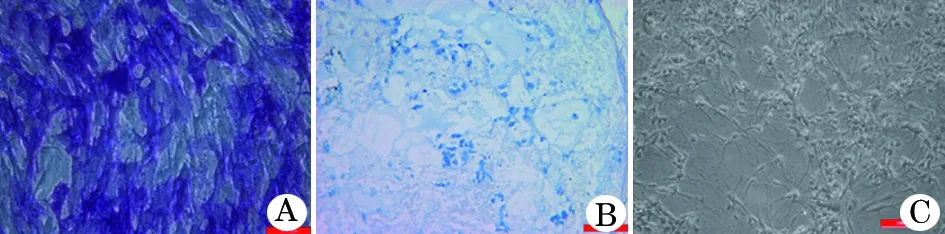
图3 iPSC-MSCs 多向分化能力的鉴定
3 讨 论
iPSC 技术的诞生极大丰富了干细胞的来源[14,15]。近年来,iPSC技术发展迅速,早期如致瘤率高、诱导效率低、iPSC全能性差等问题都逐渐得到解决。目前,虽然iPSC还不能完全代替胚胎干细胞,但是其成功地避免了免疫排斥和伦理问题,因此成为再生医学理想的种子细胞。
本实验培养的人iPSC具有和胚胎干细胞类似的生长特性,能在体外长期稳定地传代培养并保持未分化状态。将iPSC培养形成EB球后,经特定培养液诱导后外胚层细胞可分化为神经细胞,中胚层细胞经诱导培养可表现出MSCs 的生长特性和分化特性,中、外胚层的多向分化特性综合证明了该实验培养及诱导方法的有效性和可借鉴性。
在iPSC的培养阶段,诸多研究者会用滋养层对iPSC进行培养[16-18],但因考虑到饲养层细胞的好坏可以影响iPSC细胞的生长状态及进行饲养层培养的复杂性,本实验以Matrigel 基质胶代替饲养层组织,结合 mTeSRTM 1 培养液培养iPSC,简化了实验操作过程。
iPSC培养形成EB球后,因神经细胞是由外胚层细胞分化而来,本实验将形成的EB球直接用于成神经细胞诱导培养而不经过MSCs阶段,区别于后续成骨、成软骨细胞的诱导。
从EB球到诱导形成MSCs 样细胞, 并经多次传代纯化MSCs细胞。从形态学上发现MSCs 样细胞逐渐展现出长梭形。表面标记已成为鉴定MSCs群体的标准工具,通过流式细胞术鉴定iPSC-MSCs 表面标志物表达情况时发现iPSC-MSCs中 MSCs标记物内皮糖蛋白CD105,整合素家庭成员CD29 均表达阳性,表达量分别为 99.56%和99.47%,造血干细胞标志物 CD34 和泛白细胞标志抗原CD45 均表达阴性(3.77% 和3.70%),与MSCs 表面标记物的表达结果相符。说明通过该方法可以成功将 iPSC 诱导为MSCs样细胞,诱导后 iPSC -MSCs 经多次传代后均能保持一致,且经分化诱导后,成骨、成软骨染色都为阳性结果。
本实验中iPSC -MSCs的诱导是采取经典策略---逐步分化,即先将iPSC 在体外形成拟胚体,随后通过更换拟胚体细胞培养液培养,再进一步使用MSCs培养液诱导其分化为MSCs样细胞,最后通过诱导分化培养液将MSCs样细胞进行定向诱导分化[11-13]。该方法获得的MSCs样细胞纯度高,但需经过多次传代分选,操作相对繁琐。有研究者在此基础上做了简化,iPSC不先形成EB球,而是通过将iPSC一步分化为MSCs后诱导为谱系细胞[14,15]。
本研究采用较为简便的方法成功验证iPSC的多向分化能力,为进一步研究和应用iPSC 奠定了理论和技术基础。随着研究的深入,iPSC可能成为再生治疗组织损伤的一种新的细胞来源。但是,iPSC的研究仍处于初级阶段,今后需要更深入研究iPSC定向分化的具体机制、调控要点、影响因素等,明确功能恢复机制、优化细胞移植条件,使得iPSC真正成为再生医学中的理想工具。

