MEK/ERK信号转导通路在大鼠糖尿病白内障中的作用△
黄亚琳 张颖 王应飞 吴众 史平玲
人口老龄化的加剧和饮食及生活习惯的改变使得糖尿病的发病率有逐年升高的趋势[1-2]。糖尿病白内障为糖尿病的常见并发症,也是临床上致盲的重要原因之一[3]。但目前关于糖尿病白内障发病的分子机制尚不明确。丝裂原细胞外信号调节激酶(mitogen extracellular signal-regulated kinase,MEK)/细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)信号转导通路参与了胚胎发育、组织重建及血管形成等多种进程,且与多种眼部疾病的发病过程密切相关[4-6]。本研究旨在分析MEK/ERK信号转导通路在大鼠糖尿病白内障中的作用机制,为相关药物研发及临床治疗提供参考。
1 材料与方法
1.1 主要试剂及仪器链脲佐菌素(streptozocin,STZ)和PD98059购自美国Sigma Aldrich公司;兔抗大鼠Ras、兔抗大鼠Raf购自美国Cell Signaling公司;兔抗MEK及兔抗ERK1/2购自美国R&D公司;HRP标记的二抗及DAB显色液购自武汉博士德生物工程有限公司;BCA蛋白浓度测定试剂盒PC0020购自中国Solarbio公司;增强化学发光试剂盒WBKLS0100购自美国Millipore公司;化学发光仪FluorChem HD2购自美国Alpha Innotech公司。
1.2 实验动物及分组健康SPF级1月龄雄性SD大鼠60只,购自上海市实验动物中心,饲养于SPF级动物实验室,实验期间动物房环境温度(23.0±2.0)℃,相对湿度40%~70%,换气次数>15次·h-1,明暗12 h交替。每天观察动物状态,每周称体质量。动物使用符合河南省眼科研究所实验动物伦理委员会要求。随机分为正常对照组、模型组和PD98059处理组,每组各20只。
1.3 大鼠模型的建立模型组和PD98059处理组大鼠建立糖尿病模型,两组大鼠均给予高脂高糖饮食4周后,按60 mg·kg-1体质量腹腔注射用柠檬酸缓冲液配制的10 g·L-1的STZ,正常对照组注射等量的柠檬酸缓冲液。注射前大鼠禁食不禁水12 h以上,注射后2 h喂食,72 h后取尾血测空腹血糖。空腹血糖≥11.1 mmol·L-1者为糖尿病模型造模成功。PD98059处理组大鼠双眼均于注射STZ前1 d前房内注射2.5 μg(5 μL)PD98059,正常对照组与模型组大鼠眼前房内仅注射PBS。
1.4 观察指标注射STZ后每日观察大鼠双眼晶状体透明度,同时观察各组大鼠一般状况,包括饮水量、摄食量、尿量和体质量。于注射STZ后8周取尾血检测血糖,并使用日立7600型全自动生化分析仪检测各组大鼠总胆固醇。
1.5 Western blot检测注射STZ 后8周,使用一氧化碳吸入窒息法处死各组大鼠,取双眼眼球,分离出晶状体组织,使用蛋白裂解液提取组织蛋白,利用BCA蛋白浓度测定试剂盒测定蛋白浓度。以等量蛋白进行100 g·L-1SDS-PAGE凝胶电泳并转印至PVDF膜上,使用50 g·L-1脱脂奶封闭并用一抗(11000 稀释)4 ℃孵育过夜,辣根过氧化物酶标记的二抗(13000稀释)孵育后,增强化学发光试剂盒显色,使用化学发光仪检测MEK/ERK信号转导通路相关蛋白Ras、Raf、MEK和ERK1/2的表达,以β-actin为内参,样品相对蛋白表达量=灰度值目的蛋白/灰度值β-actin。
1.6 统计学分析采用SPSS 21.0统计软件对数据进行统计学分析。计量资料用均数±标准差表示,多组间比较采用单因素方差分析,两两比较采用SNK-q检验进行。P<0.05为差异具有统计学意义。
2 结果
2.1 各组大鼠基本状态观察正常对照组大鼠8周内摄食量、饮水量及排尿量均无明显改变,裂隙灯下检查晶状体未发生混浊。模型组大鼠的摄食量、饮水量及排尿量在注射STZ后4周明显增加,晶状体开始出现周边空泡增多、絮状混浊;注射STZ后8周,摄食量、饮水量及排尿量达到正常对照组的2.5倍,整个晶状体出现明显混浊。PD98059处理组大鼠的摄食量、饮水量及排尿量在注射STZ后4周也较正常对照组增加,晶状体周边可见少许空泡出现;注射STZ后8周,摄食量、饮水量及排尿量达到正常对照组的2.0倍,晶状体出现絮状、片状等部分混浊,但程度较模型组有所缓解。
2.2 各组大鼠血糖及总胆固醇水平注射STZ后8周,与正常对照组相比,模型组大鼠的血糖及总胆固醇水平均明显升高,差异均有统计学意义(均为P<0.05);PD98059处理组大鼠的血糖及总胆固醇水平均较模型组明显降低,但仍高于正常对照组,差异均有统计学意义(均为P<0.05)。见表1。
表1 各组大鼠血糖及总胆固醇水平
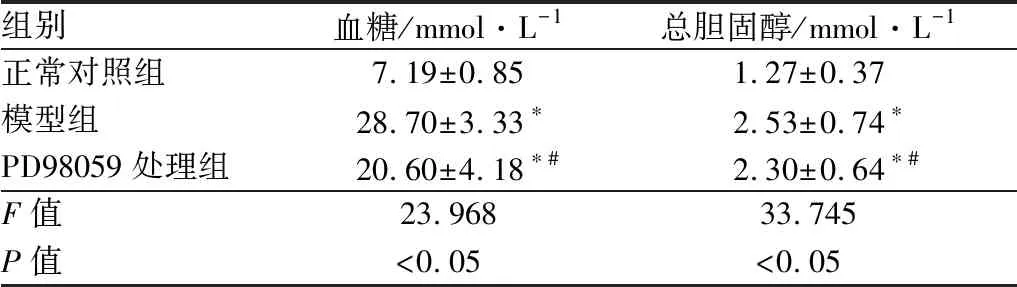
组别血糖/mmol·L-1总胆固醇/mmol·L-1正常对照组7.19±0.851.27±0.37模型组28.70±3.33∗2.53±0.74∗PD98059处理组20.60±4.18∗#2.30±0.64∗#F值23.96833.745P值<0.05<0.05
注:与正常对照组相比,*P<0.05;与模型组相比,#P<0.05
2.3 各组大鼠晶状体内Ras及Raf蛋白表达情况注射STZ后8周,与正常对照组相比,模型组大鼠晶状体内Ras及Raf蛋白的相对表达量均明显升高,差异均有统计学意义(均为P<0.05);PD98059处理组Ras及Raf蛋白的相对表达量均较模型组显著降低,但仍高于正常对照组,差异均有统计学意义(均为P<0.05)。见表2和图1。
2.4 各组大鼠晶状体内MEK及ERK1/2蛋白表达情况注射STZ后8周,与正常对照组相比,模型组大鼠晶状体内MEK及ERK1/2蛋白的相对表达量均明显升高,差异均有统计学意义(均为P<0.05);PD98059处理组MEK及ERK1/2蛋白的相对表达量均较模型组显著降低,但仍高于正常对照组,差异均有统计学意义(均为P<0.05)。见表3和图2。
表2 各组大鼠晶状体内Ras及Raf蛋白相对表达量
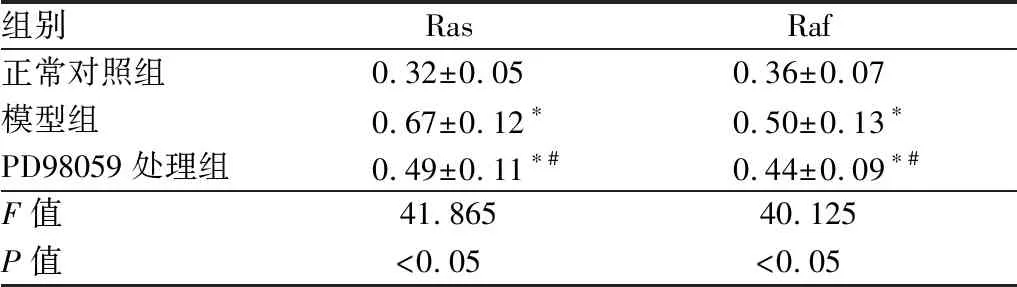
组别RasRaf正常对照组0.32±0.050.36±0.07模型组0.67±0.12∗0.50±0.13∗PD98059处理组0.49±0.11∗#0.44±0.09∗#F值41.86540.125P值<0.05<0.05
注:与正常对照组相比,*P<0.05;与模型组相比,#P<0.05

图1 Western blot示各组大鼠晶状体内Ras及Raf蛋白表达情况
表3 各组大鼠晶状体内MEK及ERK1/2蛋白相对表达量
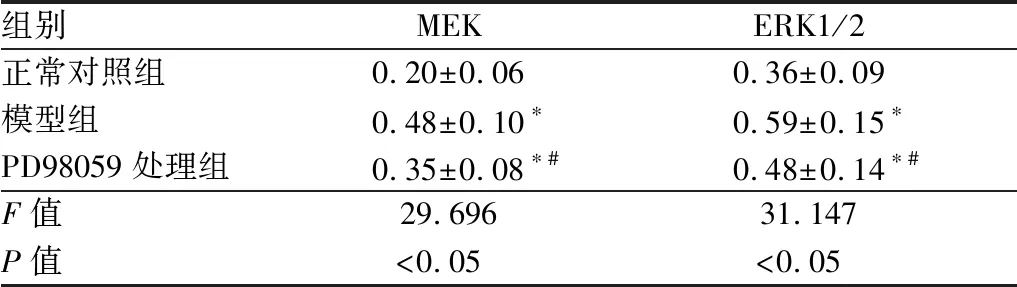
组别MEKERK1/2正常对照组0.20±0.060.36±0.09模型组0.48±0.10∗0.59±0.15∗PD98059处理组0.35±0.08∗#0.48±0.14∗#F值29.69631.147P值<0.05<0.05
注:与正常对照组相比,*P<0.05;与模型组相比,#P<0.05

图2 Western blot示各组大鼠晶状体内MEK及ERK1/2蛋白表达情况
3 讨论
白内障为临床上致盲的常见原因,也是糖尿病常见的并发症,严重影响患者的生活质量。虽然目前关于糖尿病并发白内障的分子机制尚未完全明确,但肯定是多重因素作用的结果。有研究发现,MEK/ERK信号转导通路是介导细胞外因子引起细胞反应的共同通路[7]。在局部组织成纤维细胞增殖侵袭过程中,该通路的激活发挥了重要作用。ERK是一类具有丝氨酸和酪氨酸双重磷酸化能力的蛋白激酶,被上游特异性信号分子激活后呈活化状态,活化的ERK1/2进入细胞核内,进而活化一系列转录因子,包括启动基质金属蛋白酶-2和基质金属蛋白酶-9的表达,并通过水解细胞外基质来促进细胞增殖、分化和侵袭[8]。ERK的分泌增加和功能增强可促进细胞增殖,而其受抑制后则可抑制细胞增殖[9]。
本研究为了分析MEK/ERK信号转导通路在大鼠糖尿病白内障发病中的参与情况,将STZ诱导的糖尿病大鼠经MEK/ERK抑制剂PD98095处理,观察其白内障发生情况及相关蛋白表达。结果发现,注射STZ后4周模型组大鼠的晶状体周边空泡增多、絮状混浊,注射STZ后8周整个晶状体出现明显混浊;而PD98095处理后的糖尿病大鼠晶状体周边空泡及混浊产生延迟且程度较模型组大鼠明显减轻。与正常对照组相比,模型组大鼠的血糖、总胆固醇及MEK/ERK信号转导通路相关蛋白Ras、Raf、MEK和ERK1/2蛋白表达水平均明显升高,而PD98059处理组大鼠的上述指标虽然仍高于正常对照组,但已得到显著恢复,说明MEK/ERK信号转导通路参与了SD大鼠糖尿病白内障的发病过程,对该通路的抑制则能减缓白内障的进程。进而推测,对该信号通路的调控将为糖尿病白内障的治疗研究提供参考。
已有研究显示,MEK/ERK信号转导通路参与了多种眼部疾病的发生及发展过程[10-11]。在分析去整合素echistatin对糖尿病兔后发性白内障形成中信号转导通路PI3-K/Akt和ERK1/2的影响时发现,去整合素echistatin对糖尿病兔后发性白内障的发生和发展有一定的抑制作用,其发生的机制可能与抑制信号因子Akt和ERK1/2的表达,进而阻断信号通路PI3-K/Akt和ERK1/2的转导有关[12]。在分析MEK/ERK信号转导通路对人结膜上皮细胞增殖的影响及其机制的研究中也发现,PD98059可抑制人结膜上皮细胞增殖,这可能与其下调ERK表达和减少其活化有关[13]。Marilyn等[14]研究表明,过氧化氢可以刺激视网膜神经细胞发生明显的细胞凋亡,且此过程与MAPK/AP1信号通路的过度活化有关。Kar等[15]研究表明,丝裂霉素能够抑制阻塞性泪道模型Nd:YAG激光治疗后的细胞增殖、侵袭及MEK/ERK信号通路激活。曹婷等[16]研究表明,氟西汀可以激活体外培养的正常人结膜上皮细胞内的MAPK-ERK信号通路并导致相关炎症因子的产生。Imai等[17]和Xie等[18]研究均表明,臭氧治疗能够减少糖尿病大鼠视网膜组织中凋亡细胞的数目,同时能够减轻神经细胞损伤、抑制血管新生和内质网应激。本研究结果证实,经STZ诱导的糖尿病大鼠晶状体内MEK/ERK信号转导通路相关蛋白Ras、Raf、MEK和ERK1/2的相对表达量均显著升高,相对应出现晶状体的混浊,而PD98059可延缓晶状体混浊的出现。但应当指出的是,细胞内的活性蛋白为其磷酸化的形式,本研究仅对MEK/ERK信号转导通路相关蛋白的总蛋白表达进行了分析,未对其磷酸化形式蛋白的表达情况进行研究。在以后的研究中我们将进一步分析各蛋白磷酸化形式的表达,为相关研究提供更多参考。
综上,本研究发现,MEK/ERK信号转导通路的激活参与了糖尿病大鼠白内障的发病过程,而其抑制剂PD98059能够下调该通路蛋白的表达,从而一定程度上延缓了晶状体混浊的发生。本研究为糖尿病合并的白内障防治提供了思路。

