替米沙坦对糖尿病小鼠早期视网膜病变的抑制作用及机制△
曹子群 姜涛 宗瑶 杨雪娇 王云霄 孙哲 葛朋飞
糖尿病视网膜病变(diabetic retinopathy,DR)是导致职业人群后天性失明的首要原因[1]。有研究指出,肾素-血管紧张素系统(RAAS系统)不仅参与了全身血压的调控,在糖尿病患者体内还与高血糖相互影响[2-3]。国外有研究从基因水平证实,眼内存在独立的RAAS系统及其相关受体[4]。RAAS系统及其受体如何影响DR,抑制RAAS系统是否对DR发生发展产生影响正日益受到重视。本研究拟通过建立糖尿病小鼠模型并给予玻璃体内注射替米沙坦的干预治疗,观察并分析替米沙坦对血管内皮生长因子A(vascular endothelial growth factor-A,VEGF-A)、晚期糖基化终末产物受体(receptor for advanced glycosylation end product,RAGE)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的表达及DR视网膜组织显微结构及视网膜血流灌注状态的影响,进一步探讨替米沙坦对DR的防治作用。
1 材料与方法
1.1 材料
1.1.1 实验动物C57BL/6J小鼠70只,SPF级,6周龄,雄性,体质量(19.88±2.31)g,购于济南朋悦实验动物繁育有限公司[合格证号:SCXK(鲁)20140007]。
1.1.2 药物及试剂替米沙坦购于索莱宝(分析纯用),在无菌环境下取10 mg替米沙坦纯品溶于100 μL NaOH溶液中,生理盐水稀释2次至浓度为0.5 g·L-1,盐酸滴定pH为8.3[5]。康柏西普眼用注射液(康弘朗沐药业产品);兔抗鼠VEGF-A抗体、兔抗鼠RAGE抗体、兔抗鼠TNF-α抗体(美国Abcam公司,批号分别为ab52917、ab216329、ab6671);链-脲佐菌素(streptozotocin,STZ)、异硫氰酸荧光素葡聚糖(FITC-Dextran,相对分子质量2×106;Sigma公司,美国)。
1.1.3 仪器5 μL微量加样器及33G针头(瑞士Hamilton公司),强生血糖仪(美国强生医疗器械有限公司),解剖显微镜(德国Zeiss公司),显微器械(苏州医疗器械厂),BH-2型光学显微镜(日本Olympus公司),倒置荧光显微镜、RM2016型切片机(上海医疗器械有限公司),病理组织漂烘处理仪(上海和利实业有限公司),光学显微镜(德国Zeiss公司)。
1.2 方法
1.2.1 动物模型建立及分组所有C57BL/6J小鼠适应性饲养1周后开始实验,随机分为空白对照组(10只)、溶剂对照组(10只)和糖尿病组(50只)。空白对照组小鼠不做处理;50只糖尿病组小鼠使用高糖高脂饮食饲养1个月,禁食12 h后给予腹腔注射STZ溶液(STZ溶于0.1 mol·L-1、pH 4.2的柠檬酸钠缓冲液),按照50 mg·kg-1的剂量连续注射5 d,STZ注射1周后检测空腹血糖(禁食时间大于12 h),空腹血糖大于13.9 mmol·L-1的小鼠纳入糖尿病组;溶剂对照组小鼠腹腔注射同等剂量的柠檬酸钠溶液。模型诱导成功后,糖尿病组小鼠在此基础按干预方式随机分为:替米沙坦组(18只),康柏西普组(18只),模型对照组(14只)。实验过程中,造模后1个月模型对照组和康柏西普组小鼠各死亡2只,造模后2个月替米沙坦组小鼠死亡1只,均及时补充小鼠。
1.2.2 给药方法从模型建立成功开始算起第17周给予干预治疗,选取所有糖尿病组小鼠左眼为实验眼,右眼不做处理为阴性对照。治疗当天模型对照组左眼玻璃体内注射2.5 μL生理盐水、康柏西普组左眼玻璃体内注射1 g·L-1康柏西普溶液2.5 μL(含康柏西普 2.5 μg)、替米沙坦组左眼玻璃体内注射0.5 g·L-1替米沙坦溶液 2.5 μL(含替米沙坦1.25 μg)。
1.2.3 动物标本采集干预处理的糖尿病小鼠分别在给药后饲养4周,空腹12 h后测量血糖和体质量,与同时期的空白对照组和溶剂对照组,每组随机选取一定数量的小鼠麻醉后脱颈处死,迅速摘取双眼,为后续的Western-blotting检测和HE染色做准备。
1.2.4 Western-blotting检测各组小鼠视网膜中VEGF-A、RAGE、TNF-α的蛋白表达给药4周后每组随机选取6只小鼠摘取双侧眼球,提取视网膜组织总蛋白,并用酶标仪测量蛋白浓度,计算含30 μg 蛋白的溶液体积为上样量,与蛋白缓冲液混合后100 ℃加热5 min使其变性,加入聚丙烯酰胺凝胶中进行电泳。电泳结束后在转膜缓冲液中浸泡5 min,进行转膜,将蛋白转至PVDF膜上。封闭、洗膜后分别加入一抗:兔抗VEGF-A(110 000)、兔抗TNF-α (15000)、兔抗RAGE(15000)、兔抗β-actin(15000),4 ℃过夜后洗膜,分别加入二抗:羊抗兔(110 000)抗体。室温孵育2.5 h,进行3次TBST洗膜,每次15 min。用ECL化学发光法显色,将条带进行扫描并测定各种因子蛋白的吸光度(A)值,用β-actin作为内参。应用A目的蛋白/A内参蛋白的比值比较各目的蛋白的表达。
1.2.5 小鼠视网膜组织病理学检测给药4周后替米沙坦组和康柏西普组每组随机选取6只小鼠,模型对照组随机选取4只小鼠,空白对照组和溶剂对照组每组随机取2只小鼠,麻醉后脱颈处死,摘取双侧眼球,将即刻摘取的眼球放入配制好的固定液中固定超过12 h,将固定好的眼球在体积分数分别为55%、65%、75%、85%、95%、99.99%的酒精中脱水,在无水酒精步骤时去除晶状体,然后二甲苯中透明,石蜡中浸蜡2 h后包埋,切片。用苏木精-伊红素染色,中性树胶封片,观察视网膜显微组织结构的形态。
1.2.6 小鼠视网膜FITC-dextran荧光血管造影给药4周后替米沙坦组和康柏西普组每组随机选取6只小鼠,模型对照组随机选取4只小鼠,空白对照组和溶剂对照组每组随机取2只小鼠,100 g·L-1水合氯醛按1 mL·kg-1体质量腹腔注射麻醉动物。经腹开胸,血管钳夹住下腔静脉,剪开右心耳,将10 mL生理盐水缓慢注射入左心室,观察到小鼠肝叶变白,停止灌注,将50 g·L-1FITC-Dextran 1 mL缓慢注入左心室,可以观察到肝叶变黄绿色以及右心耳有黄绿色液体流出,表明灌注成功。迅速摘除小鼠眼球,置于预冷的60 g·L-1多聚甲醛固定溶液中,0.5 h后解剖显微镜下在角巩膜缘1 mm处用1 mL空针戳孔,剪开眼球壁,仔细去除眼前节,钝性分离视网膜,将剥离完的视网膜组织平铺于载玻片上,甘油树胶封片,立即在倒置荧光显微镜下观察视网膜血管的形态,并拍照。

2 结果
2.1 各小鼠一般结果与空白对照组和溶剂对照组小鼠相比,糖尿病组小鼠精神状况一般,毛发晦暗,活动减少,反应迟钝,摄食及饮水量明显增多,垫料异味较大。
2.2 各组小鼠视网膜中VEGF-A、RAGE、TNF-α蛋白的表达各组小鼠视网膜中VEGF-A、RAGE、TNF-α蛋白表达见图1和表1,结果显示,溶剂对照组与空白对照组相比,VEGF-A、RAGE、TNF-α蛋白表达差异均无统计学意义(PVEGF-A=0.936 9、PRAGE=0.957 3、PTNF-α=0.459 3);模型对照组左眼与右眼相比VEGF-A、RAGE、TNF-α蛋白表达水平差异均无统计学意义(tVEGF-A=2.075,PVEGF-A=0.106 6;tRAGE=0.033 1,PRAGE=0.975 2;tTNF-α=0.1,PTNF-α>0.999),模型对照组VEGF-A、RAGE、TNF-α蛋白表达水平显著高于空白对照组(FVEGF-A=84.30,PVEGF-A<0.000 1;FRAGE=19.71,PRAGE<0.000 1;FTNF-α=48.37,PTNF-α<0.000 1),替米沙坦组左眼VEGF-A、RAGE、TNF-α蛋白表达水平显著低于右眼(tVEGF-A=20.86,PVEGF-A<0.000 1;tRAGE=21.60,PRAGE<0.000 1;tTNF-α=18.81,PTNF-α<0.000 1),康柏西普组左眼VEGF-A、RAGE、TNF-α蛋白表达水平显著低于右眼(tVEGF-A=17.71,PVEGF-A<0.000 1;tRAGE=12.08,PRAGE=0.000 3;tTNF-α=22.69,PTNF-α<0.000 1)。

图1 各组小鼠视网膜中VEGF-A、RAGE和TNF-α的蛋白表达。1:替米沙坦组左眼;2:替米沙坦组右眼;3:康柏西普组左眼;4:康柏西普组右眼;5:模型对照组左眼:6:模型对照组右眼;7:空白对照组;8:溶剂对照组

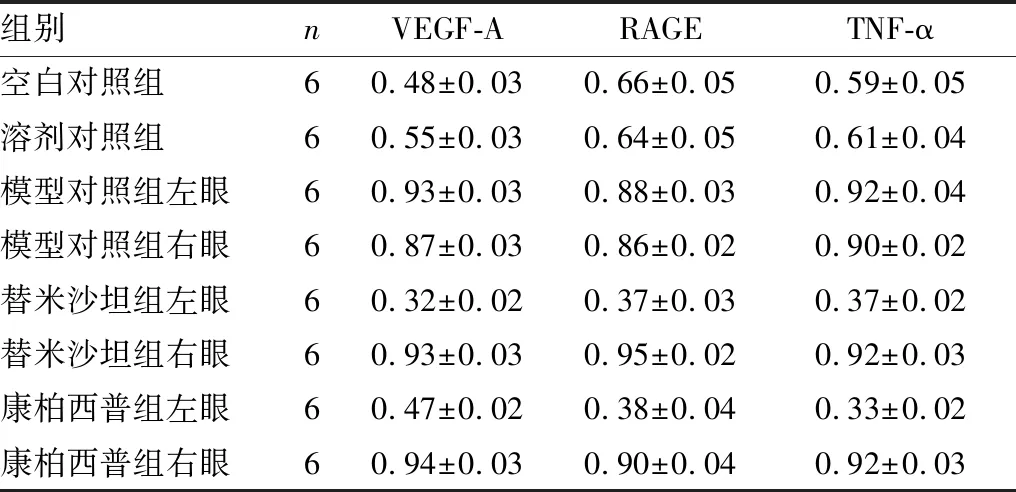
组别nVEGF-ARAGETNF-α空白对照组60.48±0.030.66±0.050.59±0.05溶剂对照组60.55±0.030.64±0.050.61±0.04模型对照组左眼60.93±0.030.88±0.030.92±0.04模型对照组右眼 60.87±0.030.86±0.020.90±0.02替米沙坦组左眼60.32±0.020.37±0.030.37±0.02替米沙坦组右眼60.93±0.030.95±0.020.92±0.03康柏西普组左眼60.47±0.020.38±0.040.33±0.02康柏西普组右眼60.94±0.030.90±0.040.92±0.03
2.3 各组小鼠视网膜组织的结构改变HE染色结果显示,与空白对照组相比,模型对照组小鼠视网膜组织各层细胞排列不规则,厚度变薄,视网膜神经节细胞数目减少,视网膜神经节细胞层可见新生血管长入;康柏西普组左眼与右眼相比,各层细胞排列基本整齐,视网膜厚度变薄不明显,神经纤维层未见明显空泡样变性,内、外核层细胞排列整齐;替米沙坦组左眼与右眼相比,视网膜厚度改变不明显,神经纤维层可见少量空泡样变性,内核层与外核层细胞排列基本整齐。见图2。
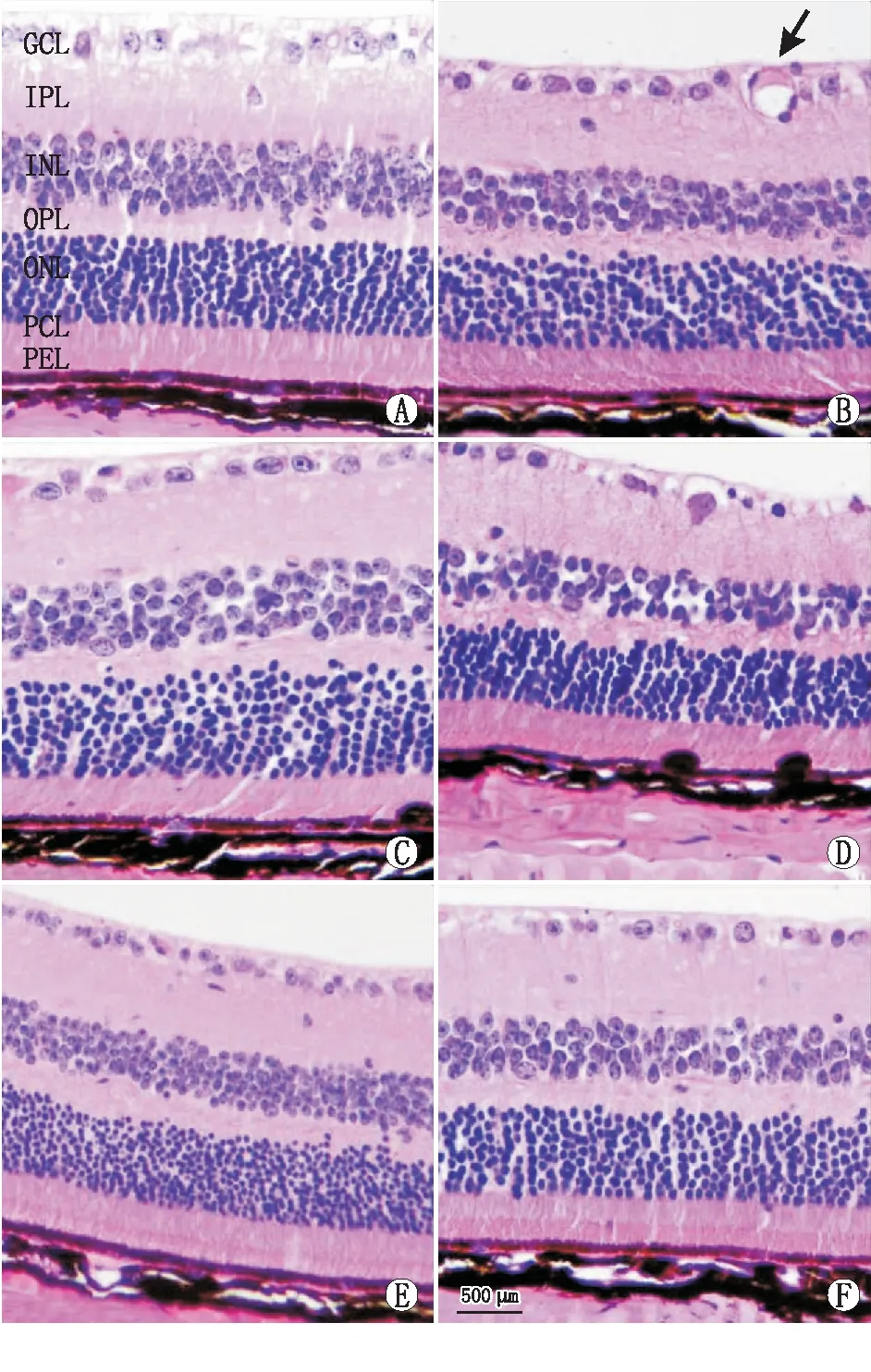
图2 各组小鼠视网膜组织受损情况。A:空白对照组;B:模型对照组;C:替米沙坦组右眼;D:替米沙坦组左眼;E:康柏西普组右眼;F:康柏西普组左眼。箭头所指为新生血管
2.4 各组小鼠视网膜血流灌注的变化荧光血管造影显示,空白对照组小鼠视网膜血管走形平直,呈放射状,浅层血管交织成网状,血流灌注充盈均匀;模型对照组小鼠视网膜浅层血管网血流灌注充盈不均匀,血管形态迂曲;康柏西普组左眼与右眼相比,无灌注区减少,血管形态迂曲减轻,深层血流灌注可见;替米沙坦组左眼与右眼相比,无灌注区明显减少,血管迂曲及不规则扩张减轻,浅层视网膜血管交织成网状。见图3。
3 讨论
本研究利用STZ小剂量多次诱导糖尿病小鼠发生DR病变,模拟人体糖尿病发病的过程。STZ可以特异性地破坏胰岛β细胞,诱导细胞凋亡。通过触发体内抗原抗体结合,进一步放大细胞损伤效应,介导糖尿病的发生[6]。本实验中糖尿病小鼠在造模成功的第5个月时出现视网膜的病理改变,研究发现,糖尿病小鼠视网膜组织中VEGF-A、RAGE、TNF-α蛋白表达显著增多。对比空白对照组小鼠,糖尿病小鼠视网膜组织显微结构出现形态学改变,荧光血管造影显示;模型对照组小鼠视网膜血流灌注不均匀,可见点状荧光素渗漏,血管形态迂曲。国内外已有研究表明,STZ诱导成功的糖尿病模型最早在3个月时即出现视网膜组织的损伤,VEGF-A蛋白表达明显增高,在第17周时可见少量视网膜新生血管[7-8]。血-视网膜屏障(blood retina barrier,BRB)的分解是DR进展的重要步骤。有研究指出,在引起BRB分解的作用机制中,VEGF-A和TNF-α的高表达、大量周细胞凋亡及细胞的氧化应激均发挥关键作用[9]。VEGF-A作为强大的内皮血管生长诱导因子,它的升高诱导紧密连接蛋白的减少;TNF-α作为主要的炎症因子之一,通过介导视网膜白细胞停滞和细胞凋亡逐步破坏BRB,紧密连接蛋白的减少和血管内皮细胞的凋亡将显著增加视网膜血管的通透性[10];RAGE作为晚期糖基化终末产物(AGEs)在细胞表面结合发挥作用的受体蛋白,增多的AGEs可以诱导RAGE表达上调,促进细胞氧化应激,加速周细胞的凋亡,上调VEGF表达促进新生血管的生成[11]。以上因子共同作用促使血管内皮通透性的增加、周细胞的凋亡及BRB的分解与破坏,临床上表现为视网膜出血、渗出、水肿,微血管瘤增生,新生血管长入。
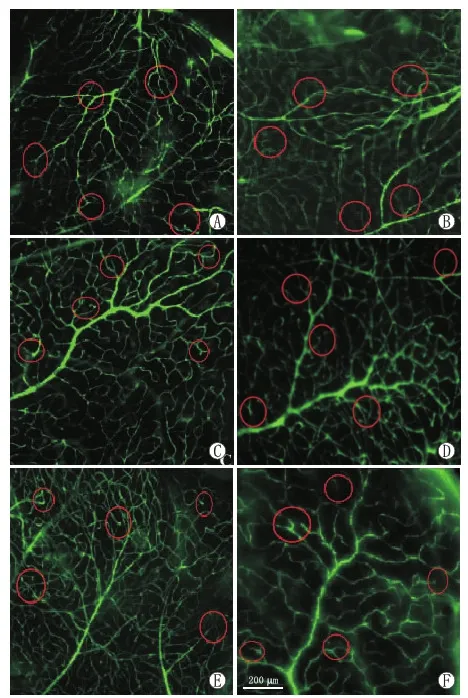
图3 各组小鼠视网膜血流灌注状态。A:空白对照组;B:模型对照组;C:康柏西普组左眼;D:康柏西普组右眼;E:替米沙坦组左眼;F:替米沙坦组右眼。红色标记处为同一位置的对比
Wilkinson-Berka[4]在基因水平证实了人眼内的玻璃体、视网膜、角膜、视网膜色素上皮层等局部组织可以独立合成、分泌血管紧张素Ⅱ(Ang Ⅱ)参与RAAS系统[3,12-13]。还有研究表明,Ang Ⅱ作为RAAS系统的最终产物,在DR患者眼内表达水平是升高的,主要作用由Ang Ⅱ 1型受体(AT1-R)信号介导转导[14],激活的RAAS系统过表达Ang Ⅱ,并激活细胞内的下游信号NF-κB和PKC通路,促进NADPH氧化诱导,加速细胞的氧化应激和炎症因子的分泌,增加VEGF的表达,促进内皮细胞增殖和血管重塑。这两个过程不仅增加了视网膜血管通透性,还导致了炎症细胞的浸润、白细胞黏附及视网膜血流动力学发生改变,最终使得BRB瓦解[14-16]。眼内高血糖水平又能够进一步促进RAAS系统发挥功能作用,加速诱导细胞凋亡、肥大,新生血管、炎症和纤维化的进程[17]。本研究结果显示,糖尿病小鼠左眼给予替米沙坦治疗后,VEGF-A、RAGE、TNF-α蛋白的表达下降,眼内注射替米沙坦溶液可以抑制VEGF-A、RAGE、TNF-α蛋白的表达,延缓视网膜组织显微结构形态学损伤,改善糖尿病小鼠视网膜血流灌注状态。我们推测玻璃体内注射替米沙坦溶液,可以选择性与眼内血管紧张素1型受体(angiotensin receptor type 1,ATR1)结合,抑制Ang Ⅱ介导的RAAS系统的过度激活而延缓BRB的分解过程。国外相关研究表明,已发生DR的小鼠早期腹腔内注射替米沙坦溶剂可以控制DR的发生与发展[18-19]。国内在替米沙坦的相关临床研究中,给予患有高血压的DR患者口服替米沙坦和舒洛地特治疗6个月,随访发现眼底微血管瘤减轻,并延缓了视网膜病变进展的速度[20-21]。替米沙坦作为选择性ATR1抑制剂,在防治DR中的作用中越来越受到重视[4]。本研究通过眼内注射替米沙坦,阻断Ang Ⅱ介导AT1R发挥作用,可以作为DR的治疗新思路[14]。
Ang Ⅱ 1型受体抑制剂(ARB)已成为临床治疗糖尿病肾病和心血管并发症的一线用药。替米沙坦替代Ang Ⅱ与AT1受体亚型(已知的Ang Ⅱ作用位点)高亲和性结合,在AT1受体位点无任何部分激动剂效应,该结合作用持久[22-23],通过阻断RAAS系统,可以有效延缓DR的进展[24]。本研究首次将替米沙坦注入玻璃体内,避免替米沙坦全身应用导致的不良作用,有效提高药物在眼内的作用浓度,减少药物经过BRB的过程。本研究为肾素血管紧张素抑制剂治疗DR提供了新的思路,并进一步明确了DR的发病机制。由于样本量少,观察时间有限,对于替米沙坦对DR的长期影响有待进一步研究。替米沙坦作为一种广泛应用于临床的降压药物,其对DR的抑制作用让我们未来对于替米沙坦和DR的研究更加有信心。
致谢:衷心感谢姜涛导师给予学术上的指导和支持,衷心感谢宗瑶老师给予学术和经济方面的支持。感谢青岛大学附属医院中心实验室全体老师给予的指导和帮助!

