紫山药组织培养快繁技术优化
韩晓勇,王立,殷剑美,张培通,郭文琦,李春宏
(江苏省农业科学院 经济作物研究所,江苏 南京 210014)
紫山药(Dioscoreaalata)是山药(Dioscoreaopposita)中珍贵的精品,因其肉质、表皮红中带紫而得名,富含黏液质、多糖、蛋白质、淀粉和矿物质元素,特别是花色苷含量比较高。花色苷是迄今为止所发现的最强效的自由基清除剂,具有抗氧化衰老、抗突变、抗癌与抗动脉硬化等功能,作为保健食品或辅助治疗药物具有巨大潜力和应用前景[1]。紫山药主要通过块茎繁殖,块茎繁殖用种量大,生产成本较高,易受季节限制,且长期利用块茎繁殖易造成种性退化,抗病性和抗逆性减退[2]。紫山药组培再生体系技术研究不仅有利于品种的更新复壮,获得基因型、长相一致的优良种苗,还可为其种苗工厂化生产提供一定的技术支持。
韩晓勇等[3-4]以台州市紫山药带腋芽的茎段为外植体,建立了台州紫山药组织培养快繁体系,并研究了培养基用量、植物生长调节剂浓度配比、蔗糖浓度,及光照强度对紫山药试管薯形成和生长发育影响。王碧琴等[5-7]以紫山药的茎尖、茎段为材料,对茎尖、茎段诱导分化不定芽进行初步研究,发现培养基中添加抗褐化剂活性炭(AC)、聚乙烯吡咯烷酮(PVP),茎尖比茎段的培养效果好,能明显降低培养基褐化速度,延长培养物培养时间;芽苗在白光源培养下的增殖系数是LED红光的2.3倍,蓝光和紫红混光的1.6倍,生长速率是红光和紫红光的1.8倍,鲜质量是蓝光和紫红光的1.5倍,表明白光是紫山药试管芽苗培养较为理想的光质。蔡月琴等[8]以紫山药无菌苗为试材,研究了植物生长调节剂种类、材料类型、光暗条件等对愈伤组织诱导及其分化的影响。这些研究为紫山药组培苗的培养奠定了一定基础,但关于紫山药茎段取样部位、取样时间、不同世代的繁殖系数和试管薯形成尚未见报道。笔者在前人研究的基础上,进一步优化紫山药组织培养技术,为紫山药良种繁育、种质交换和种质资源保存等奠定基础。
1 材料与方法
1.1 材料
以江苏省农业科学院紫山药品种苏蓣1号为材料。紫山药种植于小高垄上,出苗后备用。
1.2 处理设计
1.2.1 紫山药不同部位的腋芽分化力
取长势一致的紫山药茎,去掉叶片和茎尖1~2节腋芽,将茎段从上到下依次取3节,作上、中、下部3个处理,用剪刀截成1.5~2.0 cm带腋芽的茎段。灭菌后接种在MS+6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1培养基中,接种7 d时统计各处理污染数、死亡数,计算污染率和死亡率;接种25 d后,比较各处理腋芽分化数,计算分化率。每个处理设3次重复,每次重复35个茎段。
1.2.2 紫山药不同生长期的腋芽分化力
紫山药出苗后,分别在07-29、08-12、08-28、09-11和09-26,取带腋芽的茎段,灭菌后接种在MS+6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1培养基中,去除污染茎段。接种25 d后,比较各处理腋芽分化数、总芽数和芽高,计算分化率和平均芽数。每个处理设3次重复,每次重复35个茎段。
1.2.3 紫山药不同接种世代的组培增殖系数
将带腋芽的茎段接种在MS+6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1培养基,培养30 d,将高2.0 cm左右叶片切下,转入生根培养基1/2 MS+6-BA 0.1 mg·L-1+NAA 2.0 mg·L-1+0.02%活性炭培养,连续培养3代,培养45 d。统计每1代的株高、成形叶数、不成形叶数(2 cm以下)和根数,计算有效增殖系数。每个接种世代设3次重复,每次重复10株组培苗。理论上每片叶均带1个节,计理论增殖系数为1,实际上不成形叶并不能用作继代,即有效增殖系数=成形叶数/(成形叶数+不成形叶数)。
1.2.4 不同接种世代对试管薯形成的影响
T1、T2和T3代的组培苗分别培养90 d后,每个世代随机选取10株,调查结薯数、试管薯鲜质量、干质量,3次重复。每个世代随机选取5个种薯,量取长度和周长,3次重复。
1.2.5 培养基灭菌及培养条件
高压灭菌前用1 mol·L-1的KOH调整培养基pH值为5.8,保持121 ℃灭菌20 min。培养室温度为(25±2)℃,光照强度2 000~2 500 lx,光照周期12 h·d-1。培养基中琼脂质量分数为7 g·L-1,蔗糖的质量分数为30 g·L-1。
1.3 数据分析
用Excel 2003和STAT统计软件分析试验数据。
2 结果与分析
2.1 不同部位对紫山药腋芽分化力的影响
在上、中和下部茎段芽数差异不显著的情况下,紫山药植株不同取样部位的腋芽分化力不同。其中,中部茎段发芽数最多,为19.3个;下部的发芽率最高,为76.7%;上部茎段发芽数和发芽率最低,分别为13.3和51.7%。上、中和下部茎段的污染数和污染率无显著差异,但上部茎段死亡数和死亡率显著高于中、下部。

表1 不同部位对紫山药腋芽分化力的影响
注:同列无相同小写字母表示组间差异达0.05水平。
2.2 不同生长期对紫山药腋芽分化力的影响
从表2可以看出,紫山药不同生长期,腋芽分化力不同。其中,8月28日取样的茎段,发芽数、总芽数和发芽率显著高于其他取样时间,分别为22.3、39.3和88.1%。随着山药生长期的推进,茎段腋芽分化率呈先升后降的趋势。7月29日取样的茎段发芽数、总芽数、发芽率和平均芽数均最低,分别为9.7、10.3、37.6%和1.1。不同生长期取样的茎段芽高差异不大,8月12日取样的茎段芽高最低,为1.4 cm,显著低于其他时期。
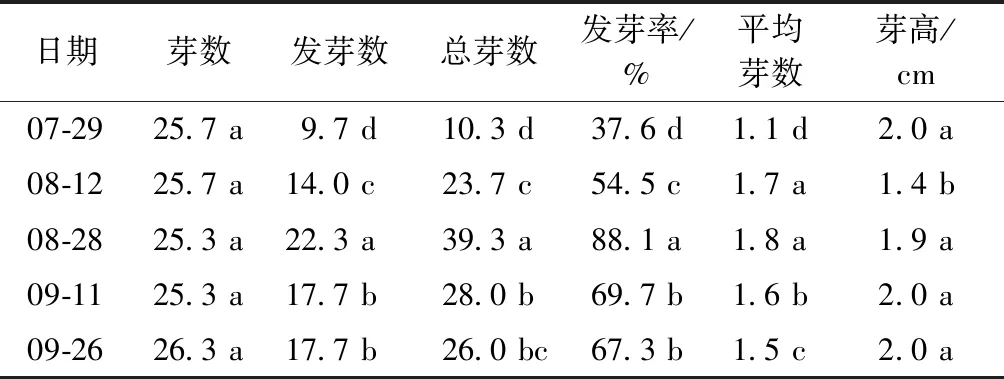
表2 不同生长期对紫山药腋芽分化力的影响
2.3 不同接种世代对紫山药组培增殖系数的影响
从表3可以看出,接种T2代组培苗株高、有效增殖系数显著高于T1和T3代,分别为5.5 cm和9.5。T1代成形叶数最多,为10.2,但不成形叶数也最多,从而影响有效增殖系数。T3代成形叶数等于有效增殖系数,为4.9。T2代之后,随着接种世代的增加,组培苗株高、成形叶数、不成形叶数、根数和有效增殖系数均呈下降趋势。

表3 不同接种世代对紫山药组培增殖系数的影响
2.4 不同接种世代对试管薯形成的影响
从表4可以看出,接种T3代试管薯鲜质量、干质量、薯长和周长显著高于T1和T2代,单株结薯数显著高于T1代。T1和T2代试管薯产量构成无显著差异。

表4 不同接种世代对试管薯产量构成的影响
3 小结
紫山药植株不同取样部位的腋芽分化力不同。中下部茎段发芽数和发芽率显著高于上部茎段,因此,紫山药组培宜取植株中下部茎段,尤其是中部茎段。通常认为,上部茎段较嫩,细胞分裂旺盛,易分化不定芽[9-10];但相同灭菌时间不仅会显著增加上部茎段死亡数和死亡率,而且易对茎段造成伤害,从而影响发芽率。紫山药不同生长发育期,腋芽分化力不同。其中,8月28日取样的茎段,发芽数、总芽数和发芽率显著高于其他取样时间,这可能是由于8月28日处于藤蔓快速生长期、腋芽分化力强所致。随着紫山药生长期的推进,茎段腋芽分化率呈先升后降的趋势,这与植株地上部分生长趋势基本一致。
不同接种世代,紫山药组培增殖系数不同,接种T1和T2代组培苗株高、有效增殖系数显著高于T3代。随着接种世代的增加,组培苗株高、成形叶数、根数和有效增殖系数均呈下降趋势。可能是继代培养过程中组培苗内源生长素水平提高,直接抑制了苗的分化,也可能是多次继代后细胞自身退化,导致分化能力下降。此外,在培养过程中,细胞的核型可能发生变异,染色体出现高度的非整倍性,也会使细胞的形态发生能力下降甚至丧失[11]。接种T3代试管薯鲜质量、干质量、种薯长和周长显著高于T1和T2代,这可能是由于T1和T2代组培苗株高、成形叶数和不成形叶数显著高于T3,造成试管苗营养生长旺盛,影响营养物质向块茎分配和累积,进而减少试管薯的质量。

