距骨骨软骨病变治疗新进展
朱渊 徐向阳
2018年3月29日至31日,中国医疗保健国际交流促进会骨科分会足踝外科学组主办的2018华夏足踝外科学术大会暨第九届上海国际足踝外科高峰论坛在上海瑞金医院成功举行,著名的足踝外科专家、韩国延世大学医疗中心骨科主任Jin Woo Lee教授应邀就“距骨骨软骨病变治疗新进展”作了精彩报告,引起与会者浓厚的兴趣。现经Lee教授同意,笔者将这部分内容加以整理,与骨科同道们分享。
距骨骨软骨病变发病率高,是足踝外科常见疾病。其治疗目的主要为缓解疼痛,同时恢复踝关节功能,以及促使软骨再生和防止软骨退变。
1 距骨骨软骨病变疼痛原因
距骨骨软骨病变产生疼痛的原因主要可分为机械性病理机制和非机械性病理机制。距骨骨软骨病变产生疼痛的机械性病理机制包括:①软骨损伤使得病变产生边缘负荷,导致疼痛;②软骨损伤导致软骨表面出现裂缝,进而引起骨内压增高,形成软骨下骨囊肿,囊肿内压力增高引起疼痛,表现为负重时踝关节深部疼痛;③软骨损伤引起持续性骨水肿,导致软骨下板异常,引发踝关节深部疼痛;④软骨损伤后,距下关节代偿性过度活动引起踝关节下方外侧痛。上述机械性原因引起的疼痛,都与软骨修复无关。也就是说,即便手术修复了软骨损伤,也不一定能缓解踝关节疼痛。
距骨骨软骨病变产生疼痛的非机械性病理机制包括:①软组织撞击;②软骨下骨、滑膜及关节囊内的神经末梢受刺激产生疼痛;③神经末梢受刺激与关节炎P物质增高有关。同样,这些非机械性原因引起的疼痛也与软骨修复无关。
由此可见,距骨骨软骨病变产生疼痛的原因复杂多样,疼痛治疗需要考虑多种因素。
2 目前的治疗选择
关节镜下清理联合骨髓刺激方法是目前使用最广泛的距骨骨软骨病变治疗方法。其临床效果较确切,有效率达80%~85%。然而,手术后再生的软骨是纤维软骨,其强度以及耐久性依然是个问题。Ferkel等[1]报道了50例接受关节镜下病灶清理与微骨折手术治疗的距骨骨软骨病变病例,平均随访71个月;术中发现病变位于距骨内侧者占78%,位于外侧者占12%,位于中间者占10%;术后Alexander评分优良72%,尚可20%,差8%;术后改良Weber评分优良64%,尚可30%,差6%;术后美国足与踝关节协会(AOFAS)踝-后足功能评分平均84分;接受再手术7例,包括再次关节镜下手术6例,踝关节融合术1例。该研究结果表明,关节镜下分期与临床结果呈显著相关。Lee教授[2]工作的韩国延世大学医疗中心从2001年1月至2007年12月总共治疗205人(218例)距骨骨软骨病变,采用图1所示的治疗方案处理,平均随访时间长达151.7个月,其中符合研究标准的患者159人(172例);在172例中手术发现病变位于内侧者139例(81.81%),位于外侧者30例(17.44%),余下3例(1.74%)病变位于中部;软骨缺损类型为包容性者8例 (4.65%),非包容性者 164 例 (95.35%);软骨病变大 小 为 19.75~322.79 mm2,平 均105.36 mm2;关节镜下病变呈多样性,依次为软组织撞击115例(66.86%),软骨下骨囊性变43例(25.00%),小骨块37例(21.51%),游离体30例(17.44%),滑膜炎27例(15.70%),下胫腓联合增宽24例(13.95%),小骨赘3例(1.74%);末次随访时,平均疼痛视觉模拟评分(VAS)从术前的(7.21±1.71)分改善至术后的(1.76±1.60)分,平均AOFAS踝-后足功能评分从术前的(57.98±14.43)分改善至术后的(82.91±11.58)分;平均随访152.16个月(120.75~2101.32个月),发现有11人初次手术后又进行了共12次手术,再手术率6.4%,与文献报道的2.44%~10%再手术率相当,但Lee教授介绍的这组病例数(159人,172例)远比文献报道的50~82例多,因此治疗效果更好。Lee教授认为,关节镜下手术治疗距骨骨软骨病变的预后不佳与软骨病灶面积大、病灶为非容纳性、伴有软骨下大囊腔等因素有关[2-8]。

图1 韩国延世大学距骨骨软骨病变手术治疗方案图解
3 软骨再生新技术
3.1 自体基质诱导软骨生成
自体基质诱导软骨生成(AMIC)是一种生物学疗法,其将微骨折手术与基质使用相结合(图2),可以修复关节软骨损伤。
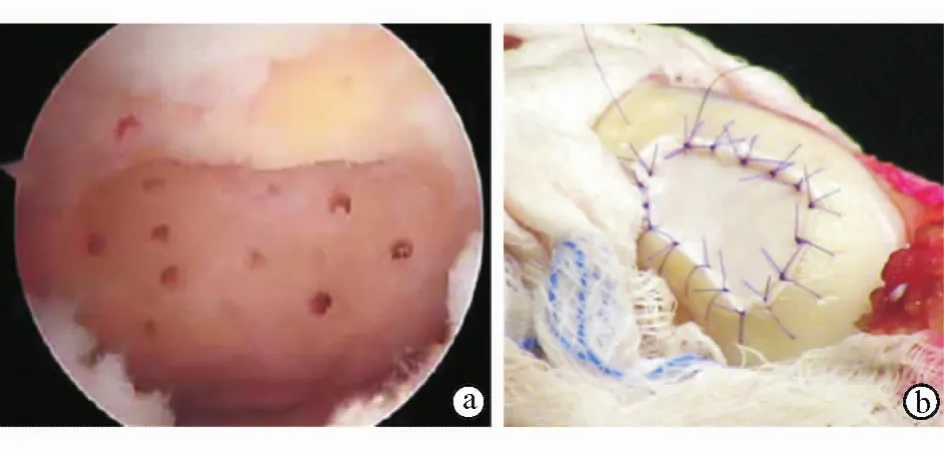
图2 AMIC技术 a.关节镜下手术使软骨下骨发生微骨折 b.用基质覆盖病灶
3.2 自体细胞治疗技术
自体细胞治疗技术包括抽取外周血或骨髓血,注入带有抗凝剂的细胞浓集装置(图3a),用离心机进行离心,使外周血或骨髓血在浓集装置内分层(图3b),去除上层血浆,抽取细胞浓集的中间层(图3c),用于修复软骨。
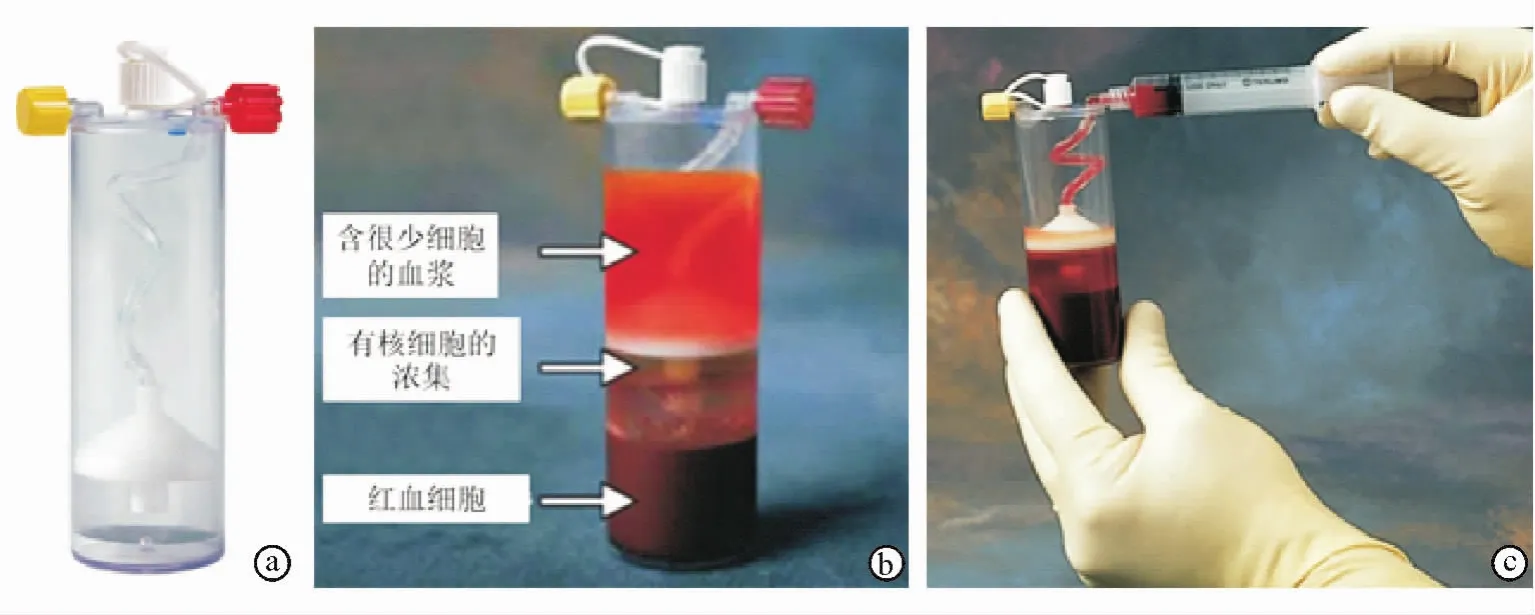
图3 Marrow StimTM浓集系统 a.搜集细胞浓集所用的装置 b.离心后骨髓血分层,上层为血浆(几乎不含细胞),中层细胞浓集,底层为红细胞 c.抽取中间层
3.3 脂肪组织间质血管细胞群
脂肪组织是具有多向分化潜能的多功能细胞来源之一。脂肪组织间质血管细胞群 (AT-SVF)为脂肪组织经胶原酶消化、过滤、离心,除去成熟脂肪细胞后得到的物质。AT-SVF含有丰富的可塑性极强的脂肪组织来源间充质干细胞,在软骨重建中可以起到重要作用。对距骨骨软骨病变患者采用单纯关节镜下清理病灶和微骨折治疗,最终影像学改善并不令人满意(下页图4),但如果在此基础上再加用AT-SVF修复,情况可能大有改观[9](下页图5)。
3.4 同种异体脐带血间充质干细胞与透明质酸水凝胶复合物
同种异体脐带血间充质干细胞(h UCB-MSC)由非侵入性方式取得,具有低免疫原性和高扩增能力,为其应用于临床治疗提供充足的细胞来源。h UCB-MSC与透明质酸水凝胶复合物可促进关节软骨再生,为骨关节炎患者提供了安全有效的新型治疗途径,从根本上改善了骨关节炎患者的软骨缺陷(下页图6),在提升疗效的同时,也降低了患者治疗过程中的痛苦和不良反应。这是干细胞临床应用的新突破,为患有软骨缺陷的骨关节炎患者带来了曙光[10]。

图4 未使用AT-SVF治疗的距骨骨软骨病变病例 a、b.术前MRI影像 c、d.单纯予以关节镜下清理病灶和微骨折治疗e、f.术后24个月MRI影像,影像学改善不明显

图5 使用AT-SVF治疗的距骨骨软骨病变病例 a、b.术前MRI影像 c、d.予以关节镜下病灶清理和微骨折治疗,同时注入AT-SVF e、f.术后28个月MRI影像,影像学改善明显

图6 h UCB-MSC与透明质酸水凝胶复合物的临床治疗效果例证 a.术后1年再次关节镜观察,软骨缺损表面被透明软骨样物质覆盖,没有过度生长,没有骨形成 b.软骨缺损修复部位,取再生组织活检,发现Ⅱ型胶原
3.5 表达转化生长因子-β1的同种异体软骨细胞
既往研究显示,转化生长因子-β1(TGF-β1)高表达能下调关节软骨和滑膜区域细胞凋亡,证实TGF-β1具有延缓骨关节炎进程的作用。基于此,出现了对软骨细胞进行基因修饰,使其表达TGF-β1,随后移植入患者体内的治疗方法。此方法使用TGF-β1转基因,并采用逆转录病毒作为载体,关节腔内一次性注射。目前该研究已进入三期临床试验阶段,其商品名为Invossa-KTM。
3.6 无支架颗粒状自体软骨细胞移植
组织工程学的自体软骨细胞移植(ACI)虽然拥有很多优点,但由于使用人工合成或异种支架,仍然存在免疫反应、产生有害降解产物等问题。因此,有学者研究无支架颗粒状ACI技术,该技术目前处于一期临床试验阶段,其商品名为CartiLifeTM(图7)。
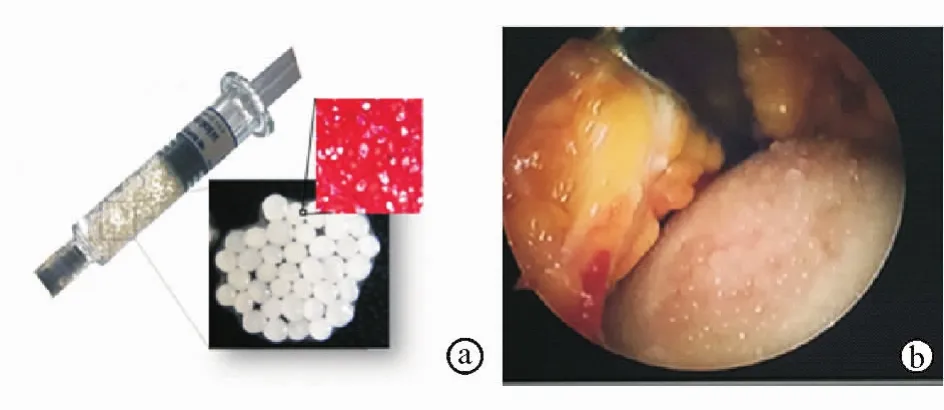
图7 CartiLifeTM a.示意图 b.关节镜下所见
3.7 青少年异体软骨颗粒移植
青少年的软骨是不成熟的软骨,具有很高的软骨细胞活性。与成年人软骨细胞相比,青少年软骨细胞的生物活性、合成基质能力、自我修复能力更强;经软骨微粒移植后,移植软骨表面积大大增加,软骨细胞更易迁移增殖(图8)。

图8 青少年异体软骨颗粒(商品名De Novo NTTM)移植 a.关节镜下图像显示De Novo NT被涂抹在距骨软骨缺损处 b.DeNovo NT移植后,纤维蛋白覆盖在病灶上封闭边缘
Dekker等[11]研究认为,青少年异体软骨颗粒移植的指征为微骨折手术失败,且病灶面积>125 mm2。而Eric等报道,接受该手术的患者年龄应<50岁,单一病灶,且微骨折手术治疗无效。
青少年异体软骨颗粒移植并发症包括渗出造成关节炎症、移植物长入失败、移植物分层或增生及传播疾病等。
3.8 基因治疗
基因治疗系采用基因调控来修饰干细胞,最终达到修复软骨的目的。目前基因治疗尚处于实验室探索阶段[12]。
4 结语
骨髓刺激技术是目前治疗距骨骨软骨病变最常用的方法,作为一线手术治疗方案,已取得满意的结果。临床医生必须了解该技术不足之处,以及影响骨髓刺激技术的预后因素。
倘若一线治疗方案的效果不理想,则需要选用二线治疗方案。目前越来越多的技术成为备选的二线治疗方案,临床医生应对它们更多了解,这样才能掌握距骨骨软骨病变的最新治疗技术。

