可注射型磷酸镁骨水泥生物相容性及体外模型中性能表现的评价
陶春杰 余铃 郭良煜 陈敬腾 方硕 郭卫春
椎体压缩性骨折是临床常见的脊椎损伤,对于后壁完整者,经皮椎体后凸成形术(PKP)是现行的良好治疗方法[1-2]。然而PKP可在椎体内形成较大骨缺损,目前最常使用聚甲基丙烯酸甲酯(PMMA)骨水泥作为骨替代物填充缺损。但是,PMMA不可生物降解,植入后将永久存在。由于其机械性能与自体骨存在差异[3],且为生物惰性材料,不具备骨诱导和骨引导的特性。注入的PMMA骨水泥固化后结构致密,不仅无法被自体骨整合,也妨碍损伤处自体骨的长入修复,导致骨替代物相关并发症发生[4-5]。另外,制备 PMMA 所使用的单体有毒[6],且在其进入体内后的固化过程中迅速大量放热致局部温度骤升,这些因素均可损伤周围组织,不利于自体骨组织修复。
鉴于上述原因,寻找一种力学性能优越且具有良好的生物降解性和骨诱导、骨引导性能的PKP骨填充材料是研究者们长期以来的目标。
磷酸镁骨水泥(MPC)是一种新型无机骨修复材料[7],其机械性能、生物相容性、生物降解性及生物活性良好,可注射性好,固化放热少。有研究表明,MPC作为骨替代物植入骨缺损后可逐步降解,同时可诱导自体骨组织修复缺损,最终达到缺损部位理想的完全自体骨修复[8]。
综合分析后我们认为,MPC作为PMMA的替代物应用于PKP中治疗椎体压缩性骨折具有极大潜能。因此,本研究拟通过在体外羊椎体PKP模型中使用 MPC,并测定其强化能力,来探索MPC在PKP中的应用。
1 材料和方法
1.1 实验材料
主要试剂:氧化镁(Mg O),磷酸二氢钾(KH2PO4)及磷酸三钙[Ca3(PO4)2]均购自国药集团化学试剂有限公司;PMMA骨水泥为某品牌商品化医用骨水泥。
主要仪器:行星式球磨仪(F-P400,湖南弗卡斯公司),万能试验机(深圳市瑞格尔仪器有限公司),微CT扫描仪(SkyScan 1176,德国布鲁克公司),扫描电镜(VEGA 3 LMU,德国VEGA公司)。
实验动物:新生雄性SD大鼠3只,3月龄雄性新西兰白兔12只(体质量3.0~3.4 kg),均购自湖北省实验动物研究中心;12只骨成熟山羊的L4~6椎骨,共36个,购自当地农贸市场。
动物实验已获得武汉大学实验动物伦理委员会审核批准。
1.2 MPC制备
本研究使用的MPC材料为研究组自主合成,合成原理参照已有文献报道[7],概述如下:依据MPC的反应原理MgO+HPO42-+H2O→MgPO4-+OH-+H2O,使用 MgO、KH2PO4、Ca3(PO4)2球磨后过200目筛所得粉末为固相,并添加缓凝剂、离子螯合剂以延缓中和反应速率及提高材料强度,以双蒸水为液相,合成本实验所用MPC配方。
1.3 体外细胞实验
取新生SD大鼠颅骨,PBS清洗表面后剪碎成1~2 mm碎屑,置于1%Ⅰ型胶原酶中消化1 h,1 200 r/min离心,PBS洗涤沉淀,转入1%EDTA胰酶中消化30 min。消化后再次离心、洗涤,得到的沉淀液用含12% 胎牛血清、1%青霉素-链霉素双抗的DMEM培养基重悬,并用25 cm2培养瓶在37℃、5%二氧化碳(CO2)、100%相对湿度下培养。48 h后首次换液,弃去瓶中残留的少量骨屑,得到幼鼠原代成骨细胞。
MPC及PMMA骨水泥调制成可注射浆料后预成型为直径6 mm、高度3 mm的圆盘,在37℃、100%相对湿度下固化24 h后放入培养皿中。取原代成骨细胞消化重悬为细胞密度5×104个/m L的单细胞悬液,接种于圆盘上表面,在5%CO2、37℃、100%相对湿度下孵育。接种后分别于4、24 h以2%戊二醛固定,将固定后的骨水泥-细胞样本制样,以扫描电镜观察材料表面的形态学及细胞黏附生长情况。
1.4 MPC抗压强度及可注射性测定
将MPC制成直径6 mm、高12 mm的圆柱体,使用万能试验机测定其抗压强度。测试时加载速度为1 mm/min,载荷降低到50%最大载荷以下时终止实验。
可注射性测定:取50 m L注射器称取质量,记为M1;将MPC粉末加液相调配成膏体后装入注射器内称取质量,记为M2;推注注射器,待活塞无法推进后再次称取质量,记为M3;MPC可注射性计算公式为
每组实验独立重复3次取平均值。
1.5 体外PKP造模及修复实验
将36个骨成熟山羊的L4~6椎骨随机均分为A、B、C 3组。A组椎骨不予处理,作为阳性对照组。对B组及C组椎骨依据文献报道方法行PKP造模[9],方法如下:用直径4 mm手钻沿双侧对位椎弓根入路钻入椎体中央,不钻破椎体前方皮质骨,钻头与经过椎体纵轴的椎骨矢状面呈30°~50°,与椎体底面所在水平面上下均呈0°~30°,构成椎体内“V”型缺损。造模后,C组椎骨经钻孔入路注入MPC填满缺损,然后将其置于37℃、100%相对湿度下保存,等待材料固化;B组椎骨不填充MPC,作为空白对照组。于PKP造模术后2、24、48、72 h分别取A、B、C 3组椎骨,用万能试验机测定椎体的轴向最大载荷。测定时,去除椎弓根及其后结构,铣刀处理椎体上下端使椎体的上下底面平行,处理过程中注意不过多磨损骨皮质。实验中加载速度为1 mm/min,载荷降低到50%最大载荷以下时终止试验。见图1。
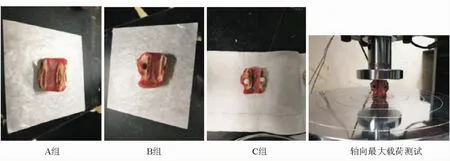
图1 轴向最大载荷测试前及测试中的体外羊椎体
1.6 动物实验
将12只新西兰白兔随机均分为4组,依据已有文献方法行双侧兔股骨髁缺损造模[10],方法如下:戊巴比妥钠麻醉后切开兔股骨外侧髁,电钻造直径6 mm、高12 mm的骨缺损,左、右侧股骨髁缺损分别以MPC和PMMA骨水泥膏体填充后缝合,材料在体内原位固化。于术后1、3、6、12周分别取1组实验动物,取双侧股骨行微CT扫描,观察骨缺损修复情况。
1.7 统计学分析
用SPSS 19.0软件对数据进行统计学分析,计量资料以均值±标准差表示,用方差分析(ANOVA)及t检验进行统计学分析,P<0.05为差异有统计学意义。
2 结果
2.1 MPC和PMMA骨水泥的细胞黏附情况
在MPC和PMMA骨水泥表面接种细胞并培养后以扫描电镜观察显示:细胞接种4 h时,MPC表面已出现大量黏附细胞,PMMA骨水泥表面几乎无黏附细胞;24 h时,MPC表面黏附的细胞伸出伪足,伸展良好,PMMA骨水泥表面的细胞黏附情况与4 h时无明显差异。见图2。

图2 扫描电镜观察不同修复材料的细胞黏附情况(×1 000倍)(箭头所指为黏附于材料表面的细胞)
2.2 MPC的抗压强度和可注射性
抗压强度测定显示,MPC固化后抗压强度为(30.16±1.22)MPa,满足骨替代物所需的抗压强度。可注射性测定显示,MPC固化前的可注射性η为99.69%±0.32%。
2.3 羊椎体骨体外实验结果
A、B、C组椎体骨轴向可承受最大载荷测定显示:A、B组各时间点间最大载荷无差异(F=0.052,P=0.983;F=0.002,P=0.999);与 A组相比,B、C组椎体各时间点的最大载荷均显著降低;MPC注入后2、24、48、72 h,C组椎体最大载荷均显著高于B组(P<0.05),椎体得到强化;C组椎体各时间点的最大载荷存在差异(F=26.16,P<0.05),24 h时最大载荷高于2 h时(t=4.338,P<0.05),而24 h与48 h、48 h与72 h时最大载荷无差异(t=1.588,P=0.239;t=5.740×10¯6,P>0.999),表明 MPC对椎体强化的形成主要发生在注入后24 h内。见表1。

表1 3组椎体不同时间点轴向最大载荷(k N)
2.4 动物实验结果
动物实验术后1、3、6、12周时微CT检查显示(图3):MPC和PMMA骨水泥修复处的周围骨质均未发生明显炎症、骨折、骨质吸收;各时间点PMMA均未降解,12周时,MPC出现降解征象,且周围可见少量新骨形成,新骨与残余材料之间骨整合良好。
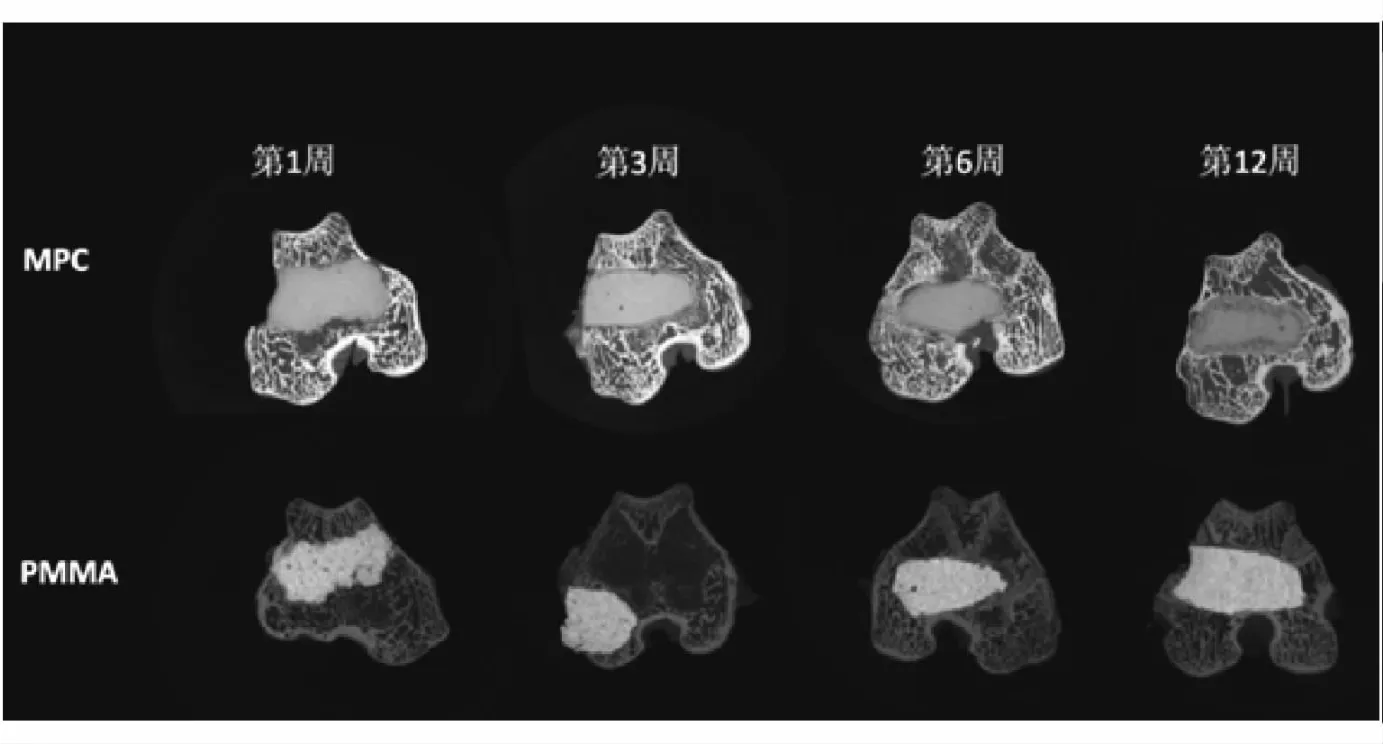
图3 兔股骨髁缺损模型中骨替代材料植入1、3、6、12周后的微CT扫描结果
3 讨论
本实验系统性评价了MPC的细胞相容性、生物体内相容性和体外椎体模型中的机械性能表现。
正常脊柱承受的载荷主要沿其纵轴分布,椎体压缩性骨折正是由于轴向载荷过大或椎体本身病变导致的椎体结构破坏[11]。PKP是目前治疗椎体压缩性骨折最常用的手术方式。PMMA是临床最常用的PKP骨替代物,但其生物活性差,在人体内难以达成理想的植入物-细胞响应,无法进一步提高治疗效果,并可发生并发症。本研究中,我们将大鼠成骨细胞接种于PMMA表面,4 h时初步黏附的细胞显著少于接种于MPC者;接种24 h后,PMMA表面黏附的细胞不仅数量远少于MPC,且细胞形态差,在PMMA表面无法伸展。该现象的发生可能与细胞黏附机制有关[12],即PMMA材料表面过于光滑致密,妨碍表面蛋白等物质的吸附,导致细胞黏附、增殖活动受阻。
MPC是一种新型骨水泥材料,具有良好的生物相容性、生物降解性和机械特性等,近年受到研究者的广泛重视[13-14]。材料学实验证实,MPC固化后强度达(30.16±1.22)MPa,且固化过程中可注射性达100%,可满足PKP手术的基本要求。本研究中,将大鼠成骨细胞接种于MPC,4 h后即有大量细胞黏附于MPC表面,24 h时黏附细胞进一步增多,且细胞伸展良好。研究结果表明,MPC具有良好的与成骨细胞发生材料-细胞响应的能力,也证实MPC的细胞相容性优越。
国内文献报道,将MPC作为粘接剂用于胫骨骨折模型取得满意效果[15],证实MPC在固定骨折中具有良好的机械性能。在此基础上,本研究探究了MPC在PKP模型中的机械性能。山羊椎体在解剖上近似人类椎体,是脊柱研究实验的常用选材,因此我们采用山羊椎体进行PKP造模后填充MPC,通过最大载荷测试评价MPC的机械性能。研究显示,未置入骨替代物时PKP椎体模型轴向最大载荷较正常椎体显著下降(该结果符合实际病理状况);注入MPC后2 h(模拟临床工作中PKP结束时刻)椎体的轴向最大载荷显著大于未注入MPC填充缺损的对照组,注入后24 h时椎体的轴向最大载荷趋向于正常椎体的最大载荷变化,注入48 h及之后椎体的轴向最大载荷已稳定于固化后最大值。该实验结果表明,MPC提高了缺损椎体的轴向最大载荷,使之恢复到接近正常椎体的轴向载荷。
综上,本研究证实,MPC是一种细胞相容性和机械稳定性良好的骨修复材料,具有代替PMMA应用于PKP的巨大潜能。但由于体外模型是对于机体真实病理状态的简化模拟,以MPC替代PMMA的体内PKP面临的情况更加复杂,且MPC植入后将面临长期骨修复过程中与机体发生的动态相互作用,因此其实用性仍需开展进一步的研究来探索。

