薏苡仁油诱导胃癌细胞SGC-7901凋亡的实验研究
孙国壮,曹有军,毛海燕,罗 恒,何子渡,孔桂美
(1.扬州大学医学院 转化医学研究院,江苏 扬州,225000;2.江苏省盱眙县人民医院 检验科,江苏 淮安,211700;3.江苏省南京明基医院 化疗科,江苏 南京,210000)
中国是胃癌高发国家,胃癌发病率在全球居于第4位,病死率排名第3位[1-2],而胃癌的发病率与病死率在中国恶性肿瘤排名中均居第2位[3]。国内外对胃癌的治疗一般采用手术及放化疗方式,但手术主要针对早期胃癌患者,而放化疗药物导致的不良反应与耐药,会损害机体的免疫机能,降低患者的生活质量与生存率[4-5]。目前针对胃癌的放化疗药物相对较少,针对胃癌晚期的药物也只有5-氟尿嘧啶、顺铂等。
在研究胃癌的发生发展过程中,中医药理论[6]认为是患者机体阴阳失衡,经络失常及多种复杂的发病机制导致胃癌的产生与发展。与西药相比,中药在治疗肿瘤相关疾病的过程中具有独特的作用,可以作为放化疗药物的辅助药,改善患者的生存率与预后[7-9]。研究[6]表明,中医药主要是通过中药活血化瘀、疏肝和胃等方面作用,调节机体的免疫反应,但具体机制仍不明确。薏苡仁油是薏苡仁的活性成分,主要成分为薏苡仁酯,具有调节机体免疫、抗肿瘤等多方面功效[10-11]。研究[12]表明,薏苡仁油可以抑制胰腺癌细胞的生长并诱导其凋亡。另有研究[13]发现,去甲斑蝥素与薏苡仁油合用可以协同诱导细胞凋亡,并通过下调调节性T细胞来抑制肝癌细胞的生长。
蛋白质精氨酸甲基转移酶5(PRMT5)在多种肿瘤中高表达,有研究[14-15]证实PRMT5的敲低可以延缓肺癌细胞系A549和H1299细胞的生长。PI3K-AKT信号通路与细胞的增殖与凋亡密切相关,有研究[16-18]显示,多种肿瘤中相关肿瘤标志物的高表达与PI3K/AKT信号通路密切相关。研究[15]表明,PRMT5能够激活PI3K/AKT信号传导和G1细胞周期蛋白,从而调节细胞生长,在使用PI3K抑制剂LY294002抑制PI3K活性后,发现PRMT5的表达也被降低,肿瘤细胞的生长被抑制,表明PI3K在调节PRMT5所依赖的细胞生长中起着重要作用。
本课题组前期研究[19]发现PRMT5在胃癌组织中高表达,与胃癌的发生与发展有一定关系,但对具体机制尚未深入研究。关于薏苡仁油通过PRMT5与PI3K/AKT信号通路抑制胃癌细胞生长,国内外文献中尚未见相关报道。本实验拟通过薏苡仁油注射液抑制胃癌细胞的增殖并诱导细胞凋亡,并探讨其具体作用机制,旨在为薏苡仁油在临床作为潜在的胃癌治疗药物辅助应用于联合放化疗提供新的策略,也为其进一步临床应用提供实验依据与理论基础。
1 材料与方法
1.1 材料
人胃癌细胞株SGC-7901(中国科学院上海细胞库),RPMI-1640基础培养液(Gibco公司)、胎牛血清(美国Gimni公司)、MTT和胰蛋白酶(Sigma公司),结晶紫、凋亡试剂盒、ECL试剂盒(碧云天生物有限公司),Transwell小室、Matrigel(美国BD公司)、PRMT5、β-actin(CST公司)、薏苡仁油注射液(康莱特药业有限公司)。
1.2 细胞培养
SGC-7901用1 640完全培养基培养(10%的胎牛血清,1%青霉素链霉素),于37 ℃、5% CO2的培养箱中培养,待细胞长到85%左右时进行常规的传代与换液,选取处于对数生长期的细胞用于后续实验。
1.3 MTT法检测细胞的增殖
取对数生长期的胃癌SGC-7901细胞,0.25%的胰酶消化,每孔5×103个细胞接种96孔细胞培养板,24 h后,加入不同浓度的薏苡仁油注射液(浓度分别为1、2、4、5、6、8 mg/mL),设磷酸缓冲盐溶液(PBS)为空白对照组,每组5个复孔,24 h后,每孔加入20 μL的MTT(5 mg/mL)溶液,置37 ℃培养箱4 h,弃掉96孔板中的液体,每孔加入150 μL的二甲基亚砜(DMSO),摇床振荡10 min后,酶标仪(波长490 nm)测定每孔的吸光度(A)值。细胞的抑制率(%)=(1-加药组A值/对照组A值)×100%。
1.4 流式细胞术检测细胞的凋亡
胃癌SGC-7901细胞接种于6孔板中,培养24 h后,根据MTT的结果,选取薏苡仁油注射液(2、4、8 mg/mL)分别加入6孔板中,对照组加入不含药物的1 640完全培养液,每组3个复孔。24 h后,用预冷的PBS洗涤2次,用不含乙二胺四乙酸(EDTA)的胰酶消化细胞离心,细胞计数1×106个/mL,用100 μL结合缓冲液(Binding Buffer)重悬细胞加入流式管中,加入5 μL磷脂结合蛋白V(Annexin V)和10 μL碘化丙啶(PI),混匀后室温避光孵育15 min,在管中加入400 μL PBS,流式细胞仪检测分析数据。
1.5 划痕实验检测细胞的迁移
将对数生长期的SGC-7901细胞接种于6孔板中,接种密度为5×105个/mL,培养24 h后,用10 μL无菌枪头在6孔板上划3条横线,PBS清洗划下的细胞3次,分别加入薏苡仁油注射液(2、4、8 mg/mL)于6孔板中,于37 ℃、5% CO2的培养箱中培养24 h后,倒置显微镜下拍照,测量细胞划痕的相对距离。实验重复3次。
1.6 Transwell小室检测细胞的侵袭
用预冷的无血清的培养基稀释Matrigel胶,预冷的枪头吸取40 μL的Matrigel胶均匀铺入小室的上室内,37 ℃培养箱孵育5 h,待Matrigel胶凝固后,取200 μL(1×105个/mL)对数生长期的SGC-7901细胞加入上室,再用不同浓度薏苡仁油注射液进行处理,下室加入含有10%血清的1 640培养基500 μL。37 ℃、5% CO2培养箱中培养24 h,取出小室用棉签将上室基质胶和没有侵袭的细胞擦拭干净,0.1%结晶紫染色下室20 min。倒置显微镜(100倍)观察迁移细胞,随机选取5个视野计数穿膜细胞数。
1.7 Western blot检测相关蛋白表达
取不同浓度薏苡仁油处理24 h后的SGC-7901,胰酶消化收集细胞,细胞总蛋白提取试剂盒提取细胞中的总蛋白,BCA法测定总蛋白含量,绘制标准曲线,计算上样量。十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)并转膜,洗涤缓冲液(TBST)摇床洗脱3次,每次5 min,5%脱脂奶粉封闭1 h,一抗4 ℃孵育过夜,TBST摇床洗脱3次,每次5 min,二抗孵育2 h,TBST摇床再洗脱3次,每次5 min,使用增强发光ECL试剂盒进行发光,凝胶图像分析系统采集目的蛋白条带图像进行分析。
1.8 统计学处理
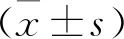
2 结 果
2.1 薏苡仁油能抑制胃癌SGC-7901细胞的增殖
MTT实验显示结果见图1,不同浓度的薏苡仁油均可抑制胃癌SGC-7901细胞的增殖,其中2、4 mg/mL的薏苡仁油对SGC-7901细胞抑制率分别为(30.02±1.56)%和(23.15±0.89)%,其中2 mg/mL组与空白对照组相比差异极显著(P<0.01),4 mg/mL组与空白对照组比较差异显著(P<0.05)。
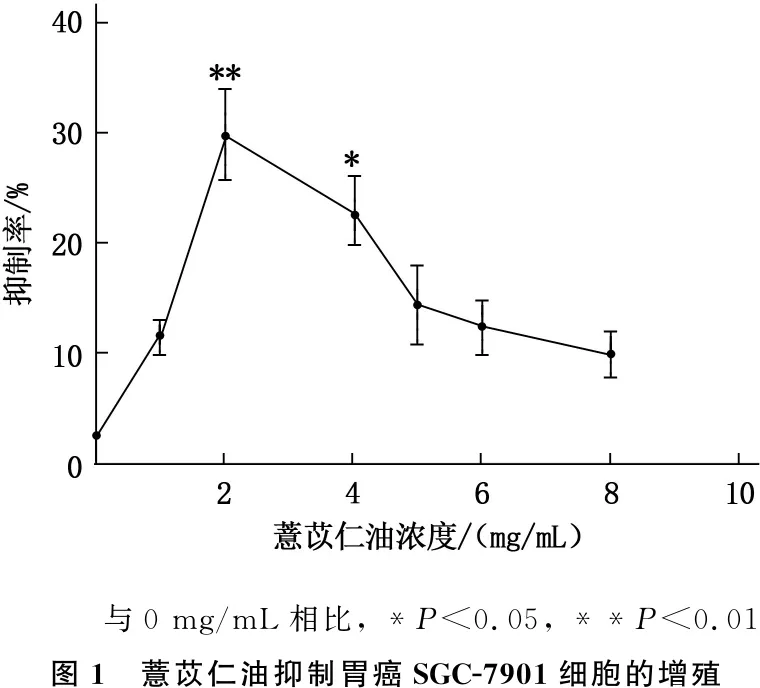
与0 mg/mL相比, *P<0.05, **P<0.01图1 薏苡仁油抑制胃癌SGC-7901细胞的增殖
2.2 薏苡仁油能诱导胃癌SGC-7901细胞凋亡
根据2.1的实验结果,选取2、4、8 mg/mL的薏苡仁油注射液处理胃癌SGC-7901细胞24 h,流式细胞仪检测凋亡情况。结果显示,2、4、8 mg/mL的薏苡仁油都能够诱导SGC-7901细胞凋亡,与空白对照组凋亡率为(2.00±1.22)%相比,2、4 mg/mL组凋亡率较高,2、4、8 mg/mL组的凋亡率分别为(16.25±2.54)、(12.60±1.12)、(7.88±1.67)%,其中2 mg/mL组和4 mg/mL组与对照组凋亡率相比差异极显著(P<0.01),8 mg/mL组与空白对照组凋亡率对比差异显著(P<0.05)。见图2。
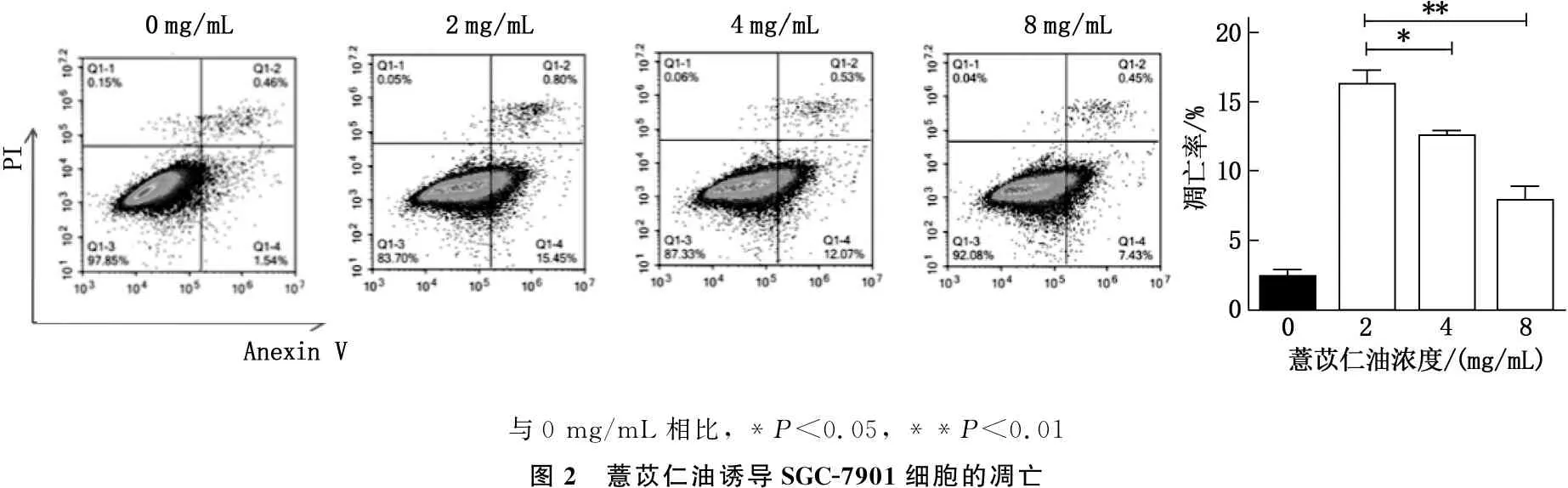
与0 mg/mL相比, *P<0.05, **P<0.01图2 薏苡仁油诱导SGC-7901细胞的凋亡
2.3 薏苡仁油能抑制胃癌SGC-7901细胞迁移
2、4、8 mg/mL的薏苡仁油注射液处理胃癌SGC-7901细胞24 h后,细胞的迁移均能抑制,空白对照组中间间距为(435.00±2.39)μm,2、4、8 mg/mL的间距分别为(643.00±1.16)、(539.00±0.58)、(464.00±2.11)μm。其中2 mg/mL组和4 mg/mL组与空白对照组相比差异极显著(P<0.01)。见图3。
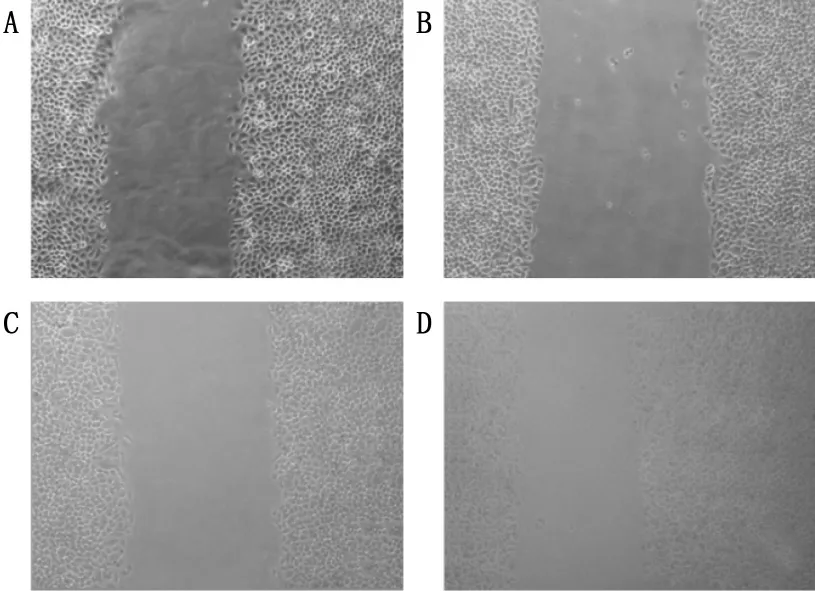
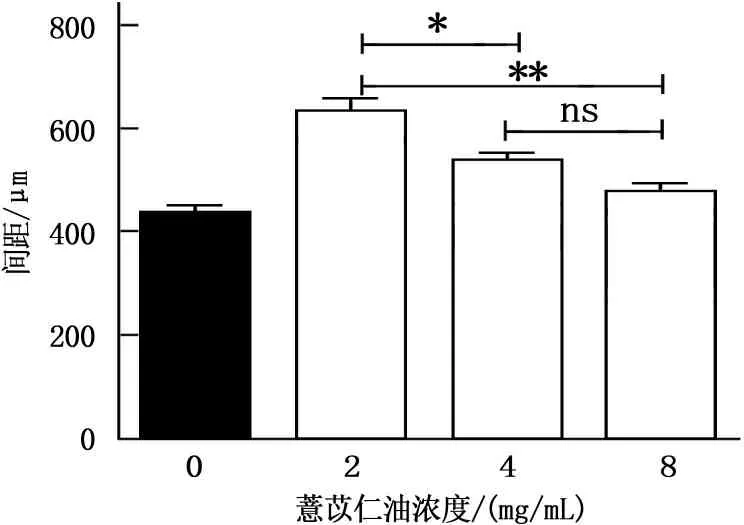
A:0 mg/mL;B:2 mg/mL;C:4 mg/mL;D:8 mg/mL。与0 mg/mL相比,*P<0.05,**P<0.01。
图3 薏苡仁油抑制SGC-7901细胞的迁移(100倍)
2.4 薏苡仁油抑制胃癌SGC-7901细胞侵袭
选取2、4、8 mg/mL的薏苡仁油注射液处理胃癌SGC-7901细胞24 h,Transwell小室结果表明,结晶紫染色后显微镜下观察,与对照组细胞侵袭数(268.00±2.05)个相比,2、4、8 mg/mL的薏苡仁油注射液处理过的SGC-7901细胞均能不同程度抑制细胞的侵袭,迁移数分别为(134.00±2.86)、(167.00±0.99)和(203.00±2.97)个。2 mg/mL组和4 mg/mL组与空白对照组细胞侵袭数相比差异极显著(P<0.01),8 mg/mL组与空白对照组细胞侵袭数对比有显著差异(P<0.05)。见图4。
2.5 薏苡仁油下调胃癌SGC-7901细胞PRMT5的表达
Western blot结果表明,随着薏苡仁油浓度的升高,PRMT5、PI3K和AKT蛋白的表达显著降低,2、4、8 mg/mL组与空白对照组相比差异极显著(P<0.001)。见图5。
3 讨 论
胃癌的发病率一直占据全球肿瘤发病率的前列,放化疗药物虽然可以提高患者的存活率,但其在治疗过程中对机体产生的不良反应让患者难以耐受,故而在治疗周期中有很多患者中途放弃治疗。面对胃癌治疗的现状,临床治疗中迫切需要新型药物的出现,该药物既要降低放化疗药物对机体产生的不良反应,又要提高对胃癌治疗的疗效,改善患者的生活质量。有研究[9]表明,部分中药在治疗恶性肿瘤的过程中发挥着重要作用,是西药不能比拟的。薏苡仁油注射液作为临床配合放化疗药的辅助用药,对于原发性非小细胞肺癌和肝癌的治疗效果较为显著[10]。本研究结果表明,薏苡仁油注射液可以抑制胃癌SGC-7901细胞的增殖,而有研究[20]发现,薏苡仁油注射液联合化疗药物治疗胃癌患者,可明显改善患者的生活质量,但对相关具体机制并没有深入研究。

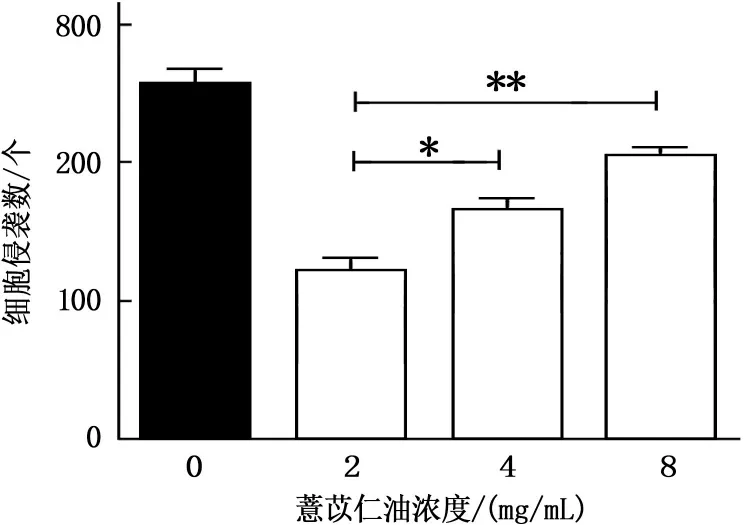
A:0 mg/mL;B:2 mg/mL;C:4 mg/mL;D:8 mg/mL。与0 mg/mL相比,*P<0.05,**P<0.01。
图4 薏苡仁油抑制SGC-7901细胞的侵袭(100倍)
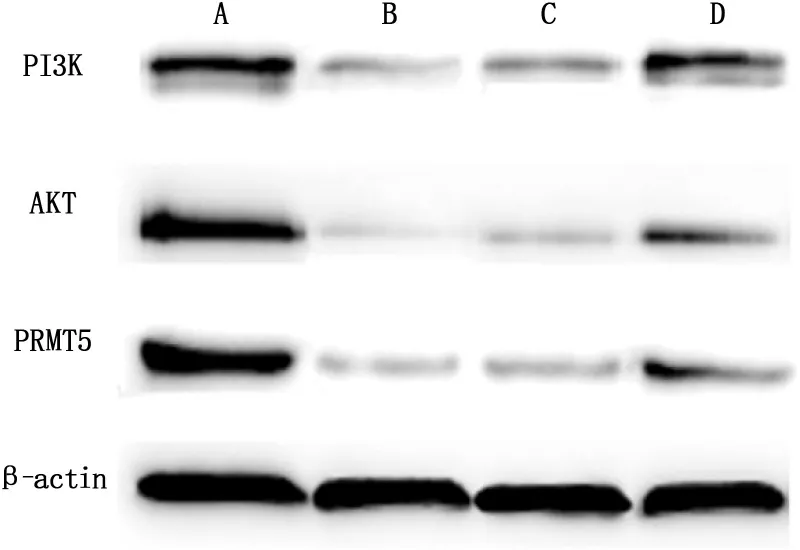
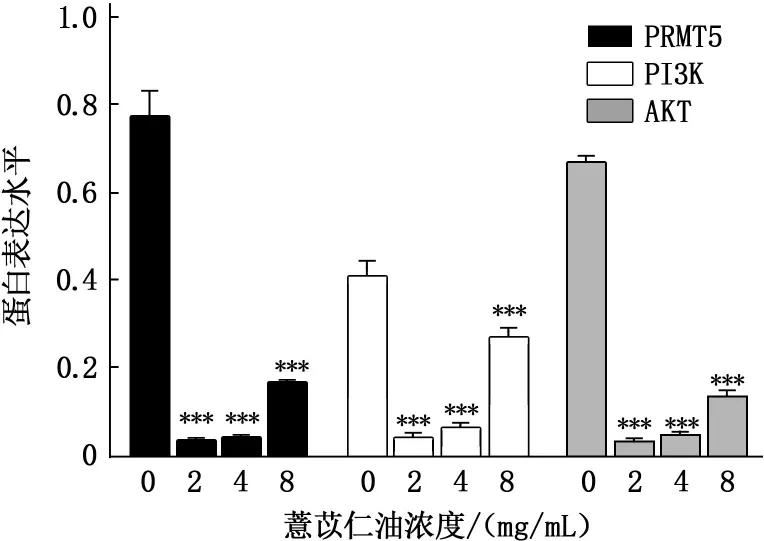
A:0 mg/mL;B:2 mg/mL;C:4 mg/mL;D:8 mg/mL。与0 mg/mL相比,***P<0.001。
图5 薏苡仁油对SGC-7901细胞PRMT5蛋白表达的影响
蛋白质精氨酸甲基转移酶参与多个细胞生物学过程,包括肿瘤的形成、细胞增殖分化与凋亡,而PRMT5作为Ⅱ型蛋白质精氨酸甲基转移酶,在多种肿瘤中高表达。本课题组在前期研究的基础上,确认了PRMT5在胃癌中的高表达。关于PTMT5与PI3K/AKT在胃癌中如何调节细胞的进展,并没有相关文献报道,本研究首次从薏苡仁油与PTMT5、PI3K/AKT信号通路着手,研究其与胃癌发生发展机制的关系。
本研究发现薏苡仁油可以显著抑制胃癌SGC-7901细胞的增殖,可能的作用机制与诱导细胞凋亡有关,并且探讨抑制SGC-7901细胞增殖的最佳药物浓度,在选择适宜药物浓度条件下,验证了凋亡、迁移、侵袭,并进一步确定了薏苡仁油诱导SGC-7901细胞凋亡的药物浓度,2、4 mg/mL浓度可以显著抑制SGC-7901细胞的增殖、迁移与侵袭,并诱导胃癌细胞的凋亡。
本实验通过Western blot结果发现,在用不同浓度的薏苡仁油处理胃癌SGC-7901细胞后,PRMT5、PI3K和AKT蛋白的表达水平在薏苡仁油浓度为2、4 mg/mL时,蛋白的表达显著降低,而8 mg/mL组蛋白的表达水平升高及8 mg/mL组细胞凋亡率显著低于2、4 mg/mL药物组,可能的原因是薏苡仁油是从中药薏苡仁中提取的活性物质,具有双向调节的作用,剂量不同发挥的作用功效也不同。中药本身作用比较复杂,许多中药使用不同剂量,针对不同机体,也具有双向调节的作用。《神农本草经》中首次明确记载部分中药具有双向调节作用,《伤寒论》和《金匮要略》中也体现了部分药物具有双向调节功能,而药理论中也常有“剂量-效果”作用相反的现象。如《中药学》中,麦芽小剂量可以催乳,大剂量回乳;柴胡小剂量可以抑制大鼠排尿,大剂量可以促进排尿[21-23]。因此,随着薏苡仁油注射液用药剂量的不同,针对不同肿瘤细胞,可以出现相反的治疗结果,对细胞恶性表型作用效果也不同。
此前研究[15]报道PRMT5与PI3K/AKT信号通路直接相关,肺癌中PI3K的失活可以抑制PRMT5依赖的细胞增殖。本次实验选取细胞系为胃癌SGC-7901细胞,实验结果初步说明薏苡仁油可以通过降低PRMT5蛋白的表达诱导胃癌SGC-7901细胞凋亡,其凋亡机制之一可能是通过PRMT5-PI3K/AKT信号通路。
综上所述,薏苡仁油可以有效抑制胃癌细胞的侵袭与迁移,其机制可能是通过PRMT5-PI3K/AKT信号通路诱导其凋亡。本研究的不足之处为缺乏临床病理胃癌及癌旁标本与动物实验模型的验证,下一步研究方向将对PRMT5进行siRNA敲低与过表达,进一步验证之前所得的结果,并通过动物造模,明确薏苡仁油与PRMT5在胃癌发生、发展中确切的机制,为未来的临床应用提供数据支持与理论基础,具体的作用机制有待进一步研究。

