胰岛素泵联合二肽基肽酶-Ⅳ抑制剂治疗新发2型糖尿病的疗效观察
陈英姿,孟信龙,杜 鹏,缪从庆,樊爱娟,刘敬敬,陆德川
(扬州大学医学院附属扬州市江都人民医院 内分泌科,江苏 扬州,225200)
胰岛素泵可模拟胰腺的分泌功能,按照人体需要的剂量将胰岛素持续地推注到患者的皮下,保持全天血糖的稳定,从而达到控制血糖的目的。对于新发2型糖尿病(T2DM)患者,需要控制好血糖水平以保护胰岛功能。T2DM发病的中心环节是胰岛细胞缺陷以及胰岛素生物学效应减弱。大部分T2DM患者存在胰岛素抵抗,单纯胰岛素治疗可能会导致高胰岛素血症以及肥胖[1]。动脉粥样硬化的危险因素之一就是高胰岛素血症[2]。二肽基肽酶-Ⅳ(DPP-Ⅳ)抑制剂能延缓胃排空,具有抑制摄食中枢、肝糖输出、改善血脂、减少内脏脂肪蓄积、抑制食欲、减少摄食的肠促胰素生物学作用,从而改善血糖控制,减轻体质量。本研究探讨胰岛素泵联合DDP-Ⅳ抑制剂治疗新发T2DM的疗效,现报告如下。
1 资料与方法
1.1 一般资料
选取扬州市江都人民医院2016 年12月—2017 年11 月收治的新诊断T2DM患者51 例,均符合《中国2型糖尿病防治指南(2017年版)》中诊断标准。所有患者未接受过任何糖尿病相关治疗,其中男27例,女24例,年龄22~75岁,体质量指数(BMI)为(25.30±11.30)kg/m2,空腹血糖(FBG)≥11.1 mmol/L;均无糖尿病急性并发症,无明显肝、肾功能异常,无急性应激状态,无使用影响血糖代谢的相关药物及疾病史;胰岛自身相关性抗体[胰岛细胞抗体(ICA)、谷氨酸脱羧酶抗体(GADA)]均为阴性。将上述患者随机分为2组。试验组26 例,其中男13例,女13例,平均年龄(46.00±10.00)岁,BMI为(27.10±1.40)kg/m2,病程(1.30±0.70)年。对照组25例,其中男13例,女12例,平均年龄(45.00±11.00)岁,BMI为(25.30±2.80)kg/m2,病程(1.30±0.90)年。2组患者一般资料无显著差异(P>0.05)。
1.2 研究方法
所有患者给予糖尿病教育、饮食、运动指导,使用韩国Dana DibetcareⅡ型胰岛素泵皮下持续注射诺和锐控制血糖,起始总量为0.4~0.5 U/(kg·d),其中半数剂量作为每小时输注的基础率,另外的半数剂量平均分配为每天3餐前的大剂量。试验组在胰岛素泵基础上加用DPP-Ⅳ抑制剂5 mg/d,疗程均为15 d,每天监测3餐前、睡前、夜间12点、凌晨3点的血糖,共计6次。根据血糖调整基础用量、餐前大剂量。记录血糖达标时间,FBG<7.0 mmol/L及3餐前<8.0 mmol/L为达标。记录2组血糖控制达标人数、每日胰岛素总量、治疗后体质量以及治疗前及治疗后第15天C肽(C-P)释放试验结果。检查0、30、60、120 min的C-P水平,检查前停止胰岛素泵8 h,C-P采用发光分析法测定。以C-P水平评价胰岛β细胞功能指数(HOMA-β)、曲线下面积(AUC)、胰岛素抵抗指数(HOMA-IR)。HOMA-β(C-P)=0.27×F(C-P)/(FBG-3.5),其中F(C-P)代表空腹C肽水平。HOMA-IR(C-P)=1.5+FBG×F(C-P)/2 800。AUC(C-P)=0.25×[(C-P)0+4×(C-P)30+3×(C-P)120)],其中(C-P)0、(C-P)30、(C-P)120依次代表0、30、120 min的C肽水平。
1.3 统计学方法
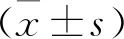
2 结 果
2组治疗后FBG、餐后2 h血糖(2 hBG)较治疗前显著改善(P<0.05),且试验组显著优于对照组(P<0.05)。治疗后,2组HOMA-β(C-P)、AUC(C-P)均较治疗前显著升高(P<0.05),HOMA-IR(C-P)显著降低(P<0.05),且试验组HOMA-IR(C-P)显著低于对照组(P<0.05)。见表1。试验组胰岛素用量、血糖完全达标比例、血糖达标时间、体质量增加值均显著优于对照组(P<0.01)。见表2。低血糖是以末梢血糖≤3.9 mmoI/L伴或不伴有心悸、心慌、出汗、手抖、昏迷等症状的并发症[3]。试验组低血糖发生率为8.00%(2/26),对照组为12.00%(3/25),2组差异无统计学意义(P>0.05)。在调整胰岛素泵剂量后,2组血糖均达标,且无严重低血糖事件发生。
3 讨 论
新发T2DM患者空腹及餐后血糖处于较高水平,长期血糖控制不佳,高糖毒性使胰岛素用量明显增加,β细胞长期处于刺激状态,导致胰岛β细胞处于耗竭状态,加重高血糖反应,而高糖毒性又能促使β细胞功能恶化,形成恶性循环[4]。胰岛素泵能模拟胰岛素生理分泌模式,能尽快解除高糖毒性,恢复胰岛功能,发挥保护胰岛功能的作用[5]。T2DM患者大多存在不同程度胰岛素抵抗,胰岛素泵治疗会导致高胰岛素血症,升高体质量增加风险。高胰岛素血症会加重动脉粥样硬化的进程,是糖尿病大血管病变的危险因素之一[6-7]。胰高血糖素样肽-1(GLP-1)可以补充β细胞的胰岛素储存量,防止β细胞衰竭,可能与通过增加胰岛素mRNA的稳定性、上调胰岛素的基因转录和生物合成有关,并且可以有效抑制α细胞分泌胰高血糖素。DDP-Ⅳ抑制剂具有与DPP-Ⅳ的天然底物GLP-1相似的结构,因而可竞争性地与DPP-Ⅳ的活性部位结合,防止GLP-1被DPP-Ⅳ水解,减少GLP-1的降解,增加其在血液中的浓度[8],进而保证其发挥相应的效用[9]。口服DPP-Ⅳ抑制剂后,活性GLP-1水平升高,进而以葡萄糖依赖的形式刺激胰岛素的释放并促进β细胞的增殖、新生,抑制β细胞的凋亡,减少内脏脂肪,降低体质量增加风险。
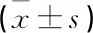
表1 2组患者治疗前后各项指标比较
FBG:空腹血糖;2 hBG:餐后2 h血糖;HOMA-β(C-P):以C肽评价的胰岛β细胞功能指数;
AUC(C-P):以C肽评价的曲线下面积;HOMA-IR(C-P):以C肽评价的胰岛素抵抗指数。
与治疗前比较,*P<0.05;与对照组比较,#P<0.05。
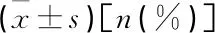
表2 2组胰岛素用量、血糖完全达标比例、血糖达标时间、体质量增加值比较
与对照组比较,**P<0.01。
本研究结果显示,2组治疗后血糖均得到明显控制,高糖毒性及胰岛β细胞功能也得到改善。在达到同样的血糖控制目标下,试验组血糖达标的人数更多,达标时间更短,胰岛素用量更少,体质量增加风险更低,提示DPP-Ⅳ抑制剂联合胰岛素泵控制新发T2DM的效果显著,能提高胰岛素生物学效应,解除糖毒性,减少胰岛素用量,减少高胰岛素血症的发生,降低体质量增加的风险。试验组HOMA-IR显著低于对照组,证明DPP-Ⅳ抑制剂能较好地改善胰岛素抵抗。此外,2组C肽水平均有明显的改善,但差异无统计学意义,可能与本研究血糖达标后进行C肽释放实验的间隔时间较短,若条件允许的话,可延长复查C肽释放实验时间至血糖达标后约2个月再进行评价。
综上所述,胰岛素泵联合DPP-Ⅳ抑制剂治疗新发T2DM效果显著,可在降糖的同时降低体质量增加风险,提高胰岛素生物学效应,效果优于单纯使用胰岛素治疗。

