长链非编码RNA前列腺癌相关转录物1在肿瘤进展中的作用
周翔宇,李德明,赵永强
(中国医科大学附属第四医院,1.第一普通外科;2.麻醉科,辽宁 沈阳,110032)
癌症是一种与多种基因突变、表观遗传变异、染色体易位、缺失和扩增相关的复杂疾病[1]。非编码RNA(ncRNA)是一类新兴的转录本,由基因组编码,但大多数不会翻译成蛋白质[2]。虽然没有翻译,但ncRNAs是各种细胞和生理功能的重要参与者[3]。特别是长链非编码RNA(长度>200 nt的ncRNA)在调节染色质动力学、基因表达、生长、分化和发育中起着关键作用[4]。现有的研究[5]发现人类基因组编码超过28 000种不同的长链非编码RNA(lncRNA),然而其中有许多仍然尚未被发现及研究。现被发现的一些特定lncRNA表现出发育和组织特异性表达模式[6-8]。这些特征对于其功能分析至关重要,也突出了lncRNA在癌症治疗、预后评估方面及作为治疗靶点的潜力。有证据[9-10]表明,lncRNA是肿瘤发生的重要因素,而lncRNA介导的生物学行为在癌症进展中起着关键作用。前列腺癌相关转录物1(PCAT-1)是新鉴定的lncRNA,其包含2个外显子,位于Chr8q24中致癌基因MYC上游约725 kb处[11]。PCAT-1在前列腺癌研究[11]中被发现其升高与前列腺癌进展有关。现已发现PCAT-1在多种人类癌症发生、发展中存在表达异常,并发挥多种生物学作用(见表1)。本研究以PCAT-1为主题检索了与癌症相关的文章,并基于所选文章阐述PCAT-1在人类癌症中的相关作用及其潜在分子机制和临床意义。
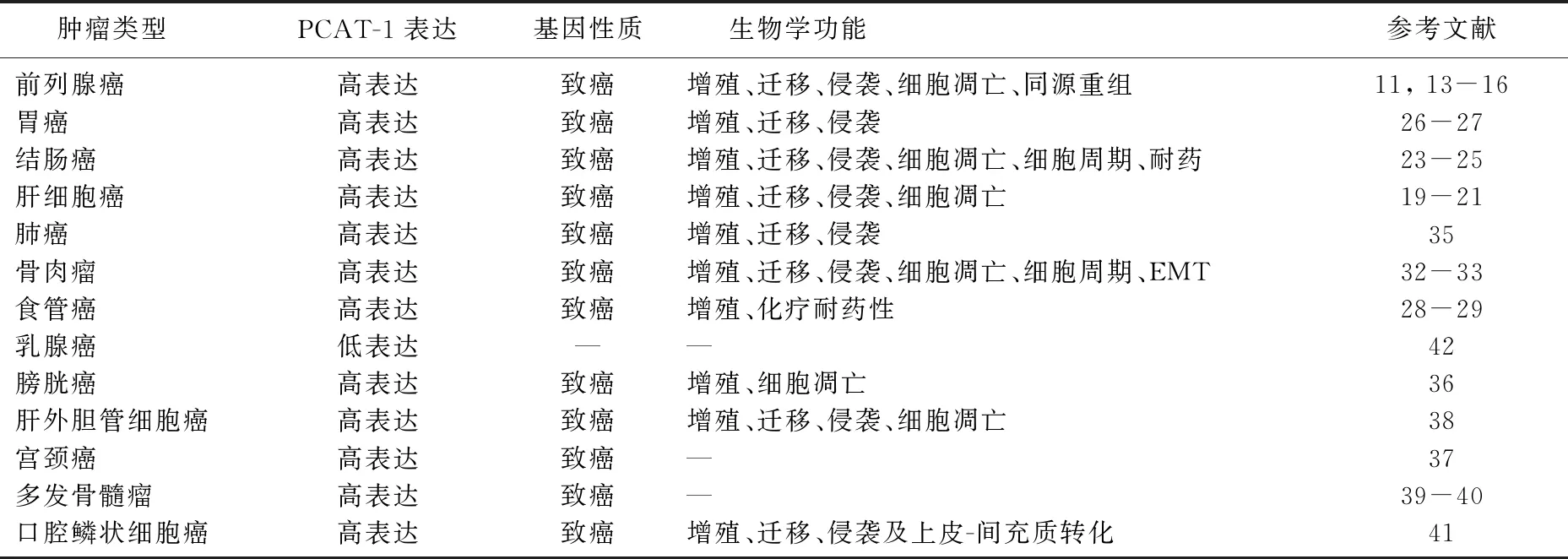
表1 PCAT-1在多种恶性肿瘤中的功能特征
1 PCAT-1在前列腺癌中的作用
前列腺癌是导致男性癌症死亡的第二大原因,每年新确诊100万例[12]。PCAT-1最初是在前列腺癌中发现,其在前列腺癌组织及细胞中的表达明显上调,且活跃的PCAT-1表达能促进前列腺癌细胞的增殖[11,13-14]。有研究[13]表明,PCAT-1可通过miR-145-5p上调FSCN1促进前列腺癌细胞的增殖、迁移和侵袭,抑制前列腺癌细胞的凋亡。另有学者[14]发现,PCAT-1介导的前列腺癌细胞增殖依赖于cMyc蛋白的稳定化,cMyc的拮抗可以逆转PCAT-1介导的前列腺癌细胞增殖。Prensner等[15]研究发现,PCAT-1可抑制抑癌基因BRCA2表达,进而阻断肿瘤细胞的DNA损伤修复。通过影响两种DNA修复途径发挥作用:① 损害同源重组。② 增强肿瘤细胞对DNA损伤修复酶PARP1抑制剂的敏感性。进一步研究[16]证明,PCAT-1通过与ELAV样 RNA结合蛋白-1竞争性结合降低抑癌基因BRCA2的表达且PCAT-1的5′端参与了此进程。
2 PCAT-1在肝细胞癌中的作用
作为世界十大恶性肿瘤之一,肝细胞癌(HCC)具有极高的发病率和病死率[12,17]。研究[18-19]表明,HCC组织中PCAT-1的表达较邻近非肿瘤组织明显升高。PCAT-1的高表达与HCC的TNM分期及转移有着显著相关性。此外,生存分析显示,高表达PCAT-1的HCC患者的总生存率低,且可作为HCC的独立预后因素[18]。PCAT-1的过表达会促进HCC细胞的增殖及转移,抑制HCC细胞的凋亡[19]。研究显示PCAT-1通过miR-129-5p-HMGB1(高迁移率族蛋白B1)信号通路在肝细胞癌中促进侵袭和转移。具体而言,PCAT-1可通过竞争性结合miR-129-5p,降低miR-129-5p对HMGB1的抑制作用,进而促进HCC的侵袭和转移[20]。另有研究[21]证明,p53诱导的miR-215可通过抑制PCAT-1表达,间接下调Crk样原癌基因,从而抑制HCC的发生及发展。这些研究结果表明,PCAT-1的上调与HCC的发生和转移有关,可能作为一种潜在的预后生物标志物。
3 PCAT-1在结直肠癌中的作用
结直肠癌(CRC)是世界上第二常见的恶性肿瘤,10年间结直肠癌的发病率增高了34%,每年新发病例约170万[22]。一项CRC研究[23]通过实时定量PCR对108例CRC癌组织及与其对照的81例癌旁正常组织进行检测显示,与正常组织相比,肿瘤中PCAT-1表达显著上调,64%的CRC组织中PCAT-1过表达,PCAT-1高表达组的总生存率显著低于低表达组。一项对CRC中PCAT-1的研究[24]表明,PCAT-1的下调促使CRC细胞从增殖到细胞周期阻滞及凋亡转变,其中部分是通过抑制致癌基因c-Myc表达。另一项研究[25]报道,PCAT-1通过调节c-Myc表达提高了CRC细胞的侵袭性及多种药物耐药性。
4 PCAT-1在胃癌中的作用
胃癌是致死率极高的恶性肿瘤之一,胃癌组织中PCAT-1表达明显高于正常癌旁组织。PCAT-1的表达水平与肿瘤浸润深度、淋巴结转移、TNM分期呈正相关[26]。CDKN1A基因编码一种有效的细胞周期蛋白依赖性激酶抑制剂从而起到抑癌作用,而研究[27]显示PCAT-1可通过调节CDKN1A基因促进胃癌细胞的增殖和转移。
5 PCAT-1在食管癌中的作用
食管癌是世界上最致命的恶性肿瘤之一,化疗耐药性限制了食管癌的治疗效果。在食管癌组织中也发现了高水平的PCAT-1表达,PCAT-1高表达水平与晚期肿瘤淋巴结转移、临床分期及肿瘤侵袭程度显著相关[28]。另据报道,PCAT-1的过表达增加了食管癌细胞的增殖速率和生长。PCAT-1的低表达抑制了食管癌细胞的增殖和生长,并增强了顺铂的化学敏感性[29]。因PCAT-1促进食管癌的发展并抑制食管癌对顺铂的化学抗性,PCAT-1可能成为治疗食管癌的潜在治疗靶点,并且可能成为判断食管癌预后的一个重要因素。
6 PCAT-1在骨肉瘤中的作用
骨肉瘤是一种原发性恶性骨癌,主要发生于儿童和青少年。骨肉瘤每年的发病率约为30/1 000 000[30-31]。研究[32]表明,PCAT-1在骨肉瘤组织中高表达,机制研究发现,PCAT-1与EZH2相互作用,抑制骨肉瘤细胞中p21的表达,从而降低p21的抑癌作用。另有报道[33]显示,人骨肉瘤细胞中PCAT1的过表达促进细胞增殖、细胞侵袭迁移和上皮细胞向间充质细胞转化,抑制细胞凋亡,也导致了S期细胞数量的增加而G0/G1期细胞数量的减少,且PCAT1的上调与骨肉瘤患者的较晚的临床分期、肿瘤转移、总生存期缩短有显著相关性。
7 PCAT-1在肺癌中的作用
肺癌是世界范围内癌症患者死亡的主要原因,占癌症相关死亡的1/4[34]。现国内外对肺小细胞癌中的PCAT-1研究数据尚缺乏,而对肺非小细胞癌的研究表明PCAT-1在非小细胞肺癌组织和细胞系中升高。肺癌A549细胞通过PCAT-1小发夹RNA抑制PCAT-1表达,进而抑制细胞的增殖、迁移和侵袭,而合成质粒载体过表达PCAT-1则可促进细胞的增殖、迁移和侵袭[35]。
8 PCAT-1在其他恶性肿瘤中的作用
PCAT-1在膀胱癌、宫颈癌、肝外胆管细胞癌、多发性骨髓瘤及口腔鳞状细胞癌中表达均有上调[36-41]。研究[38]发现PCAT-1的高表达能促进宫颈癌及肝外胆管癌的增殖、转移,其中PCAT1通过Wnt-β连环蛋白信号传导途径调节肝外胆管癌的迁移侵袭,而多发性骨髓瘤中的PCAT-1被认为是影响预后的独立因素[40]。然而,一项乳腺癌研究[42]发现,与邻近的非癌组织相比,肿瘤组织中PCAT-1的表达水平明显降低,现PCAT-1与乳腺癌的增殖、侵袭、转移及预后等因素关系尚不明确。
9 总结及展望
综上所述,PCAT-1是一种新的致癌基因,在多种人类恶性肿瘤中表达上调,如前列腺癌、肝细胞癌、结直肠癌、胃癌、食管癌、骨肉瘤、肺癌、膀胱癌、多发性骨髓瘤、宫颈癌、肝外胆管癌及口腔鳞状细胞癌。PCAT-1表达异常与恶性肿瘤中细胞增殖、侵袭、转移、细胞凋亡、细胞周期、化疗耐药和同源重组等有关。PCAT-1作用机制与多种因素及信号通路作用有关,较为复杂,现阶段对于PCAT-1的研究仍处于初级阶段,对于PCAT-1在多种恶性肿瘤中表达异常机制知之甚少,对PCAT-1上行调节及下游信号的了解可对PCAT-1的研究提供更好的方法。PCAT-1在多种肿瘤中与临床分期及生存期相关,提示其可能在恶性肿瘤的评估中起到较好的临床效用。为了进一步明确PCAT1表达与癌症发生、发展及预后之间的关系,还需进行大规模多中心的实验及临床研究。PCAT-1可能成为一种新的生物学标志物,为恶性肿瘤的评估及治疗提供新的方向。

