自噬在机械通气致大鼠脑组织神经元凋亡中的作用
余 鑫,米智华,高 巨
(扬州大学临床医学院 江苏省苏北人民医院 麻醉科,江苏 扬州,225001)
机械通气是治疗全身麻醉和急危重患者的重要辅助措施,临床上全麻下高危手术后需要长时间机械通气的患者数量日益增加[1]。然而,有研究[2-3]表明,长时间机械通气可导致呼吸机相关性肺损伤(VILI),甚至导致其他远隔器官的损伤,如急性脑功能障碍[4],其机制可能与诱发脑组织炎症及神经元凋亡有关[5-6]。自噬广泛存在于真核细胞中,它既是细胞的一种自我保护机制,同时也被认为是一种与凋亡、坏死并列的细胞程序性死亡机制[7-8]。研究[9]表明,自噬相关蛋白参与了大鼠呼吸机相关性肺损伤过程,但自噬对机械通气致大鼠脑组织神经元凋亡的作用尚不清楚。本研究拟建立大鼠机械通气致神经元凋亡模型,探讨自噬在其中的作用。
1 材料与方法
1.1 实验动物与分组
健康成年雄性Wister大鼠24只,体质量200~250 g,由扬州大学比较医学中心提供。采用随机数字表法将其分为4组:对照组(C组)、机械通气组(MV组)、机械通气+6-氨基-3-甲基嘌呤处理组(3MA组)、机械通气+雷帕霉素处理组(R组),每组6只。
1.2 方法
实验前禁食10 h,自由饮水。腹腔注射0.7%水合氯醛5 mL/kg麻醉大鼠。参照文献[10]的方法制备机械通气致大鼠脑损伤模型。左侧颈内静脉穿刺置管用于泵注维库溴铵维持肌松。颈部正中备皮、消毒,在距胸骨约1 cm处纵行剪开皮肤,钝性分离皮下组织与肌肉,暴露气管,切开并插管,固定。C组保留自主呼吸,不行机械通气。MV组、3MA组及R组接DW 3000型小动物呼吸机(安徽省淮北正华生物仪器设备有限公司)行机械通气。呼气末正压(PEEP)为0时吸入空气。呼吸参数设置:吸呼比1∶2、潮气量40 mL/kg、通气频率40次/min、通气时间6 h。3MA组及R组于MV前15 min分别腹腔注射自噬抑制剂3-MA 30 mg/kg及自噬激活剂雷帕霉素1 mg/kg,C组于MV前15 min腹腔注射等量生理盐水。
机械通气结束后立即于深麻醉下断头取脑,冰上快速分离海马,取部分海马组织,4%多聚甲醛固定后进行石蜡包埋,制备病理切片,常规苏木精-伊红染色,光学显微镜下观察海马CA1区神经元病理学改变。采用TUNEL染色法定量检测凋亡细胞。石蜡切片脱蜡至水,加入浓度为20 pg/mL的蛋白酶K溶液消化,孵育15 min,PBS冲洗2 min(3次),擦干组织周围水分。加入TUNEL反应液混合液覆盖样本区,于湿盒中37 ℃反应1 h。PBS漂洗3 min(3次),滴加POD,至湿盒内37℃孵育30 min,PBS冲洗5 min(3次),滴加DAB溶液显色,苏木素复染,梯度酒精脱水干燥,二甲苯透明,中性树胶封固。凋亡神经元细胞核为深浅不一的棕黄色或棕褐色,非凋亡神经元细胞核呈蓝色。200倍光学显微镜下观察神经元形态;随机选取每张切片的5个视野,计算细胞凋亡指数(AI)=凋亡细胞数/细胞总数×100%。
取上述大鼠海马组织,-80 ℃冰箱冻存。检测时取海马组织,加入蛋白裂解液,匀浆后4 ℃、12 000转/min下离心15min,取上清液使用BCA法进行蛋白测定。取50 μg总蛋白上样,SDS-PAGE电泳,电泳分离的蛋白转至PVDF膜。5%脱脂奶粉室温封闭2 h,洗膜缓冲液(TBST)洗膜10 min,重复3次。加入一抗(抗Caspase-3、Bax/Bcl-2、Beclin-1、LC3Ⅱ、LC3Ⅰ、p62抗体),4 ℃孵育过夜。TBST洗膜10 min,重复3次;加入二抗(辣根过氧化物酶标记山羊抗兔)后室温孵育1 h,TBST清洗,最后加入显色底物显色曝光,采用Image J图像分析软件测定各蛋白表达水平。
1.3 统计学分析
采用SPSS 19.0统计学软件进行分析,计量资料以均数±标准差表示,组间采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠脑组织病理学改变
C组海马组织未见明显的病理学改变,神经元排列紧密有序,神经元数量较多,胞体大小正常,形态规则,胞核呈圆形或椭圆形,核仁明显,染色质均匀;MV组神经元形态结构呈现明显异常,层次紊乱,神经元数量减少、排列稀疏、间隙增大,胞核深染、固缩;与MV组相比,3MA组病理学损伤明显减轻,正常神经元数量较多,神经元排列比较紧密,胞核呈圆形或椭圆形,核仁清晰,少见固缩变性的神经元;与MV组相比,R组病理学损伤进一步加重。见图1。
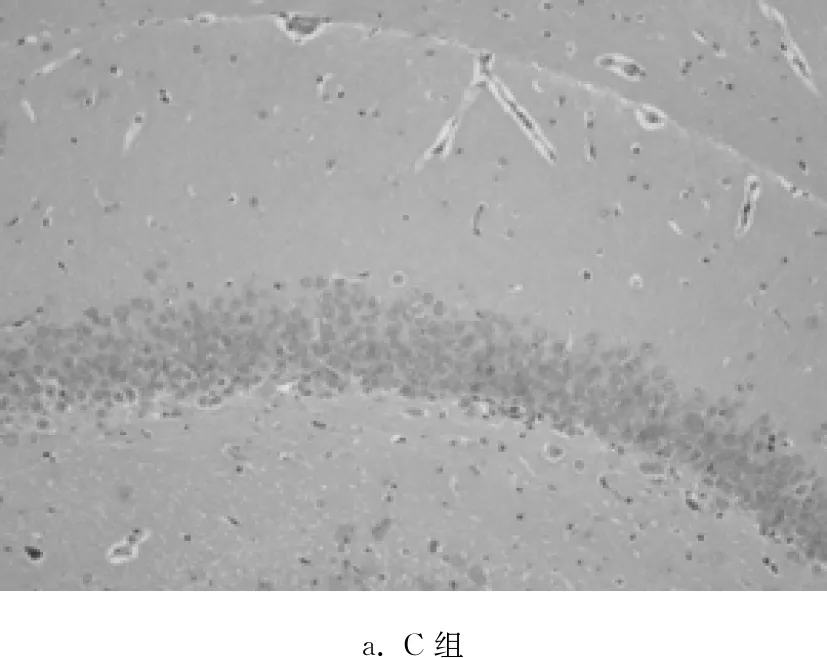
a. C组
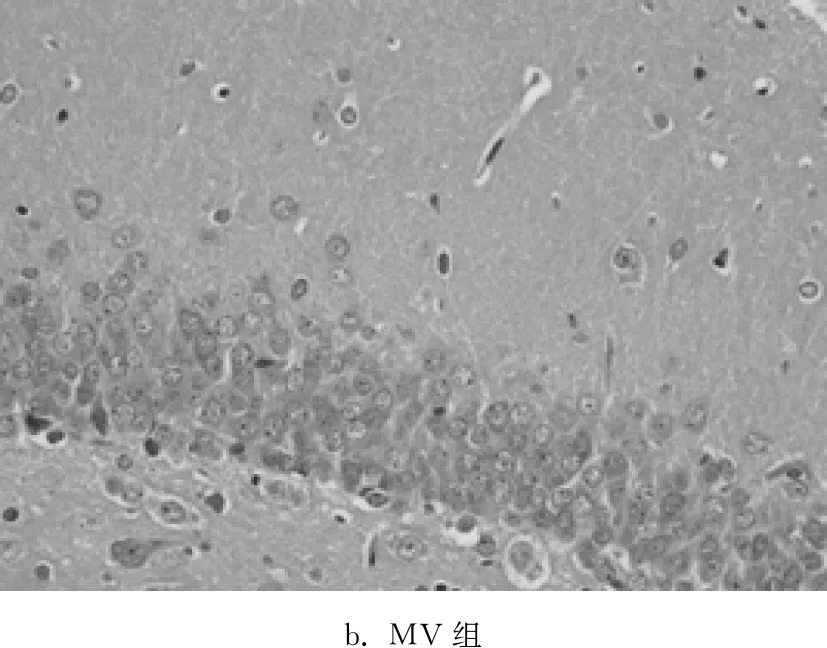
b. MV组
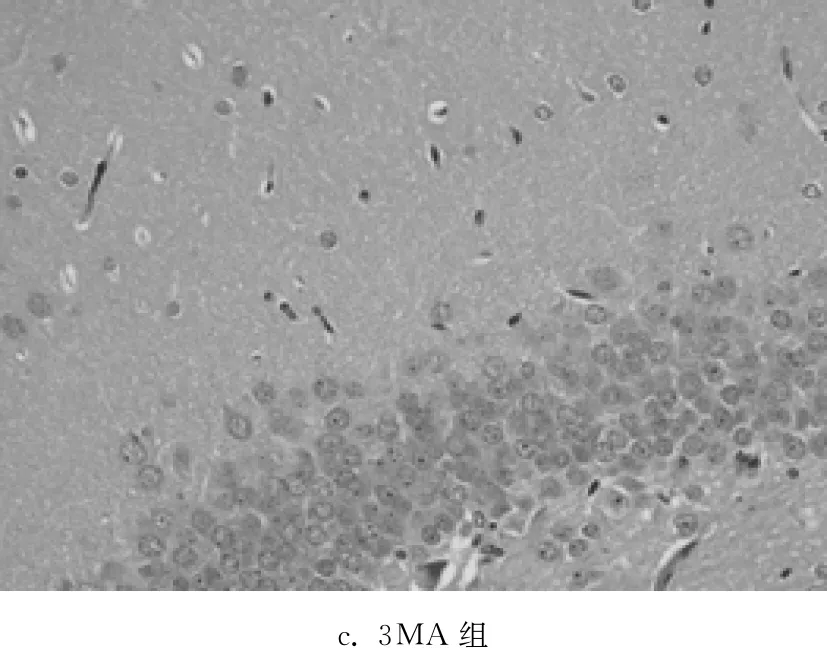
c. 3MA组
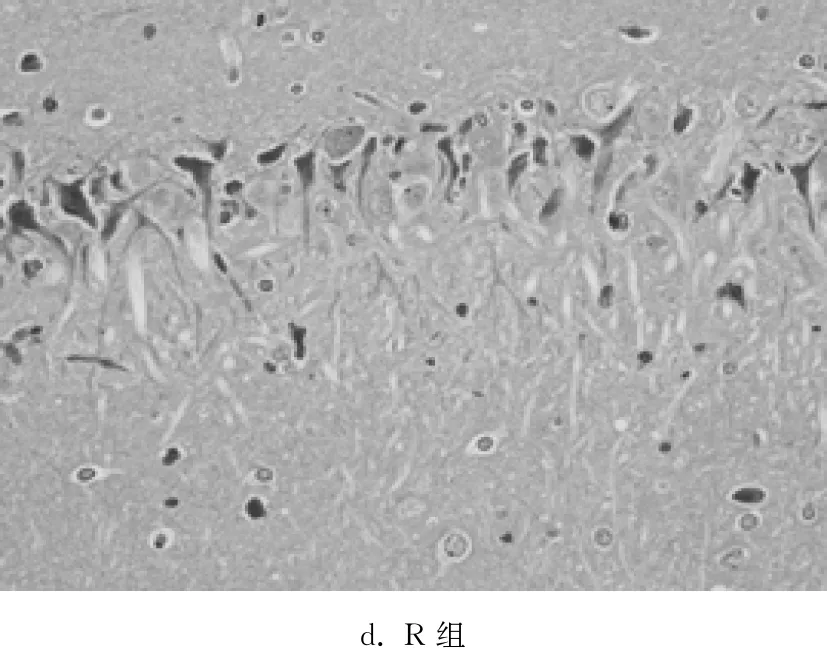
d. R组
图1光镜下观察各组大鼠脑组织病理学改变
2.2 神经元凋亡指数、Bax/Bcl-2比值、活化型Caspase-3表达比较
与C组比较,其余3组组海马神经元凋亡指数和Bax/Bcl-2比值升高,海马活化型Caspase-3表达显著上调(P<0.05);与MV组比较,3MA组大鼠的海马神经元凋亡指数和Bax/Bcl-2比值下降,海马活化型Caspase-3表达显著下调(P<0.05);与MV组比较,R组大鼠的海马神经元凋亡指数和Bax/Bcl-2比值升高,海马活化型Caspase-3表达显著上调(P<0.05)。见表1。
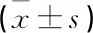
表1 4组大鼠海马神经元凋亡指数、Bax/Bcl-2比值、活化型Caspase-3表达比较
与C组比较,*P<0.05;与MV组比较,#P<0.05。
2.3 Beclin-1、LC3Ⅱ/Ⅰ比值、p62表达比较
与C组比较,其余3组海马Beclin-1、LC3Ⅱ/Ⅰ表达上调,p62表达显著下调(P<0.05);与MV组比较,3MA组大鼠海马Beclin-1、LC3Ⅱ/Ⅰ表达下调,p62表达显著上调(P<0.05);与MV组比较,R组大鼠海马Beclin-1、LC3Ⅱ/Ⅰ表达上调,p62表达显著下调(P<0.05)。见表2。
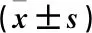
表2 4组大鼠海马Beclin-1、LC3Ⅱ/I比值、p62表达比较
与C组比较,*P<0.05;与MV组比较,#P<0.05。
3 讨 论
机械通气是治疗危重患者和全麻患者的重要手段之一,但长时间机械通气也可能会导致神经系统损伤,引起认知功能及记忆力的下降[11]。自噬是广泛存在的细胞维持稳态的生理现象,适当激活的自噬可以阻碍疾病发展,但是过度激活的自噬也可能加重细胞损伤。因此,探讨自噬在机械通气致大鼠脑组织神经元凋亡中的作用具有重要意义。
本研究大鼠均采用水合氯醛麻醉,均衡了麻醉因素对海马神经元凋亡的影响。参照文献[10],采用大潮气量长时间机械通气法建立机械通气致脑损伤模型。因为海马是脑区中与记忆和学习练习最为密切,所以本研究采集大鼠海马作为取材部位[12]。本研究结果显示,6 h、40 mL/kg机械通气下大鼠海马组织出现明显病理学改变,海马神经元凋亡指数升高,提示本研究机械通气致大鼠脑组织神经元凋亡模型制备成功。
Caspase是一个在细胞凋亡过程中起重要作用的蛋白酶家族,Caspase-9在凋亡起始中具有重要作用,激活的Caspase-9可以激活细胞凋亡的最关键酶Caspase-3,从而促进后续的细胞凋亡信号[13]。Bcl-2是凋亡抑制因子,Bax是凋亡促进因子,常用Bax/Bcl-2的比值反映细胞凋亡情况[14-15]。本研究表明,与MV组相比,3MA组Bax/Bcl-2比值下降、海马活化型Caspase-3表达下调,R组Bax/Bcl-2比值升高,海马活化型Caspase-3表达上调,提示自噬抑制剂3-MA减轻了机械通气导致的脑组织神经元凋亡程度,自噬诱导剂雷帕霉素加重了机械通气致脑组织神经元凋亡程度。
Beclin-1是哺乳动物参与自噬泡形成的特异性基因,是自噬起始的重要调节因子,Beclin-1的表达水平可以反映自噬程度[16]。LC3是哺乳动物细胞中酵母ATG8基因的同源物,分为LC3Ⅰ型和LCⅡ型,自噬发生时LC3 Ⅰ经泛素样加工修饰与磷脂酰乙醇胺结合,形成LC3 Ⅱ,LC3Ⅱ与LC3Ⅰ的比值常用来反映自噬水平[17]。p62是机体内蛋白降解途径的关键蛋白分子,其表达水平与自噬水平呈反比[18]。本研究结果表明,与C组比较,MV组海马Beclin-1、LC3Ⅱ/Ⅰ表达上调,p62表达下调。与MV组比较,3MA组大鼠海马Beclin-1、LC3Ⅱ/Ⅰ表达下调,p62表达上调,R组与之相反,提示机械通气致大鼠脑组织神经元凋亡的机制与自噬有关。
综上所述,长时间大潮气量机械通气致大鼠脑组织神经元凋亡的机制与自噬有关,但其具体机制仍有待进一步研究。

