EGCG对人肝星状细胞的生长状态及活化表型的影响
王琦 赵佳 陈大方 何晓岩 陈萍 刘慧 洪艺扬 沈筱芸
表没食子儿茶素没食子酸酯(EGCG)是一种从茶叶中提取的水溶性单体,具有明显的抗氧化、抗炎症、抗纤维化和抗肝癌作用[1-4]。肝星状细胞(hepatic stellate cell,HSC)不仅是全肝非实质细胞中占比近30%的基质细胞,也是肝脏中最主要的免疫细胞之一。活化的HSC是产生细胞外基质的主要场所,也是各种致纤维化因素作用的主要效应靶细胞,参与肝组织纤维化过程;HSC还具有抗原提呈细胞的活性,参与免疫调节过程。正常情况下HSC处于静止状态[5]。当肝脏有炎症或受到机械刺激等损伤时,HSC被激活,其表型由静止型转变为激活型,并且细胞膜表面表达活化标志物α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)。鉴于活化的HSC在EGCG抗纤维化作用机制中所扮演的角色尚不明确,笔者初步研究了EGCG对体外培养的人肝星状细胞株(LX-2)细胞的生长状态及活化表型的影响。
1 材料和方法
1.1 材料和仪器 LX-2购自中南大学湘雅医学院细胞室,实时无标记细胞分析技术(RTCA)系统由杭州艾森生物有限公司提供;DMEM培养基、FBS、青霉素和链霉素双抗购自美国CellMax公司;胰蛋白酶购自北京索莱宝科技有限公司;PBS购自杭州吉诺生物医药技术有限公司;纯度95%EGCG购自美国Sigma-Aldrich公司;α-SMA-Alexa Fluor 405流式抗体购自美国Life Technologies公司;细胞凋亡检测试剂盒(AnnexinV-PE/7-AAD)购自美国BD PharmingenTM公司;活细胞/凋亡细胞/坏死细胞鉴别试剂盒购自江苏凯基生物技术股份有限公司;CO2培养箱Heal Force HF90/HF240购自上海力申科学仪器有限公司;离心机Heraeus Multifuge X1R购自美国Thermo Fisher Scientific公司;普通倒置显微镜ZEISS primovert、荧光倒置显微镜ZEISS AXIO Observer A1购自德国Carl Zeiss Jena公司;流式细胞计数仪LSRFortessaTM购自美国BD公司。
1.2 细胞培养 将LX-2细胞置于含10%FBS和110g/L浓度丙酮酸钠的高糖DMEM培养液中培养,放于5%CO2和37℃恒温培养箱中,每2~3d传代1次,最多5次,显微镜下观察细胞未发生形态学变化。
1.3 EGCG对LX-2细胞生长影响监测 将LX-2细胞体外培养至对数生长期,经胰酶消化后,采用完全培养基终止反应,PBS洗涤、离心、重悬后作细胞计数。将LX-2细胞混悬液接种于RTCA系统的E-Plate 16孔板中(每孔总体积 150μl,含 8×103个细胞),放入细胞培养箱中的RTCA S16上,启动监测系统,每5min记录1次监测结果。待细胞增长至对数生长期(约18 h)时暂停监测,将E-Plate 16孔板取出,分别加入终浓度为0、25、50、75、100、125、150、175μmol/L 的 EGCG,并设重复孔。重新将E-Plate 16孔板放回培养箱中的RTCA S16上,每15min监测1次细胞活力和增殖情况,持续监测72h(总监测时间可长达200h)。通过RTCA系统动力学变化反应曲线反映各孔0~90h间LX-2细胞的生长状况。监测结果显示为标准化细胞指数(cell index,CI)。通过RTCA Data Analysis Software 1.0软件分析上述不同浓度EGCG作用至72h的CI值,生成增殖曲线和斜率,其中,增殖曲线可以直观反映不同浓度梯度的药物在连续作用至最后检测时间点时的细胞生长状态,斜率可以间接反映某一时间段细胞的增殖速率,斜率越大,细胞增殖速度越快,斜率越小,细胞增殖速度越慢;随着监测时间延长,各组斜率逐渐减小接近0轴,说明细胞增殖速率逐渐减慢至不再增殖,斜率负值表示细胞不仅不再增殖,且发生了明显的凋亡,呈负增长状态。
1.4 LX-2细胞凋亡率检测 取对数生长期LX-2细胞,将LX-2细胞混悬液接种于6孔板(每孔总体积2ml,含3×105个细胞),置于细胞培养箱 6h后,加入终浓度为0、25、50μmol/L的EGCG,分别继续培养48和72h后,胰酶消化,完全培养基终止消化,收集细胞至15ml离心管。用预冷的PBS洗涤2次,离心,弃上清液,1×Binding Buffer重悬细胞后调整成浓度为1×106个/ml的细胞悬液,取100μl/管细胞悬液至5ml流式管,每管分别加入5μl AnnexinV-PE和5μl 7-AAD,充分混匀后室温避光孵育15min,最后每管再加入400μl 1×Binding Buffer,充分混匀后在1h内上流式细胞仪检测。每组做3个复孔,重复实验3次。实验结果采用Flowjo 7.6流式专业分析软件分析,设十字门四象限显示各类细胞各自占总细胞的比率(%),分别为:活细胞率(Q4)、早期细胞凋亡率(Q3)、晚期细胞凋亡率(Q2)、坏死细胞率(Q1),其中细胞总凋亡率=Q3+Q2。
1.5 α-SMA表达检测 取对数生长期LX-2细胞,按1.4方法处理细胞后,收集细胞至15ml离心管,PBS洗涤1次,离心,弃上清液。每管加入4%多聚甲醛500μl于4℃中固定10min,PBS洗涤、离心、弃上清液,加入0.1%Triton X-100/PBS,室温孵育15min,PBS洗涤、离心、弃上清液,再加入10%羊血清/PBS,室温孵育1h,再次PBS洗涤、离心、弃上清液后取适量PBS重悬细胞,将细胞悬液移至流式管,每管分别加入5μl流式抗体α-SMA-Alexsa Fluor 405室温避光孵育30min,最后PBS洗涤、离心、弃上清液,每管加入200μlPBS重悬细胞后上流式细胞仪检测α-SMA表达。实验结果采用Flowjo 7.6流式专业分析软件分析,采用荧光素Alexsa Fluor 405的平均荧光强度值来反映α-SMA的表达强弱程度。每组作3个复孔,重复实验3次。
1.6 细胞凋亡形态观察 采用吖啶橙/溴乙锭(AO/EB)染色法。AO能透过胞膜完整的细胞,嵌入细胞核DNA,使之发出明亮的绿色荧光;EB仅能透过胞膜受损的细胞,嵌入细胞核DNA,发出橘红色荧光。凋亡细胞呈现为染色增强,荧光更为明亮,均匀一致的圆状或固缩状、团块状结构;非凋亡细胞核呈现荧光深浅不一的结构样特征,两者形态明显不同。在荧光显微镜下观察,可见4种细胞形态:活细胞,核染色质着绿色并呈正常结构;早期凋亡细胞,核染色质着绿色呈固缩状或圆珠状;非凋亡的死亡细胞,核染色质着橘红色并呈正常结构;晚期凋亡细胞,核染色质为橘红色并呈固缩状或圆珠状。
1.7 统计学处理 采用Graphpad Prism 6.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 EGCG对LX-2细胞生长状态的影响 加入EGCG后,LX-2细胞的增殖曲线整体下移,且呈药物浓度依赖性梯度变化,其中增殖曲线中最早且最急剧的下降时间为加入EGCG 3h后,表明EGCG作用3h后的LX-2细胞的生长开始受抑制,见图1。此外,EGCG作用时间越长,细胞增殖抑制作用越明显,EGCG浓度越高,细胞增殖抑制作用越明显,见图2。
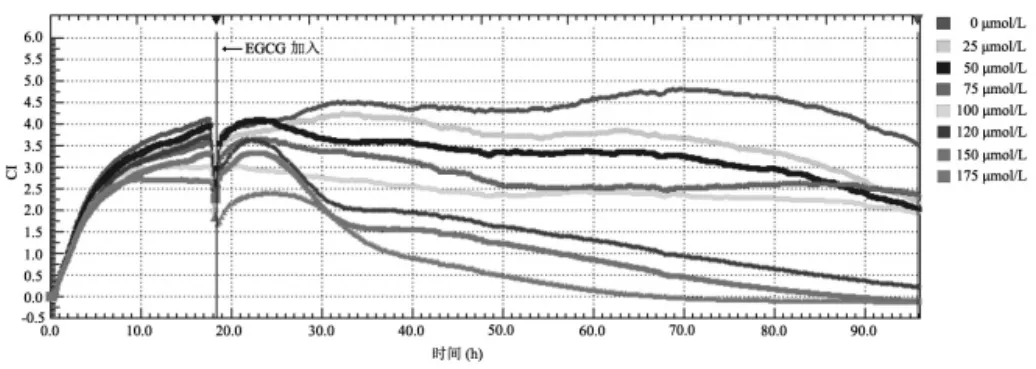
图1 RTCA实时监控不同浓度EGCG对LX-2细胞的生长状态的影响
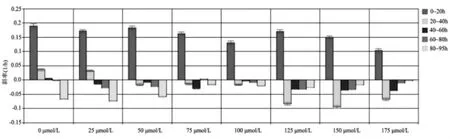
图2 RTCA实时监控不同浓度EGCG对LX-2细胞增殖速率的作用
2.2 不同浓度EGCG作用后LX-2细胞凋亡率比较 根据上述RTCA药物细胞监测结果,笔者选择0、25、50μmol/L这3个浓度EGCG进行后续研究,通过AnnexinV-PE/7-AAD双染法标记细胞,采用流式细胞仪检测不同浓度EGCG作用48和72h后LX-2细胞的凋亡率。结果显示,0、25、50μmol/L的EGCG作用48h后,细胞总凋亡率组间比较差异均无统计学意义(均P>0.05);而EGCG 作用 72h后,25μmol/L和 50μmol/L组的细胞总凋亡率与0μmol/L组相比,差异均有统计学意义(均P<0.05),50μmol/L组的细胞总凋亡率也明显高于25μmol/L组(P<0.01);细胞总凋亡率的组间差异是由早期凋亡变化引起,晚期凋亡差异无统计学意义。结果提示,EGCG可能通过诱导细胞发生凋亡的方式来抑制细胞增殖,见图3。
2.3 EGCG作用后LX-2细胞α-SMA的表达 不同浓度 EGCG作用 48或 72h后,25μmol/L和 50μmol/L组的α-SMA平均荧光强度均明显低于0μmol/L,差异有统计学意义(均P<0.01),25μmol/L与 50μmol/L组比较差异无统计学意义(P>0.05)。结果说明,EGCG可以抑制LX-2细胞的活化标志物α-SMA的表达,且作用时间越久,抑制效果更明显,见图4。
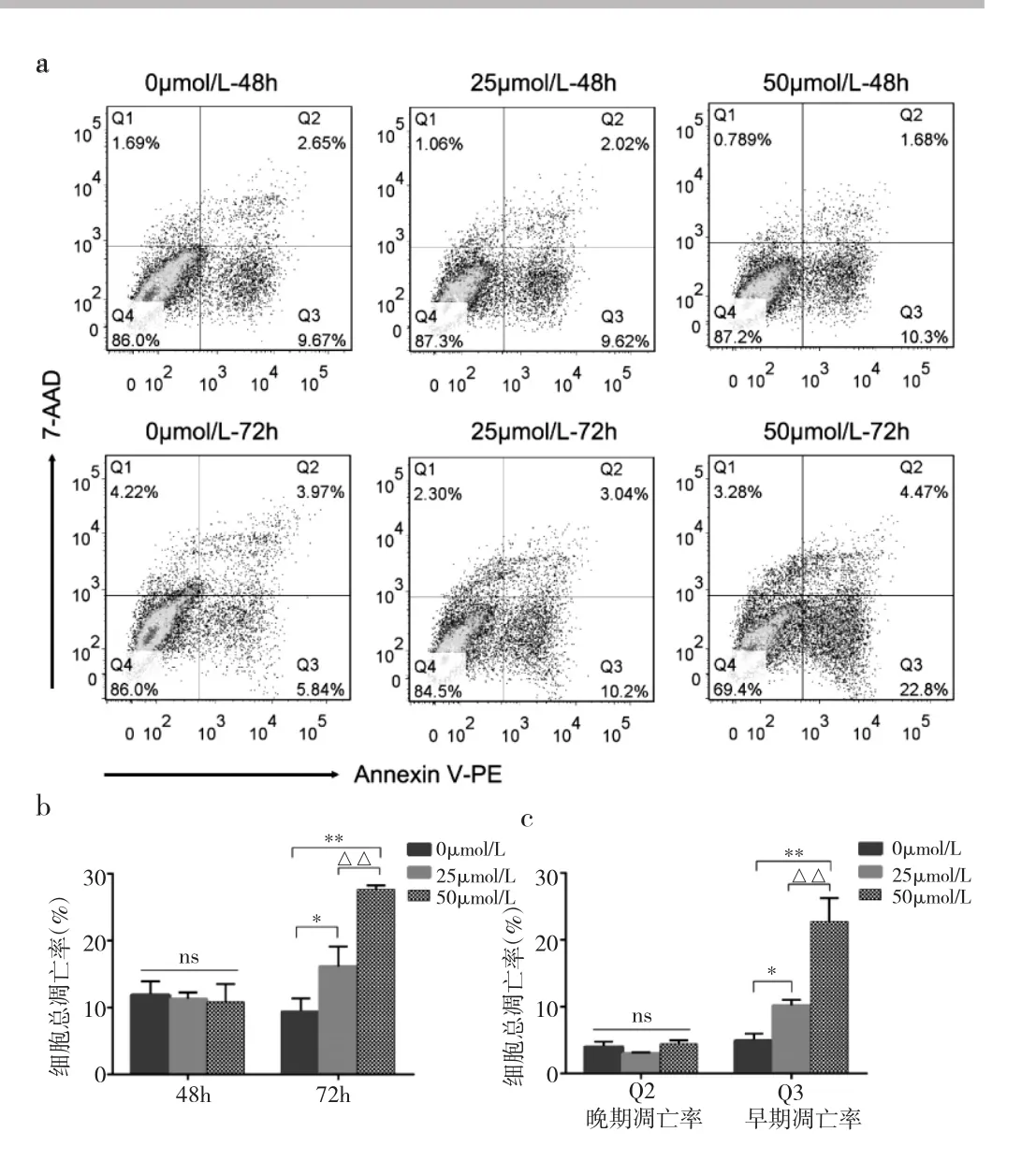
图3 不同浓度EGCG作用后LX-2细胞的流式细胞图和凋亡率比较(a:干预48、72h后的流式细胞图;b:不同浓度 EGCG作用48和72h后的LX-2细胞总凋亡率比较;c:不同浓度EGCG作用72h后的 Q2与 Q3比较;与 0μmol/L 组比较,*P<0.05,**P<0.01;与 25μmol/L组比较,△△P<0.01,nsP >0.05)
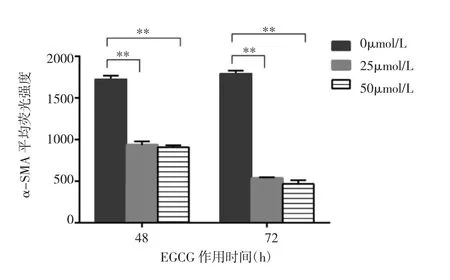
图4 流式检测EGCG作用后LX-2细胞α-SMA的表达(与0μmol/L 组比较,**P<0.01)
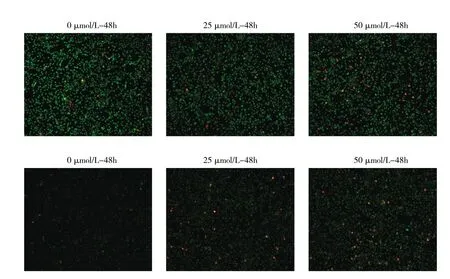
图5 EGCG作用后荧光显微镜下所见(AO/EB染色,×50)
2.4 各组细胞凋亡形态比较 EGCG作用48h,与0μmol/L组比较,25、50μmol/L组的活细胞生长密度降低,橘红色的凋亡细胞增多;EGCG作用72 h,与0μmol/L组比较,25、50μmol/L组活细胞生长密度更低,橘红色的凋亡细胞明显增多。说明EGCG浓度越高,作用时间越长,抑制细胞增殖和诱导凋亡的作用越明显,见图5(插页)。
3 讨论
HSC是1种位于肝脏窦周间隙Disse腔内的非实质细胞,这种细胞呈星状细胞形态,细胞中富含维生素A和脂质小滴,其细胞突起与肝脏内的自主神经末梢相连,能将肝内自主神经冲动传递给肝实质细胞。HSC有静息和活化两种状态,正常情况下肝星状细胞呈静息状态,在肝脏中主要参与维生素A的代谢、储存脂肪、调节血管和肝窦血流。当肝脏受到物理、化学及病毒感染生物因素的刺激时,处于静息状态的HSC就会被激活,胞体增大,胞突伸展,胞质中脂滴消失,维生素A含量减少,发生增殖并转变为“肌成纤维细胞”[6]。自1876年Kupffer意外发现并命名为HSC以来,聚焦HSC的研究结果一致认为,细胞外基质(extracellular matrix,ECM)是肝纤维化发生发展过程中的主要介质,而持续活化的HSC是肝纤维化中ECM的主要来源。活化的HSC能表达活化标志物α-SMA、波形蛋白和结蛋白,并通过增生和分泌ECM参与肝纤维化的形成和肝内结构的重建;同时通过自分泌转化生长因子-β、血小板衍生生长因子、内皮素-1等细胞因子使自身活化持续进行。此外,HSC还能促使肝窦内皮细胞收缩使肝窦内压升高[7]。因此,抑制星状细胞的活化和减少纤维化介质ECM的分泌一直是抗纤维化治疗的主要策略。
EGCG被认为是绿茶多酚的主要的活性成分。EGCG是1种有效的抗氧化剂,因其在预防氧化应激相关疾病(包括癌症,心血管疾病和纤维化)中的作用而备受关注[8-10]。其中1项有关EGCG在非酒精性脂肪性肝病小鼠模型的研究中,观察到EGCG与阿托伐他汀(ATST)有相似的功效,并通过EGCG和ATST治疗组的RNA微阵列数据的整合生物信息学分析发现,纤维化相关基因如Ⅰ型胶原 1、Ⅰ型胶原 2、Ⅲ型胶原1和Ⅵ型胶原3都出现明显下调,证明EGCG确实有抑制肝纤维化的功效[11]。有学者研究过EGCG对体外培养的大鼠HSC侵袭和迁移的影响[12]。为了进一步了解EGCG对肝纤维化的抑制作用,笔者研究ECGC对LX-2细胞生长状态及活化表型的影响。利用RTCA系统连续监测72h不同浓度EGCG对LX-2细胞生长状态的影响,结果显示EGCG作用时间越长,细胞增殖抑制作用越明显,EGCG浓度越高,细胞增殖抑制作用越明显;而通过流式细胞术和倒置荧光显微镜均得到进一步验证,EGCG能通过诱导凋亡的方式抑制LX-2细胞的增殖和活化。
本研究不仅通过RTCA动态监测技术明确了EGCG对人肝星状细胞株的药物毒性反应,也通过荧光染色利用不同的检测技术明确了EGCG作用后的LX-2细胞生长状态和活化标志α-SMA的影响,为EGCG抗肝纤维化的药物活性和机制研究提供更具体的实验数据。来自单细胞基因和蛋白质调节研究的最新结果开始揭示先前未被充分认识的HSC功能表型,该研究通过开发相关的数学模型,描述了HSC功能表型对肝脏再生的贡献,并通过单个HSC的分离和转录表征的测试模型,将HSC功能表型的分布动态变化与严格调节的肝再生生理反应相关联。结果鉴定出导致肝再生的4种HSC转录状态(其中两种为首次报道的转录状态),并揭示了不同转录状态的HSC表型之间的差异及这些表型的动态转换如何控制肝再生的过程[13]。这为笔者的下一步研究带来启示,利用EGCG对HSC的抑制作用,除了能起到抗纤维化功效,是否还能干预不同HSC表型对肝再生的调控,成为抗肝纤维化和诱导肝再生的利器。

