肠道菌群强化改善方案对乙肝肝硬化患者肝纤维化程度、肠道通透性指标及炎性细胞因子的影响
罗万蓉 蒋香梅 邬碧波 庄汉
目前乙肝肝硬化临床治疗以联合抗病毒方案为基础,可在一定程度上改善总体疗效,但难以有效延缓肝硬化进展[1]。氧化应激增强和免疫功能紊乱是影响病毒清除效果及肝纤维化病情进展关键因素;而国外学者报道证实,肠道炎症细胞因子过度分泌导致通透性改变及入血后继发肝细胞损伤亦是诱发肝硬化发生发展的重要原因[2]。以往对于乙肝肝硬化患者多给予微生态制剂辅助治疗以调节肠道菌群组成,减少炎性细胞因子入血,但存在个体疗效差异大,见效缓慢等问题。近年来乳果糖以其高效抗氧化、免疫调节等作用被逐渐用于肝硬化临床治疗,并取得令人满意效果,但国内尚缺乏相关随机对照研究对这一优势进行确证。本文旨在探讨肠道菌群强化改善方案对乙肝肝硬化患者肝纤维化程度、肠道通透性指标及炎性细胞因子的影响,为临床治疗方案选择提供更多循证依据,现报道如下。
资料和方法
一、临床资料
研究对象选取我院2014年3月至2016年8月收治乙肝肝硬化患者共110例,均符合《慢性乙型肝炎防治指南(2010年版)》诊断标准[3],Child-Pugh评分≥7分,HBsAg(+),HBV DNA拷贝数>100拷贝数/mL,方案经医院伦理委员会批准,且患者及家属知情同意;同时排除合并其他类型肝炎病毒感染或HIV感染,既往食管静脉曲张破裂和肝性脑病病史,其他原因导致肝硬化,免疫系统疾病,血液系统疾病,重要脏器功能障碍,溃疡性结肠炎,糖尿病,慢性胆囊炎及临床资料不全者。全部患者以随机数字表法分为对照组和观察组,每组各55例;对照组患者中男性35例,女性20例,平均年龄为(45.19±5.60)岁,平均HBV DNA水平为(5.81±1.63)×106拷贝数/mL,根据Child-Pugh分级划分,B级31例,C级24例;观察组患者中男性37例,女性18例,平均年龄为(45.33±5.64)岁,平均HBV DNA水平为(5.89±1.65)×106拷贝数/mL,根据Child-Pugh分级划分,B级33例,C级22例;两组患者一般资料比较差异无统计学意义(P>0.05)。
二、方法
入选患者均给予常规抗病毒方案治疗,包括:①拉米夫定(福建广生堂药业股份有限公司生产,国药准字H20113025,规格100 mg)100 mg/d口服;②阿德福韦酯(河北医科大学制药厂生产,国药准字H20100172,规格10 mg)10 mg/d口服;对照组患者采用双歧杆菌三联活菌(内蒙古双奇药业股份有限公司生产,国药准字S19980004,规格0.5 g)单用治疗,1.5 g/次,3次/d;观察组患者则在此基础上加用乳果糖(北京韩美药品有限公司生产,国药准字H20065730,规格100 mL)辅助治疗,10 mL/次,3次/d;两组患者治疗时间均为12个月。
三、观察指标
①记录患者疗程结束后HBV DNA转阴、HBeAg转阴及HBeAg/抗HBeAb转换例数,计算百分比;其中以HBV拷贝数<1×103拷贝数/mL作为HBV DNA转阴判定标准[6];②肝功能指标包括丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、白/球蛋白(A/G)、总胆红素(TBil)及Child-Pugh评分;其中ALT、AST及TBil检测采用美国Beckman Coulter公司生产AU5800全自动生化分析仪;Child-Pugh评分分值5~15分,分值越高提示病情越严重[6];③肝纤维化指标包括透明质酸(HA)、层黏连蛋白(LN)、Ⅳ型胶原(Ⅳ-C)及Ⅲ型前胶原(PC-Ⅲ),检测方法采用ELISA法,试剂盒由珠海泉晖生物技术有限公司提供;④肠道通透性指标包括内毒素、D-乳酸及PCT,检测仪器同肝功能指标;⑤炎性细胞因子指标包括TNF-α、IL-6及IL-8,检测仪器同肝功能指标;⑥记录患者治疗过程中自发性腹膜炎发生例数,计算百分比。
四、统计学处理
采用SPSS20.0软件进行数据分析;其中计量资料采用t检验,以(均数±标准差)表示;计数资料采用χ2检验,以百分比(%)表示;检验水准为α=0.05。
结 果
一、两组患者抗病毒效果比较
对照组患者HBV DNA转阴率、HBeAg转阴率及HBeAg/抗HBeAb转换率分别为70.91%(39/55)、12.73%(7/55)、7.27%(4/55);观察组患者HBV DNA转阴率、HBeAg转阴率及HBeAg/抗HBeAb转换率分别为81.82%(45/55)、29.09%(16/55)、20.00%(11/55);观察组患者HBV DNA转阴率、HBeAg转阴率及HBeAg/抗HBeAb转换率均明显高于对照组(P<0.05)。
二、两组患者治疗前后肝功能指标水平比较
观察组患者治疗后ALT、AST、A/G、 TBil及Child-Pugh评分均明显优于对照组、治疗前(P<0.05);见表1。
三、两组患者治疗前后肝纤维化指标水平比较
观察组患者治疗后HA、LN、IV-C及PC-Ⅲ水平均明显低于对照组、治疗前(P<0.05);见表2。
四、两组患者治疗前后肠道通透性指标水平比较
观察组患者治疗后内毒素、D-乳酸及PCT水平均明显低于对照组、治疗前(P<0.05);见表3。
五、两组患者治疗前后炎性细胞因子指标水平比较
观察组患者治疗后TNF-α、IL-6及IL-8水平均明显低于对照组、治疗前(P<0.05);见表4。
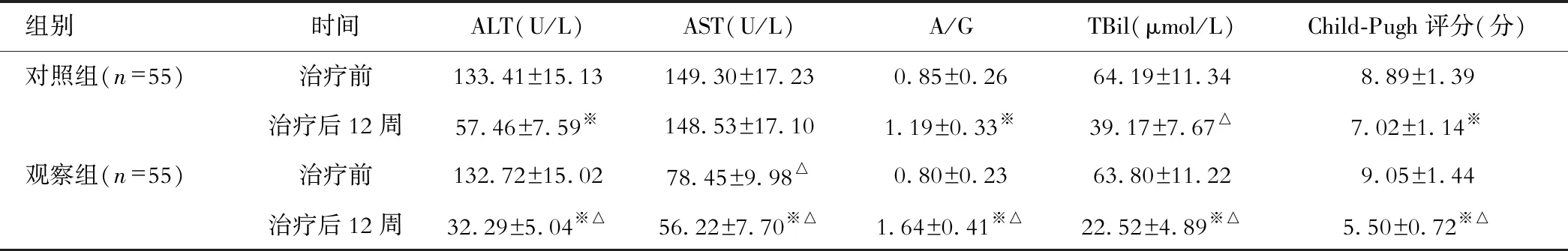
表1 两组患者治疗前后肝功能指标水平比较
注:与对照组相比,△P<0.05;与治疗前比较,※P<0.05
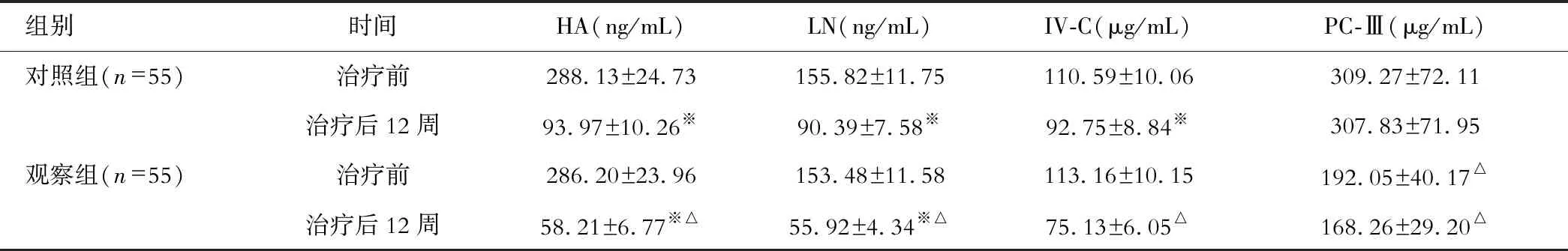
表2 两组患者治疗前后肝纤维化指标水平比较
注:△与对照组相比,P<0.05;※与治疗前比较,P<0.05
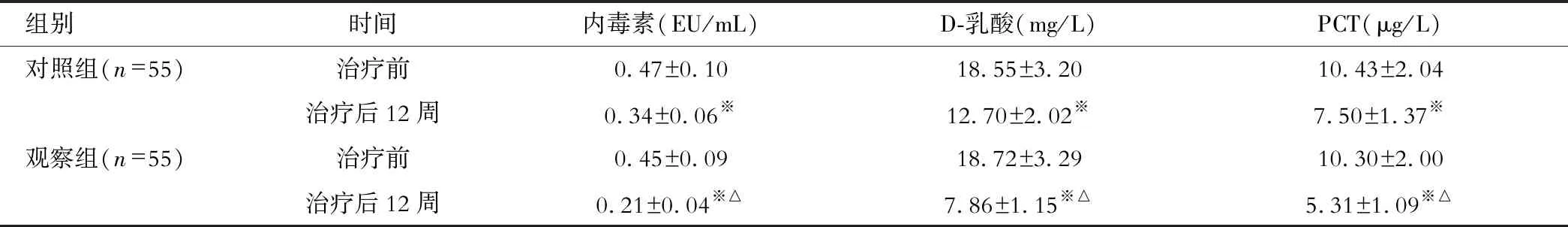
表3 两组患者治疗前后肠道通透性指标水平比较
注:△与对照组相比,P<0.05;※与治疗前比较,P<0.05

表4 两组患者治疗前后炎性细胞因子指标水平比较
注:△与对照组相比,P<0.05;※与治疗前比较,P<0.05
六、两组患者自发性腹膜炎发生率比较
对照组和观察组患者自发性腹膜炎发生率分别为20.00%(11/55),5.45%(3/55);观察组患者自发性腹膜炎发生率显著低于对照组(P<0.05)。
讨 论
流行病学报道显示,未行规范抗病毒干预乙肝肝硬化患者随访5年,进展恶变风险超过10%,其中约20%~30%进入肝硬化失代偿期[7]。拉米夫定联合阿德福韦酯是目前乙肝肝硬化患者主要抗病毒方案;其中拉米夫定属于脱氧核苷类抗病毒药物,主要通过干扰HBV DNA复制增殖进程而达到治疗目的;而阿德福韦酯则是一类无环核苷类似物,其入血后水解形成活性产物二磷酸阿德福韦,能够直接对HBV DNA聚合酶产生抑制效应[4]。但大量临床报道显示[5],单纯抗病毒方案用于乙肝肝硬化治疗存在停药后易复发,耐药菌株形成后疗效下降等问题,难以满足临床需要。
医学界对于乙肝肝硬化发生发展机制尚未彻底阐明,近年来研究证实HBV持续感染以外,异常氧化应激损伤、免疫功能紊乱及肠道炎性细胞因子分泌亢进均广泛参与病情进展过程[6]。国内外学者报道证实,以双歧杆菌三联活菌为代表微生态制剂能够对肠道正常菌群进行调节,降低肠源性内毒素血症程度,改善肠道屏障功能,并有助于上调黏膜屏障效应,这对于保护乙肝肝硬化肝脏功能和延缓病情进展具有显著促进作用。乳果糖则由果糖与半乳糖以B-1,4糖苷键人工连接合成,其进入人体后可在A-半乳糖苷酶作用下分解,进而为双歧杆菌生长繁殖提供充足碳源,提高肠道B族维生素合成水平,最终达到有效营养肠道的目的[7]。已有研究表明[8],乳果糖辅助用于乙肝肝硬化患者治疗能够降低肠道通透性,抑制内毒素入血;同时其还能够增强机体免疫功能、纠正氧化-抗氧化系统失衡,消除体内过量氧自由基,延缓肝细胞凋亡坏死和缺血进程,这对于降低远期病情进展恶变风险具有重要意义。
本次研究结果中,观察组患者HBV DNA转阴率、HBeAg转阴率及HBeAg/抗HBeAb转换率均明显高于对照组(P<0.05);观察组患者治疗后ALT、AST、A/G、 TBil及Child-Pugh评分均明显优于对照组、治疗前(P<0.05);观察组患者治疗后HA、LN、IV-C及PC-III水平均明显低于对照组、治疗前(P<0.05),证实加用乳果糖辅助治疗乙肝肝硬化在提高病毒清除效果、改善肝脏功能及降低肝纤维化程度方面具有优势;观察组患者治疗后内毒素、D-乳酸、PCT、TNF-α、IL-6及IL-8水平均显著低于对照组、治疗前(P<0.05),提示乙肝肝硬化患者行肠道菌群强化改善方案应用有助于降低肠道通透性和抑制机体炎症细胞因子分泌水平,这可能是该方案更加具有临床疗效的关键机制所在。炎性细胞因子释放亢进在乙肝肝硬化病情进展及自发性腹膜炎发生方面的重要性已被广泛认可;其中TNF-α、IL-6及IL-8均参与急性肝细胞炎症反应过程,TNF-α和IL-6可激活NK细胞、T细胞及B细胞分化吞噬功能,加重肝硬化炎症反应;而IL-8则具有趋化和激活中性粒细胞效应;三者水平与肝硬化患者局部炎症损伤程度呈正相关[14]。同时乙肝肝硬化患者肠道黏膜屏障受损后肠道细菌和内毒素易位引起肠源性内毒素血症是重要预后不良因素;而内毒素、D-乳酸及PCT均是评价肠黏膜通透性和屏障功能敏感血清学指标[10]。此外观察组患者自发性腹膜炎发生率显著低于对照组(P<0.05),则说明肠道菌群强化改善方案应用还能够降低乙肝肝硬化患者自发性腹膜炎发生风险,总体疗效值得认可,与以往研究结论相符[8]。
综上所述,肠道菌群强化改善方案治疗乙肝肝硬化可有效提高病毒清除效果,保护肝脏功能,降低肝纤维化程度和肠道通透性,抑制炎症反应水平,并有助于预防自发性腹膜炎发生风险。但鉴于纳入样本量不足,随访时间短及单一中心等因素制约,所得结论仍有待更深入多中心前瞻性随机对照研究确证。

