先天性胆道闭锁行与未行葛西术患儿临床病理特点
——附58例对比研究
赵新颜 罗文萍 刘立伟 魏琳 何恩辉 贾继东 孙丽莹 朱志军
先天性胆道闭锁(congenital biliary atresia, BA)是一种病因尚未明确的以肝外胆道发育异常、导致进行性胆汁淤积性肝病,如未能及时诊治常快速进展为胆汁性肝硬化,多于1~2岁死于肝功能衰竭[1]。BA发病率为1/8 000~1/14 000,特别是亚洲国家发病率较高[2-5]。BA也是我国新生儿黄疸的主要原因,是儿童肝移植的主要适应证[6, 7]。
BA主要表现为出生后黄疸进行性加重,陶土样大便,确诊主要依靠影像学检查,如腹部B超、CT或核医学肝胆显像[8],对于诊断困难的患儿可剖腹探查,术中胆管造影可以明确诊断。胆道闭锁葛西术(Kasai procedure)是将第一肝门与肠腔吻合,将残留细小胆管与肠道连通,重建胆汁流,缓解胆汁淤积[9]。如手术及时,多数患儿可存活,但仍有50%~70%的患儿发展为肝硬化,最终需要肝脏移植挽救生命[10-12]。
肝脏病理学检查对新生儿胆汁淤积性肝病诊断及鉴别诊断至关重要[13-14]。本文比较BA行与未行葛西术患儿的临床特点,以提高对本病的认识。
材料与方法
一、研究对象
2017年1月至2018年10月,在首都医科大学附属北京友谊医院肝移植中心进行肝移植手术并符合BA诊断标准患儿共58例,其中行葛西术者44例,未行葛西术者14例。入选标准:葛西术前BA主要依靠腹部B超典型改变,核素肝胆管显像未见肝外胆管显影;葛西术后、肝移植术前、术中所见或胆道造影明确诊断为BA的患儿。排除其他病因导致的儿童胆汁淤积性肝病[15-16]。
二、临床资料收集
记录患儿性别、年龄、发病年龄、葛西术时年龄、肝移植年龄等临床资料。肝移植前1天,检测白细胞、中性粒细胞、血红蛋白、血小板、血清总胆红素、直接胆红素、胆汁酸(TBA)、白蛋白、球蛋白、血肌酐、国际标准化比值(international normalized ratio, INR)等。Child-Pugh及终末期肝病模型(MELD)评分。
三、病理切片制备
肝移植术中取病肝组织0.5 cm×0.5 cm×0.5 cm,4%甲醛溶液固定,常规脱水,石蜡包埋,4 μm厚连续切片,经苏木素-伊红染色(HE)、Masson三色染色、淀粉酶消化糖原染色(DPAS)、网状纤维、铜(罗丹宁)、铁(普鲁士蓝)染色。光镜观察肝细胞淤胆、毛胆管胆栓、库普弗细胞吞噬胆汁等急性淤胆表现,汇管区细胆管增生、细胆管内胆栓等阻塞性黄疸表现,汇管区炎性细胞浸润、胆纤维化程度等。上述病理变化程度划分参见参考文献[17, 18]。
四、统计学方法
计量资料中,符合正态者采用均数±标准差表示,不符合正态分布者采用中位数(四分位数间距)表示,计数资料用例数(%)表示。两组间连续变量比较采用独立样本t检验或Mann-Whitney U检验。两组间计数资料比较用卡方检验或秩和检验。采用IBM SPSS Statistics Version 24.0软件。P<0.05为差异有统计学意义。
结 果
一、行葛西术与未行葛西术患儿基本资料比较
葛西术组中位发病年龄及肝移植时年龄显著大于未行葛西术组。男女比例为1∶1.2。行葛西术后仍需要肝移植的指征包括:门脉高压症腹水(70.5%)、食管胃底静脉曲张破裂出血(11.4%)及肝性脑病(2.3%)。见表1。

表1 行葛西术与未行葛西术患儿基本资料比较
二、行葛西术与未行葛西术患儿实验室指标比较
与未行葛西术组比较,行葛西术组患儿总胆红素及直接胆红素显著降低。未行葛西术组,白细胞及中性粒细胞绝对值较葛西术组显著升高,提示前者胆管梗阻更为严重,多因胆系感染所致;尽管两组患儿均有轻-中度贫血,但差异无统计学意义。较未行葛西术组,行葛西术后血小板计数升高。未行葛西术Child Pugh 评分及MELD评分均明显升高,提示肝脏损伤程度更为严重。值得注意的是,两组胆红素差异明显,但胆汁酸水平差异无统计学意义。见表2。
三、行与未行葛西术前后腹部超声检查结果比较
与行葛西术组比较,未行葛西术组门脉内径显著变窄,脾脏厚度及长度均显著减低,差异有统计学意义。两组患儿门脉峰流速无显著性差异,行葛西术组2例出现门脉系统血栓,未行葛西术组未见门脉血栓形成。见表3。

表3 行与未行葛西术组影像学指标的比较
四、行与未行葛西术患儿病理特征比较
葛西术后肝脏病理所见:纤维间隔显著变窄、细胆管反应及细胆管胆栓显著减轻;急性淤胆特征:肝细胞淤胆、胆汁淤积性菊型团、毛细胆管胆栓及Kupffer细胞淤胆显著好转;反映大胆管梗阻特征的胆汁湖、汇管区疏松水肿程度显著减轻。小胆管损伤或胆管缺失、小动脉增生两组间差异无显著性统计学意义。见表4。行与未行葛西术组肝组织病理特点见图1。
讨 论
肝活组织检查对未行葛西术BA患儿的诊断灵敏度为88.4%、特异度为92.7%,总体准确率为90.1%[19]。本研究未行葛西术BA患儿肝病理主要特点包括,汇管区周边明显细胆管反应、细胆管胆栓形成及汇管区水肿、肝细胞淤胆、毛细胆管胆栓(胆汁淤积性菊型团)、Kupffer细胞淤胆,严重者可见胆汁湖,与既往研究报道一致[19-23]。随病情进展出现慢性淤胆表现,如泡沫样细胞、汇管区周边疏松水肿带,继发性铜沉积;汇管区纤维组织增生,纤维间隔宽阔分隔肝实质,最终导致胆汁性肝纤维化及肝硬化[24]。10%~20%患儿可见巨细胞改变。汇管区不同程度炎性细胞浸润,早期小胆管多保留、后期可出现小胆管消失,当合并上行感染时,可见化脓性胆管炎表现。
葛西术后,如果胆汁流恢复,患儿病理急性淤胆表现,如肝细胞淤胆、毛细胆管胆栓明显好转或消失,细胆管反应减轻、细胆管胆栓消失,临床黄疸减轻或消退。汇管区及间隔内水肿及炎症明显减轻或消失,纤维化的程度与葛西术时间关系密切,如葛西术及时且重建了有效胆汁流,纤维化可不明显,如未及时行葛西术或葛西术不成功,纤维间隔往往较为宽阔,后期患儿仍可出现门脉高压表现,这与既往研究结果一致[25]。
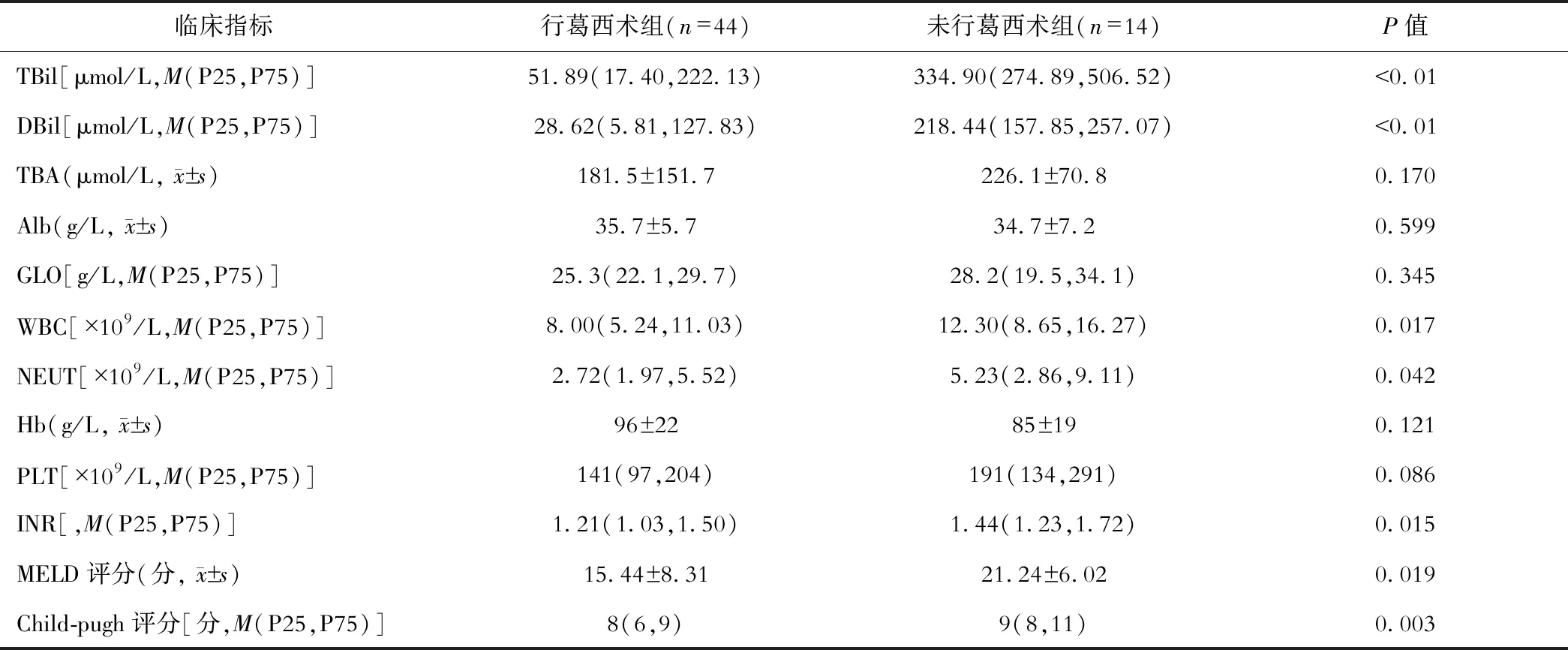
表2 行葛西术与未行葛西术患儿实验室指标的比较

表4 葛西术与未行葛西术病理比较(例)

注:未行葛西术组(A, C, E)细胆管反应及细胆管胆栓、肝纤维化及急性淤胆程度均显著高于葛西术后组(B, D, F)。 A、B、E、F,HE×40;C、D,Masson×40
尽管葛西术的广泛开展,挽救了绝大多数患儿生命,但是仍有约70%患儿需要肝移植[12],肝移植主要原因为:反复胆管炎发作,这与是否成功重建了胆汁流及肠道内容物返流关系密切,反复感染导致肝硬化加重或出现肝衰竭。葛西术后另一个肝移植的原因为反复门脉高压食管胃底静脉曲张破裂出血,这主要与葛西术时间有关,有研究表明葛西术时,桥接纤维化是预后良好的独立危险因素[26]。此外,肝纤维化分期、胆管板样结构、中-重度胆管损伤及缺失、葛西术时年龄、INR延长是预测是否需要肝移植的关键危险因素。
本研究对比了未行葛西术胆道闭锁患者及葛西术后BA患儿临床、影像及病理特点,结果与文献报道类似,通过对切除病肝的对比分析,进一步说明BA早期诊断的重要性、在未出现明显纤维化前行葛西术可能是该手术持续成功并避免后续肝移植的关键因素。