比卡鲁胺联合塞来昔布对前列腺癌细胞LNCaP增殖的影响
白晓黎,王 丽,谢秀娟,陈宏伟
(1.河南科技大学第一附属医院药品调剂科,洛阳 471003;2.郑州大学附属洛阳中心医院,洛阳 471000)
近年来,前列腺癌在全球的发病率和死亡率逐渐增加[1-2],其治疗面临极大的挑战[3-5]。比卡鲁胺是一种新型非甾体抗雄激素受体制剂,对前列腺癌细胞的增殖具有显著的抑制作用,已应用于临床[6-7]。塞来昔布是一种COX-2的抑制剂,在治疗前列腺炎及前列腺癌中具有较好的应用[8-10]。本研究拟培养前列腺癌LNCaP细胞,给予比卡鲁胺、塞来昔布及二者联合干预后,采用MTT法测定细胞生长的抑制情况,化学发光法检测细胞培养液中总前列腺特异抗原(PSA)的浓度,流式细胞仪检测各组细胞的凋亡率,Western Blot检测各组细胞Caspase 3和Caspase 8蛋白的表达情况。
1 仪器与材料
1.1仪器 流式细胞仪(美国BD公司);细胞培养箱(美国Thermo公司);电泳仪、电转移装置(美国BIO-RAD公司);酶标仪(美国BIOTEK公司);超声细胞破碎仪(宁波新芝公司)。
1.2材料 比卡鲁胺和塞来昔布(辉瑞制药公司,批号分别为H20100309和J20140072);胰蛋白酶、胎牛血清、F12培养基和Western Blot试剂盒(批号SC-1004,北京中杉生物公司);ECL试剂盒(Pierce公司,批号NCI4106);Annexin VFITC细胞凋亡检测试剂盒(碧云天生物技术研究所,批号C1062S);驴抗兔、Caspase 3和Caspase 8抗体(批号分别为ab13847和ab25901,Abcam公司)。TBST由实验室自制;前列腺癌细胞LNCaP(上海生命科学院细胞库,批号CRL-1740),培养于含90%的F12培养液、体积分数为10%胎牛血清、青霉素和链霉素各100 u·mL-1的培养基中,培养环境为37 ℃、体积分数为5%的CO2,常规培养。2 d换液1次,8 d用胰蛋白酶进行消化传代1次。
2 方法
2.1细胞MTT测试 MTT按照3×104个细胞·孔-1的规格接种至96孔板中,在37 ℃和体积分数为5%的CO2环境中培养。取处于生长对数期的细胞,分别加入50 μmol·L-1比卡鲁胺、40 μmol·L-1塞来昔布以及50 μmol·L-1比卡鲁胺联合40 μmol·L-1塞来昔布,对照组不加处理因素。作用于前列腺癌LNCaP细胞24,48 和72 h。终止培养4 h前加入质量浓度为5 g·L-1的MTT 10 μL,4 h后弃上清液,留下MTT结晶,用DMSO进行溶解,在波长为570 nm,参考波长为630 nm处,用Biotek EJ309酶标仪检测吸光度值A,每组重复3次取平均值,以空白组吸光度值A为0,计算生长抑制率。细胞生长抑制率=1-(实验组吸光度值A-对照组吸光度值A)×100%。
2.2细胞凋亡率的测定 依照2.1项下方法操作,作用于细胞48 h后,收集所有细胞,以1 000 r·min-1离心5 min,弃上清液,加入新鲜配制的PBS缓冲液(pH=7.4)3 mL,冲洗2次,离心5 min,弃上清液,将细胞重悬于Binding Buffer 200 μL,Annexin V-FITC 10 μL和PI 5 μL中,轻盈混匀,遮光反应15 min,加入Binding Buffer 300 μL,1 h内检测细胞凋亡率。
2.3Western Blot 依照2.1项下方法操作,作用于细胞48 h后,收集所有细胞,用PBS缓冲液洗涤,添加富含蛋白酶抑制剂和磷酸酶抑制剂的强效细胞裂解液,用超声细胞破碎仪破碎细胞,BCA法进行蛋白定量。SDS-聚丙烯酰胺凝胶电泳分离蛋白,随后电转至PVDF膜上,Caspase 3和Caspase 8抗体(均为1∶500)进行孵育,4 ℃放置24 h后用TBST洗涤3次,加入HRP标记的驴抗兔IgG(1∶500),ECL试剂盒曝光,系统ImageLab软件对条带进行灰度分析,并计算与内参蛋白β-actin的相对值。
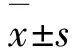
3 结果
3.14组不同时间点前列腺癌LNCaP细胞的生长抑制率 对照组的生长抑制率均为0,各给药组的生长抑制率结果见表1。进一步对组间细胞的生长抑制率进行比较,联合组显著优于比卡鲁胺组和塞来昔布组(P<0.05)。
表1 4组不同时间点前列腺癌LNCaP细胞的生长抑制率
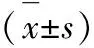
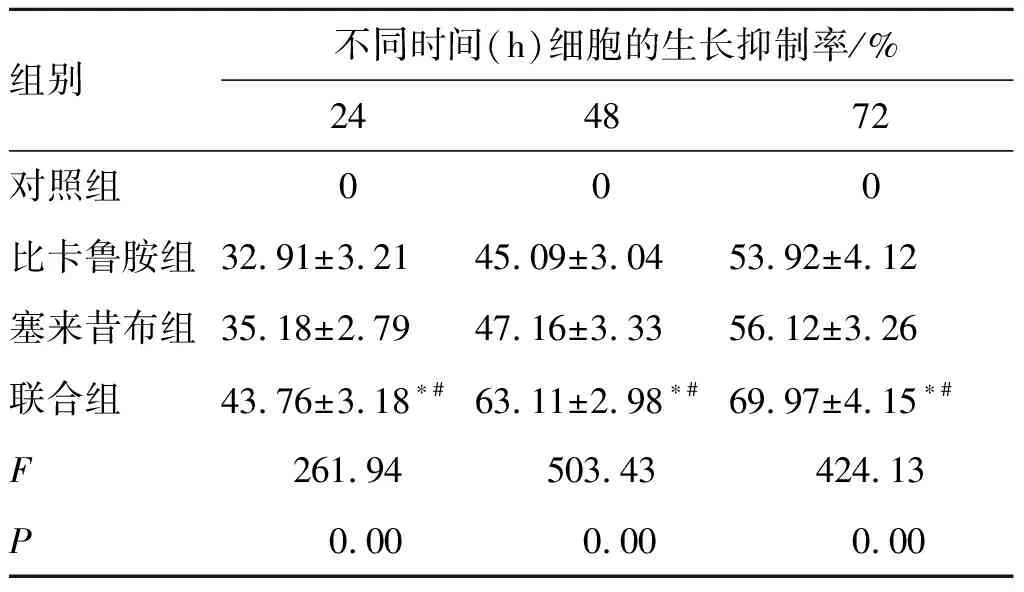
组别不同时间(h)细胞的生长抑制率/%244872对照组000比卡鲁胺组32.91±3.2145.09±3.0453.92±4.12塞来昔布组35.18±2.7947.16±3.3356.12±3.26联合组43.76±3.18∗#63.11±2.98∗#69.97±4.15∗#F261.94503.43424.13P0.000.000.00
注:与塞来昔布组比较*P<0.05;与比卡鲁胺组比较#P<0.05。
3.24组细胞培养液中总前列腺特异抗原(PSA)的变化 与对照组比较,比卡鲁胺组、塞来昔布组以及联合组的PSA浓度明显降低,其中联合组对PSA的抑制程度明显优于比卡鲁胺组和塞来昔布组(P<0.05)。见图1。
3.34组不同时间点前列腺癌LNCaP细胞的凋亡率比较 进一步对组间细胞的凋亡率进行比较,联合组显著优于比卡鲁胺组和塞来昔布组(P<0.05)。见表2。
3.44组细胞Caspase 3和Caspase 8蛋白的表达情况 与对照组相比,比卡鲁胺组、塞来昔布组和联合组Caspase 3和Caspase 8蛋白的表达水平均显著升高,联合组Caspase 3和Caspase 8蛋白的表达水平明显高于比卡鲁胺组和塞来昔布组(P<0.05)。见图2。
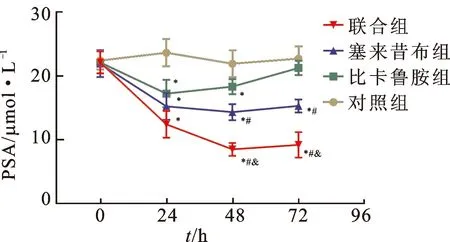
图1 4组细胞培养液中总前列腺特异抗原的变化
注:与对照组比较*P<0.05;与比卡鲁胺组比较#P<0.05;与塞来昔布组比较&P<0.05。
Fig.1 Changes of total prostate specific antigen in 4 groups of cell culture fluids
Note:*P<0.05 vs control group;#P<0.05 vs bicalutamide group;&P<0.05 vs celecoxib group.
表2 4组不同时间点前列腺癌LNCaP细胞的凋亡率
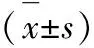
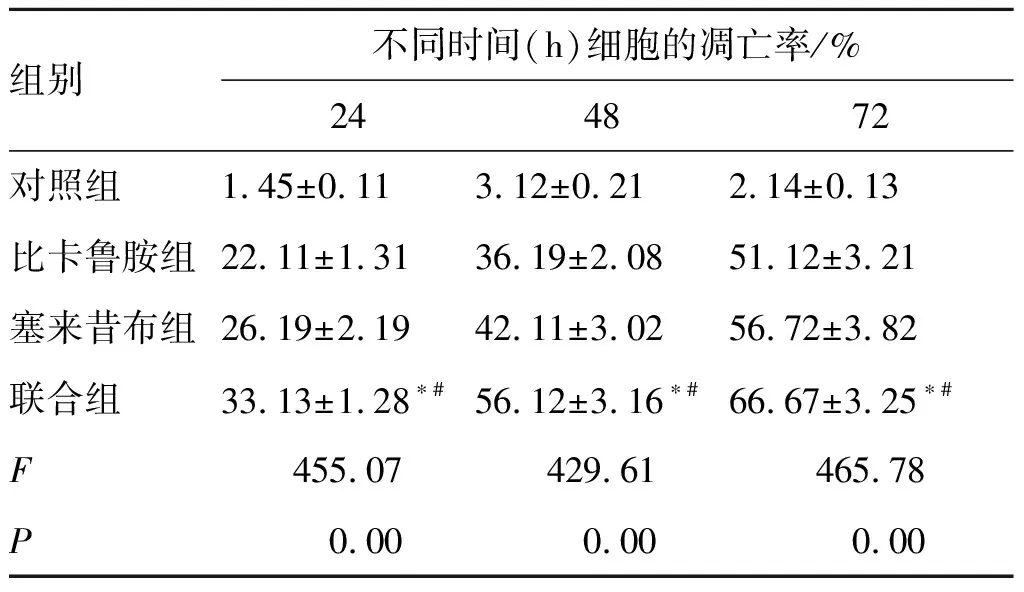
组别不同时间(h)细胞的凋亡率/%244872对照组1.45±0.113.12±0.212.14±0.13比卡鲁胺组22.11±1.3136.19±2.0851.12±3.21塞来昔布组26.19±2.1942.11±3.0256.72±3.82联合组33.13±1.28∗#56.12±3.16∗#66.67±3.25∗#F455.07429.61465.78P0.000.000.00
注:与塞来昔布组比较*P<0.05;与比卡鲁胺组比较#P<0.05。

图2 4组细胞Caspase 3和Caspase 8蛋白的表达情况
注:与对照组比较*P<0.05;与比卡鲁胺组比较#P<0.05;与塞来昔布组比较&P<0.05。
Fig.2 Expression of Caspase 3 and Caspase 8 proteins in 4 groups of cells
Note:*P<0.05 vs control group;#P<0.05 vs bicalutamide group;&P<0.05 vs celecoxib group.
4 讨论
比卡鲁胺对前列腺癌细胞LNCaP具有显著的生长抑制作用[11-12]。研究表明,比卡鲁胺联合塞来昔布存在协同作用,可抑制LNCaP细胞的增殖,诱导凋亡;其作用可能通过Caspase 3介导[13]。在体外培养条件下,睾酮对LNCaP-FCG细胞的生长依浓度关系呈双向作用,比卡鲁胺依浓度关系抑制LNCaP-FCG细胞的生长[11]。塞来昔布可通过调控凋亡蛋白的表达抑制肿瘤细胞的增殖[14-15]。研究表明,塞来昔布作为选择性COX-2抑制剂可诱导激素非依赖性前列腺癌DU-145细胞凋亡,并首次对肿瘤的侵袭能力进一步探讨,证实塞来昔布通过降低肿瘤细胞侵袭能力从而增加其抗肿瘤的作用[16-17]。研究显示,对照组在24,48和72 h的细胞生长抑制率均为0。与对照组相比,比卡鲁胺组、塞来昔布组和联合组在24,48和72 h的生长抑制率明显较高。进一步对组间细胞的生长抑制率进行比较,联合组显著优于比卡鲁胺组和塞来昔布组,这与既往研究报道较为一致[11,18-19]。化学发光法检测显示,与对照组相比,比卡鲁胺组、塞来昔布组以及联合组的PSA浓度明显降低,其中联合组对PSA的抑制程度明显优于比卡鲁胺组和塞来昔布组。PSA作为诊断及治疗前列腺癌的敏感性指标,在联合组中的表达得到有效的抑制,提示联合比卡鲁胺与塞来昔布可有效抑制肿瘤细胞的活性,这与既往研究较为一致[20-21]。流式细胞仪检测结果显示,对照组在24,48和72 h的细胞凋亡率均低于比卡鲁胺组、塞来昔布组和联合组在24,48和72 h的生长抑制率。进一步对组间细胞的生长抑制率进行比较,联合组显著优于比卡鲁胺组和塞来昔布组,符合预期。Western Blot结果提示,与对照组相比,给药组Caspase 3和Caspase 8蛋白的表达水平均显著升高,联合组Caspase 3和Caspase 8蛋白表达水平明显高于比卡鲁胺组和塞来昔布组。提示比卡鲁胺联合塞来昔布抑制前列腺癌细胞的生长抑制率以及促进肿瘤细胞凋亡的机制可能与促进细胞内Caspase 3和Caspase 8蛋白的表达有关,这与本实验预期结果较为一致。
综上所述,比卡鲁胺联合塞来昔布能有效抑制前列腺癌细胞LNCaP的增殖,其机制可能与促进凋亡相关蛋白Caspase 3和Caspase 8进而促进肿瘤细胞的凋亡有关,有望为临床治疗前列腺癌带来新思路。

