连续性血液透析滤过联合血液灌流在脓毒症合并急性肾损伤患者中的应用研究
郝 鹏,梁彦平,李晓峰,李 旭,何 清
脓毒症是指机体对感染反应失调所引起的器官功能障碍,严重者可危及生命。该病具有发病率和病死率高等特点[1]。如何降低脓毒症患者的病死率仍是重症医学领域的一大难题。血液净化是脓毒症的治疗手段之一,目前治疗脓毒症的连续性血液透析滤过(continuous venovenous hemodiafiltration,CVVHDF)治疗时间通常超过24 h,甚至达到96 h 以上[2],此方法在为患者提供持续的肾脏支持治疗同时还会相应增加清除一些营养物质(如氨基酸、维生素、磷等)、药物(如抗菌药物等)。另外,在治疗过程中还需要持续抗凝,增加患者出血风险。血液灌流(hemoperfusion,HP)是另一种血液净化方式,根据其所用不同材质灌流器可对不同物质起到吸附作用(如毒物、自身抗体、炎性因子等)。有研究显示,HP 可降低脓毒症患者体内炎性因子水平并降低脓毒症患者的病死率[1]。但HP无调节酸碱平衡紊乱、电解质紊乱及清除水负荷等肾脏替代治疗可达到的作用,对于合并严重急性肾损伤(acute kidney injury,AKI)的脓毒症患者可能效果不佳。鉴于二者在治疗脓毒症方面存在的优缺点,本研究将HP 联合CVVHDF 治疗脓毒症患者,监测多项炎性指标和器官功能指标变化,评估二者清除炎性介质和保护器官功能的作用,为临床治疗AKI 提供治疗依据,现报道如下。
1 对象与方法
1.1 研究对象 选取2015-10 至2017-09 在石河子人民医院肾病内科、呼吸内科、急诊普外科、急诊烧伤科、急诊重症监护室、综合重症医学科收住的116 例脓毒症患者,排除患有严重免疫障碍疾病患者3 例,入院后未完成血液净化治疗的死亡患者5 例,符合纳入标准的脓毒症患者共108 例,平均年龄为(63.11±13.16)岁,男性55 例(50.9%),女性53 例(49.1%)。
原发病来源于有肺部感染的脓毒症患者66 例、泌尿系感染者19 例、腹腔感染者16 例、其他感染7 例。本研究取得了石河子大学人民医院医学伦理委员会批准,符合医学伦理学标准,所有治疗及检查均取得了患者或家属的知情同意。
1.2 纳入与排除标准 纳入标准:(1)年龄≥18 岁;(2)确诊为脓毒症患者(诊断标准参照第三版脓毒症与感染性休克定义国际共识)[3];(3)急性生理功能和慢性健康状况Ⅱ评分系统(acute physiology and chronic health evalution Ⅱ,APACHE Ⅱ)评分≥15 分;(4)AKI ≥2 期;(5)无血液净化治疗的绝对禁忌;(6)取得患者或家属知情同意者。排除标准:(1)严重的高钾血症、代谢性酸中毒、肺水肿者;(2)有恶性肿瘤,肾移植,维持性血液透析患者;(3)孕妇;(4)长期使用免疫抑制剂或免疫功能缺陷性疾病者;(5)有明显的出血倾向或活动出血者;(6)拒绝签署相关知情同意者。
1.3 方法
1.3.1 对照组 按《脓毒性休克治疗指南(2014)》[4],在血液净化治疗的基础上给予对照组患者常规治疗,包括液体复苏、治疗感染、碳酸氢钠、血制品、缩血管药物、正性肌力药物、β 受体阻滞剂、镇静和肌松、预防深静脉血栓、营养支持、预防应激性溃疡、机械通气等。根据患者病情选择相应治疗。当对照组患者在出现以下急诊指征之一时给予肾脏替代治疗:血钾>6.5 mmol/L 并有相应的心电图改变、代谢性酸中毒pH <7.15、急性肺水肿经利尿剂治疗无效、尿素氮超过40 mmol/L。
1.3.2 观察组 在对照组治疗的基础上,联合CVVHDF+HP 治疗。方法:建立血管通路(股静脉或颈内静脉),采用CVVHDF 联合HP 模式治疗。使用AsahiKASEI PLASAUTOΣ 连续性血液净化装置,REXEEDTM-18AC滤器(聚砜膜,膜面积1.8 m2),灌流器采用佛山市博新生物科技有限公司生产的MG350。采用低分子肝素抗凝,血流量150~250 ml/min、置换液流量25 ml/(kg·h)、前稀释法,透析液与置换液采用相同剂量及相同配方,基础配方为0.9%氯化钠注射液2 000 ml、5%碳酸氢钠注射液125 ml、注射用水500 ml、50%葡萄糖注射液10 ml、25%硫酸镁注射液2 ml、10%葡萄糖酸钙注射液24 ml、10%氯化钾注射液8 ml(相应离子浓度为K+4 mmol/L、Na+143 mmol/L、Cl-115 mmol/L、Ca2+1.92 mmol/L、Mg2+0.76 mmol/L、碳酸氢根子27.9 mmol/L、葡萄糖9.5 mmol/L),根据患者血气分析、血糖、电解质指标对配方做适当调整,治疗过程中每2 h 复查上述指标,根据复查结果调整配方,单次治疗时间8 h、超滤量根据患者病情。首先给予CVVHDF 联合HP 治疗2 h,而后去除灌流器,继续行CVVHDF 治疗6 h。每天治疗1 次,当患者24 h 自然尿量(不使用利尿剂)超过1 000 ml 时,停止肾脏替代治疗。
1.4 观察指标 主要指标为入组后28 d 内病死率。次要指标包括:(1)患者入院治疗前及治疗后24 h、48 h 炎性因子水平,即使用促凝管在无菌操作下,各抽取静脉血约5 ml,在静置2 h 后离心机4 500 转下离心5 min,取上层血清2 ml 用移液枪放入标记有编号的EP 管中;最后放入-80℃冰箱冻存待测。化学发光法试剂盒:西门子医学诊断产品(上海)有限公司。主要仪器:IMMULITE/IMMULITE 1000 化学发光免疫分析仪。(2)患者治疗前及治疗后24 h、48 h 的APACHE Ⅱ评分情况。(3)患者的整体住院天数及ICU 住院天数。
1.5 统计学处理 应用SPSS 19.0 软件进行分析;计量资料中符合正态分布的以描述,两组间比较方差齐的采用独立样本t 检验;两组治疗48 h 前后感染及炎性指标、APACHE Ⅱ评分比较采用重复测量的方差分析;计数资料用频数与百分数描述,两组间比较采用Pearson χ2检验;以P<0.05 为差异有统计学意义。Kaplan-Meier 法绘制生存曲线,应用Log-rank 检验组间差异。
2 结 果
2.1 一般资料 两组患者一般资料比较,差异无统计学意义(P>0.05,表1)。
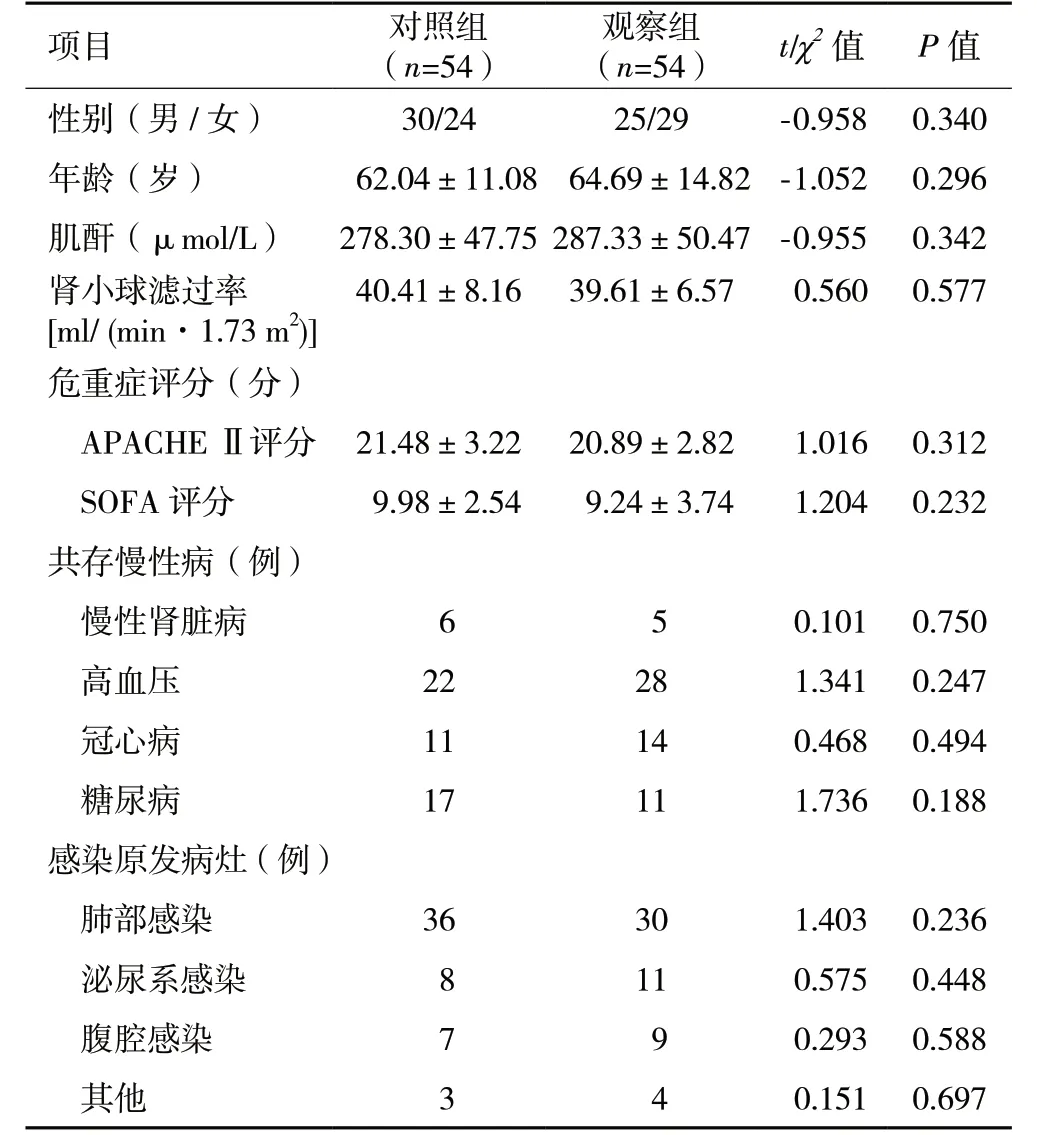
表1 两组脓毒症患者一般资料比较
2.2 两组患者治疗24 h、48 h 前后血清IL-1、IL-10 水平、APACHE Ⅱ评分 经Mauchly 球形度检验结果显示,P 值均<0.05,不符合球形度。因此采用Greenhouse-Geisser 检验对组间及分组与时点的交互效应进行检验。结果显示:(1)血清IL-1 水平与APACHE Ⅱ评分下降明显,时间与分组间存在交互效应,且组间差异具有统计学意义。(IL-1,P<0.05;APACHE Ⅱ,P<0.05)。(2)血清IL-10 水平下降不明显,时间与分组间不存在交互效应,且组间差异不具有统计学意义(IL-10,P>0.05)。见表2。
2.3 ICU 住院天数比较 观察组ICU 住院天数和总住院天数低于对照组,差异有统计学意义(P<0.05,表3)。
2.4 随访 观察组与对照组均在入组28 d 内完成随访,观察组死亡16 例(29.6%),对照组死亡21 例(38.9%),同时记录两组死亡患者的生存天数。应用Kaplan-Meier 生存曲线及Log-rank 检验显示两组28 d生存时间差异无统计学意义(χ2=1.013,P=0.310)。见图1。
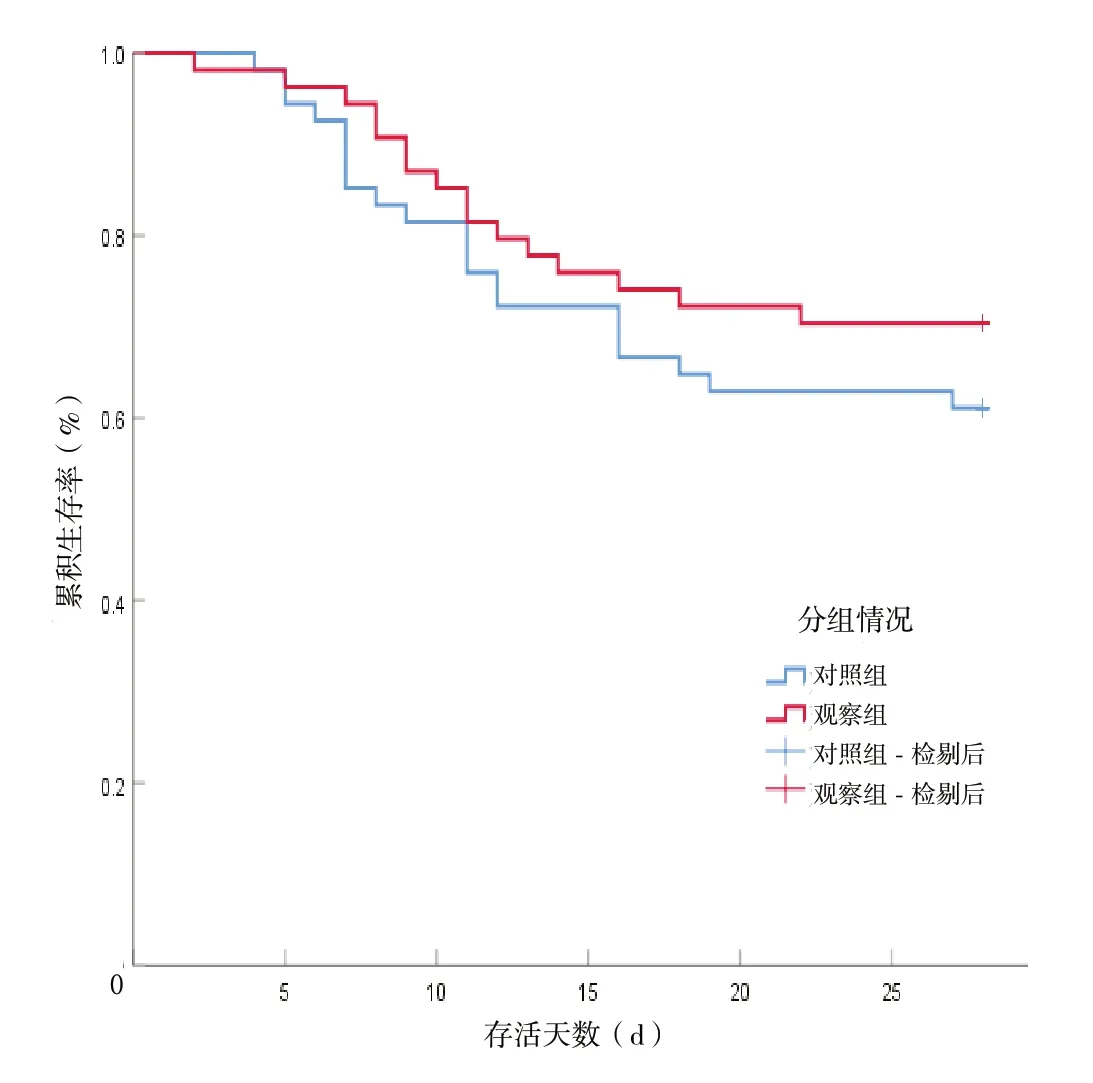
图1 两组患者28 d 累积生存率的Kaplan-Meier 生存曲线
表2 两组脓毒症患者治疗前后炎性因子IL-1、IL-10 及APACHE Ⅱ评分

表2 两组脓毒症患者治疗前后炎性因子IL-1、IL-10 及APACHE Ⅱ评分
注:APACHE Ⅱ,急性生理功能和慢性健康状况Ⅱ评分系统;IL-1,白细胞介素-1;IL-10,白细胞介素-10
项目 对照组(n=54) 观察组(n=54)治疗前 治疗后24 h 治疗后48 h 治疗前 治疗后24 h 治疗后48 h IL-1(pg/ml) 18.58±3.22 17.98±3.29 17.28±3.43 18.26±2.23 16.67±2.40 15.80±2.37 IL-10(pg/ml) 68.66±50.32 59.70±39.17 54.92±33.27 69.40±58.33 64.31±54.71 63.43±60.77 APACHE Ⅱ评分 21.48±3.23 19.83±4.65 16.93±5.90 20.89±2.82 14.52±7.15 13.44±7.43
表3 两组脓毒症患者住院期间其他情况比较
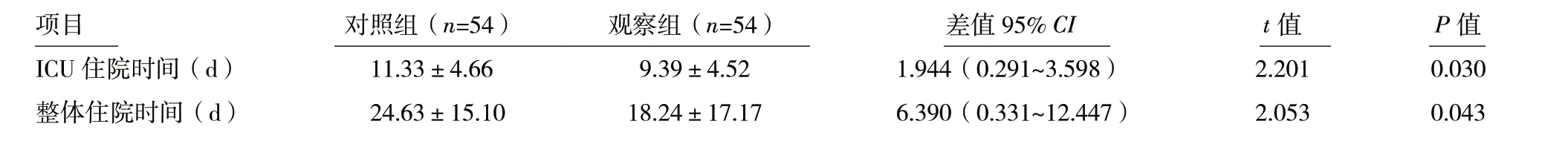
表3 两组脓毒症患者住院期间其他情况比较
项目 对照组(n=54) 观察组(n=54) 差值95% CI t 值 P 值ICU 住院时间(d) 11.33±4.66 9.39±4.52 1.944(0.291~3.598) 2.201 0.030整体住院时间(d) 24.63±15.10 18.24±17.17 6.390(0.331~12.447) 2.053 0.043
3 讨 论
脓毒症具有发病率及病死率高的特点,美国脓毒症的病死率仍在30%以上[5],我国形势更为严峻,过去的10 年间脓毒症发病率持续上升,主要源于整体人群的老龄化、有创操作的增加及非感染性疾病治疗的飞速发展,如风湿免疫学的迅猛发展,免疫抑制治疗日趋普遍,肿瘤化疗、器官移植后免疫抑制剂的使用都使机体感染风险增加,尽管近些年来内科常规治疗手段层出不穷,但脓毒症整体病死率仍居高不下。据我国西部地区统计脓毒症的病死率在45%以上[6],且多数的脓毒症外科无法干预,如何降低脓毒症患者的病死率成为重症医学领域的一个难题。AKI 是脓毒症的常见并发症,AKI 增加了脓毒症的死亡风险。严重的AKI 常常需要肾脏替代治疗[7]。目前肾脏替代治疗的介入时机、模式选择、持续时间等具体方案学术领域仍争议不断,本研究从血液净化治疗与脓毒症患者的血浆炎症因子及各项临床结果展开了讨论。
众所周知,曾经脓毒症一直被定义为是感染导致的过度炎症反应,机体促炎反应与抗炎反应的严重失衡[8]。现虽将定义改为机体对感染反应失调所致的危及生命的器官功能障碍[3],但炎性介质的失衡在脓毒症的发生发展过程中依旧起着关键作用。本研究也将炎性因子水平列为本研究的重点指标,动态观察血液净化前后各炎性因子水平的变化,广泛阅读国内外文献,选取学术上对评估脓毒症的严重程度及预后广泛共识的炎性因子进行研究。有研究证明,脓毒症患者与正常人比较炎性因子IL-1 等严重失衡、免疫功能紊乱[4]。促炎因子水平越高,患者死亡风险越高,抑炎因子则相反。本研究立足以上学术共识的观点,把这些因子从血液中清除出去不失为可行的治疗措施[9]。虽然常规的血液净化模式可以清除过度表达的炎症因子,但持续性受到透析膜快速饱和的限制,半透膜的吸附作用在2~4 h 即饱和,透析膜达到饱和后清除炎性因子的作用大打折扣[10-12]。HP 是另一种血液净化方式,根据其所用灌流器材质的不同可发挥对不同物质的吸附作用(如毒物、自身抗体、炎性因子等)。本研究采用短时间的CVVHDF 联合HP 治疗脓毒症。这种组合治疗模式,既保留了肾脏替代作用,又发挥了血液滤过及HP 协同清除炎性因子的作用;本研究也证实了通过CVVHDF 与HP 的组合对过度表达的IL-1清除显著,IL-1 为炎性反应综合的始发因子,通过对促炎性因子IL-1 的清除,阻碍了下级炎性因子的集连、放大,可明显阻断或延缓SIRS 的激活与瀑布学说的发展,患者各项急慢性生理指标明显好转,所以APACHE Ⅱ评分亦有显著降低。多项研究表明,抗炎因子IL-10 与脓毒症患者病死率成反比,因本研究照其他研究对IL-10 水平的追踪时间较短,仅记录治疗48 h 前后IL-10 水平,期间并未见IL-10 水平显著升高[13-16]。考虑由于初期血液净化各膜器孔径的非选择性与IL-10 分子直径造成,IL-10 水平有所降低,但降低幅度不大,差异无统计学意义。生理情况下促炎因子与抑炎因子相互抑制,此消彼长。根据血液净化去峰值学说,过度表达的促炎因子被清除的更为显著,随着促炎因子对IL-10 等抑炎因子的抑制解除,3 d 左右时间后抑炎因子逐渐升高,可逐渐回归到稳态[17,18]。本研究没有得到IL-10 升高的结果,考虑是因为对其检测时间短造成,期望未来可做进一步研究证实本观点。
AKI 患者何时启动肾脏代替治疗始终没有定论,如2016 年Gaudry 等[10]的一项多中心随机对照试验研究中应用肾脏代替治疗脓毒症,共收集确诊脓毒症合并AKI3 期患者619 例,虽早期组病死率较延迟组病死率低,但不具有统计学意义。Zarbock 等[11]的另一项高质量研究做了一个与Gaudry 相类似的研究,血液净化可以降低脓毒症患者病死率,差异具有统计学意义(P=0.03);血液净化治疗AKI 患者何时启动及预后受多种因素影响,如不同疾病引起的AKI 最终结局可能不一样,即便都是由脓毒症引起的AKI,但有外科干预方法的如化脓梗阻性胆管炎与无法外科干预如重症肺炎引起的脓毒症结局都可能存在差异,更何况结局还受到血液净化模式,随访时间等的影响。本研究虽未发现CVVHDF 联合HP 对脓毒症合并AKI 患者病死有任何影响,但从降低住院时间角度,将脓毒症合并AKI 2 期纳入肾脏代替治疗也不失为明智的选择。
综上所述,HP 没有调节酸碱平衡紊乱、电解质紊乱及清除水负荷等肾脏替代治疗的作用,而单纯连续性肾脏代替治疗耗时过久等特点,将两者优点有机结合起来,也达到了预想的目的。本研究使用短时间的CVVHDF 联合HP 治疗脓毒症的肾脏替代治疗模式,既保留了肾脏替代作用,又发挥了血液滤过及HP协同清除炎性因子的作用,加强了炎性因子的清除效率,能较好改善脓毒症患者的病情。同时对脓毒症患者ICU 住院时间及整体住院时间均存在正向意义,但由于本研究样本例数尚少,研究人群较窄,存在一定的局限性,并未改善脓毒症患者28 d 病死率,尚需进一步的大样本研究,从而为脓毒症的预防与治疗提供新思路与新手段。

