磁共振功能成像在脑胶质瘤诊断中的应用价值*
柴茂林,马党捐
1.陕西省第二人民医院放射科(西安 710005);2.陕西省第二人民医院影像科(西安 710005)
脑胶质瘤是神经外胚叶衍化出的胶质细胞恶性病变引发的颅内肿瘤。流行病学调查显示,脑胶质瘤发病率约占颅内肿瘤1半左右,且其死亡率位于34岁以下肿瘤人群第2位,位居35~54岁肿瘤人群第3位[1-2]。目前临床治疗脑胶质瘤的主要手段为手术及术后放化疗。通常因脑胶质瘤浸润性和异质性生长等特点存在,导致其病理分级和真实级别间出现一定偏差,进而影响到患者术后康复治疗方案选择及预后[3]。因此,准确判断脑胶质瘤病理级别及侵袭生长程度等对治疗方案制定具有重大意义。磁共振功能成像检查因组织分辨率,可多序列和多参数成像而成为脑胶质瘤初步筛查诊断的首选方法[4-5]。灌注加权成像(Perfusion weighted imaging,PWI)可从组织血流灌注水平及血管化程度,反应器官组织的血流动力学信息[6];扩散张量纤维束成像(Diffusion tensor tractography,DTT)是唯一可活体重建脑白质纤维束走向和空间分布的无创成像技术[7];氢质子共振波谱(Hydrogen proton resonance spectrum,1H-MRS)分析是唯一可无创观察活体组织代谢和生化变化的共振技术[8]。三种磁共振功能成像技术各有优势。为更准确的判断脑胶质瘤病理分级,本研究回顾性分析了PWI、DTT、1H-HES技术在脑胶质瘤分级诊断中的应用效果。现报告如下。
资料和方法
1 一般资料 收集2015年6月至2017年12月经手术病理学检查证实为脑胶质瘤的48例患者临床资料。依据中枢神经系统肿瘤分类标准分级,其中Ⅰ、Ⅱ级,即低级别胶质瘤患者20例,男13例,女7例,年龄22~72岁,平均(56.85±7.12)岁;Ⅲ、Ⅳ级,即高级别胶质瘤28例,男17例,女11例,年龄20~75岁,平均(56.41±7.26)岁。患者术前均行PWI、DTT、1H-MRS扫描检查。
2 检查方法 采用GE3.0T超导型磁共振仪进行检查,患者均行常规磁共振平扫、PWI、DTT、1H-HES扫描。①常规平扫:T1加权成像(T1WI)、T2WI、T1WI矢状位、T2flair轴位。②PWI扫描:TE 40 ms,TR 1500 ms,翻转角30°,视野(FOV)24 cm×24 cm,矩阵128×128,每位患者扫描30个层,40个时相,产生480图像,成像时间共68 s,层间距1.0 mm,层厚4.0 mm。扫描前实施自动匀场,待扫描至第5个时相时,采用磁共振仪配套高压注射器向肘前静脉注射外源性对比剂钆喷替酸葡甲胺(Gd-DTPA)剂,剂量设定为0.1 mmol/kg,速率为3.5 ml/s,注射时间<5s,之后注射等量生理盐水进行冲洗。③DTI选在25个方向进行扩散梯度的方式进行扫描,TR设定为4600 ms,b值为1000,TE则默认为最小值,层厚为4.0 mm,时间设定为2 min 4 s,视野为240 mm。④1H-MRS选择点分辨波谱技术进行扫描,TE 144.0 ms,TR 1000 ms,扫描时间为5 min 28 s。MRS在平扫轴位T2WI或增强后轴位T1病灶最大实性层面进行定位,定位范围为肿瘤实性和边缘区、健侧脑组织。
3 图像分析和数据处理 PWI经配套的神经灌注软件对灌注原始途径实施后处理,获得患者脑血容量(CBV)的伪彩图像,选择CBV灌注最大层面,分别于瘤体的最大灌注区域、周围水肿区域及对侧的正常脑白质区域挑选4个兴趣区域(ROI,面积约80~100 mm2) 对各区域CBV、脑血流量(CBF)进行计算,并取其平均值;选择健侧脑白质区域CBV、CBF作为参照值,计算瘤体实质区及周围水肿区的相对CBV值(rCBV)、相对CBF(rCBF);1H-MRS结果经后处理得到患者代谢物和解剖图的叠加图像、代谢物的分布图及比率图,主要观察代谢物质为乙酰天门冬氨酸(NAA)、总胆固醇(Cho)、肌酐(Cr)、脂质(Lip)、肌醇(MI)、乳酸(Lac),计算Cho/Cr、Cho/NAA、NAA/Cr;DTI图像经重建DTT图,观测患者术前白质纤维束破坏及移位情况,计算各向异性分数(FA)及相对FA(rFA)。
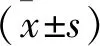
结 果
1 PWI及DTT所得瘤实质区、周围水肿区及健侧白质区CBV、CBF、FA值对比 见表1。胶质瘤不同区域CBV、CBF、FA值间差异具有统计学意义(P<0.05),瘤实质区、瘤周围水肿区CBV、CBF值显著高于健侧白质区,FA值则显著低于健侧白质区;瘤实质区CBV、CBF值显著高于瘤周围水肿区,FA值则显著低于瘤周围水肿区。

表1 PWI及DTT所得瘤实质区、周围水肿区及对健侧白质区CBV、CBF、FA值对比
注:与健侧白质区比较,*P<0.05;与瘤周围水肿区比较,#P<0.05
2 PWI及DTT所得高低级别瘤实质区和周围水肿区rCBV、rCBF、rFA值对比值对比 见表2。高级别瘤实质区和周围水肿区rCBV、rCBF值均显著高于低级别,差异均存在统计学意义(P<0.05);rFA值在高低级别间差异无统计学意义(P>0.05)。
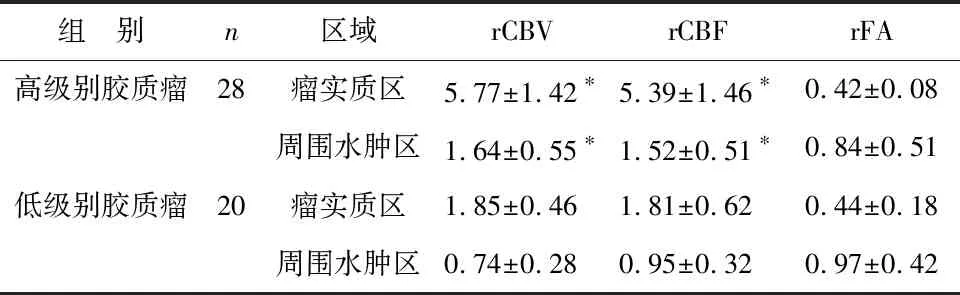
表2 PWI及DTT所得高低级别瘤实质区和周围水肿区rCBV、rCBF、rFA值对比值对比
注:与低级别比较,*P<0.05
31H-MRS所得高低级别患侧和健侧代谢指标值对比 见表3。高低级别健侧代谢指标Cho/Cr、Cho/NAA、NAA/Cr值间差异无统计学意义(P>0.05)。高低级别患侧Cho/Cr、Cho/NAA值均显著高于健侧,NAA/Cr值显著低于健侧,且高级别患侧Cho/Cr、Cho/NAA显著高于低级别,NAA/Cr值显著低于低级别(P<0.05)。
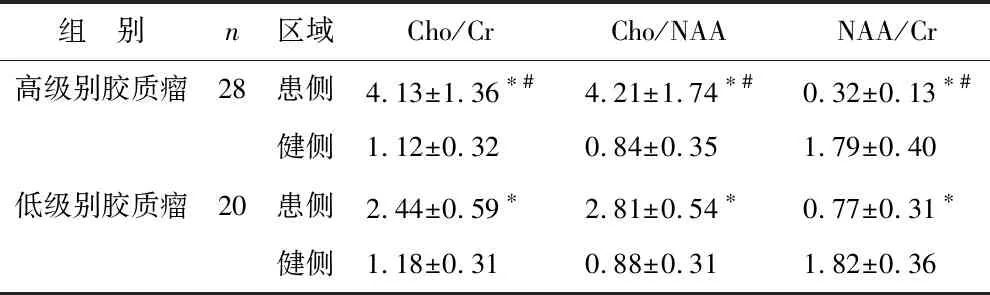
表3 1H-MRS所得高低级别患侧和健侧代谢指标值对比
注:与同级别健侧比较,*P<0.05;与低级别患侧比,#P<0.05
4 高低级别胶质瘤成像特点 常规磁共振和PWI检查:28例高级别患者瘤实质区内灌注不均,且以高灌注为主,高灌注区分布于瘤实质区或周边,而在强化留周围水肿区域亦可见稍高或等灌注区,5例等灌注,1例低灌注;20例低级别患者以低灌注为主,其中2例表现为高灌注,1例等灌注;诊断正确率为87.50%(42/48)。MRS扫描:28例高级别患者中25例瘤实质区NAA、Cr显著下降,Cho、MI显著升高,5例见Lac峰,3例见Lip峰,3例Lac峰和Lip峰同见,2例因多种原因被误判为低级别患者;20例低级别中17例瘤实质区NAA、 Cr值出现不同程度下降、Cho升高,但变化均不如高级别明显,3例被误诊为高级别胶质瘤;诊断正确率为89.58%(43/48)。DTT扫描:28例高级别患者中24例瘤体区白质纤维束出现不同程度中断破坏并伴有局部移位现象;其余则以移位推挤为主,并伴有局部变细,纤维束完整性相对较好,术前均被误判为低级别胶质瘤;20例低级别15例瘤体区白质纤维束仅出现移位推挤,并伴局部稀疏变细,纤维束完整性相对较好,其余5例除存在上述现象外,局部伴发破坏中断,因此被误诊为高级别患者;诊断正确率为81.25%(39/48)。术前依据PWI、DTT、1H-MRS扫描结果,综合分析瘤体血流灌注水平、白质纤维束完整性和形态变化、组织代谢及生化变化,48例胶质瘤患者诊断为高级别者26例、低级别22例,与术后病理学检查符合率者45例,诊断正确率为93.85%,高于单一扫描诊断。
讨 论
常规磁共振扫描可显示瘤体部位和大致范围,但因胶质瘤内部成分具有多样性,且钆剂具有非特异性,导致扫描诊断中高低级别瘤体强化不一致;而病理学诊断方法则为有创性操作,且难以在脑组织功能区域进行操作,穿刺活检结果取决于材料部位和样本量,因而很难反映整个瘤体情况。磁共振功能成像可弥补常规磁共振扫描和病理组织诊断之不足,然不同技术间亦存在不同优劣势。
PWI成像技术主要显示组织胃管血流动力学信息,通过反映活体组织微血管密度、分布及血流灌注情况为临床判断提供依据。胶质瘤病变程度越高,血管生成密度越高[9],CBV、CBF伪彩图正好反应胶质瘤血容量和血流量,但因脑组织中毛细血管网较丰富且复杂,导致ROI部分对比出现再循环,为获得更有效的血流动力学参数,本研究选择rCBV、rCBF。周丽等[10]研究结果表明,高级别脑胶质瘤rCBV显著高于低级别,瘤实质区显著高于周围水肿区。陈杰云等[11]研究发现,PWI可显示瘤实质区、周区血流灌注特点和瘤实质区血脑屏障破坏程度。本研究结果显示,胶质瘤不同区域CBV、CBF值间差异具有统计学意义,瘤实质区、瘤周围水肿区CBV、CBF值显著高于健侧白质区;瘤实质区CBV、CBF值显著高于瘤周围水肿区;高级别瘤实质区和周围水肿区rCBV、rCBF值均显著高于低级别。提示,PWI可用于脑胶质瘤浸润程度及高低级别的诊断评估,该结果与江晶晶等[12]和周丽等[10]人结果相吻合。DTI扫描成像可反映病变区域白质内水分子扩散的优势方向。FA属于该功能成像技术的常用量化指标之一,常用于评价病变区白质各向异性改变。正常情况下,脑神经纤维中的水分子布朗运动呈有序的方向性。当肿瘤发生时,肿瘤细胞异常增殖使得其内部结构发生紊乱,细胞密度、大小和分布等出现改变,水分子扩散亦变得杂乱无章,进而导致FA值下降[13]。本研究结果显示,虽瘤实质区、周围水肿区及健侧白质区FA值差异具有统计学意义,但不同级别胶质瘤FA值间差异无统计学意义。提示,DTI扫描可用于脑胶质瘤周围水肿组织是否发生肿瘤细胞侵袭及浸润,但不能用于胶质瘤分级判断,该结果与江晶晶等[12]人相一致。MRS是通过磁共振化学位移成像获得局部组织某些代谢产物波谱信息,并对其进行定量分析,从而从分子水平反应局部组织病理生理及代谢变化。NAA峰是正常脑组织内第1大峰,峰值位于2.0 ppm处,其含量与神经元功能及完整性密切相关,其峰值下降提示神经元数量减少或功能遭破坏;其峰值回升提示神经元活动增强;Cho峰值位于3.2 ppm处,胆碱不仅是细胞生物膜主要构成成分,也是细胞代谢、髓鞘形成和胶质增生的重要指标,病理条件下,神经髓鞘、细胞生物膜及神经脂崩解,细胞增殖等均会导致Cho峰值增加;Cr峰值位于3.0 ppm处,其主要存在于神经元及胶质细胞中,参与机体能量代谢,通常同一个体Cr总量是恒定的,其波峰较稳定,因此在某些疾病发展过程中将其作为参照指标,诸如Cho/Cr可作为判断髓鞘完整性和神经元功能的良好指标。李莹等[14]研究显示,高低度恶性骨肉瘤Cho/Cr值间差异存在统计学意义,提示,1H-MRS可用于评价骨肉瘤恶性程度。Cho/NAA 升高预示瘤体周围水肿区出现肿瘤细胞浸润;其在肿瘤和非肿瘤组织诊断中的敏感性可高达90%。Lip峰出现则预示肿瘤组织部位发生凝固性坏死,为恶性肿瘤之特征性代谢物。本研究显示,高低级别患侧Cho/Cr、Cho/NAA值均显著高于健侧,NAA/Cr值显著低于健侧,且高级别患侧Cho/Cr、Cho/NAA显著高于低级别,NAA/Cr值显著低于低级别。表明,1H-MRS可作为诊断脑胶质瘤细胞浸润程度及胶质瘤高低级别的良好手段。该结果与张玉琴等[15]研究结果相一致。
综上所述,PWI、DTI、1H-MRS在脑胶质瘤诊断中各有优势,术前联合应用三种磁共振功能成像技术可更准确的判断胶质瘤级别。

