ST段抬高型急性心肌梗死早期脑钠肽水平变化及各个时间点检测对心力衰竭的诊断价值
龙继贤,高文妹
上海市徐汇区大华医院急诊医学科(上海200237)
急性心肌梗死(Acute myocardial infarction, AMI)是临床常见的心血管疾病,主要是由于冠状动脉血管痉挛或不稳定斑块破裂,导致血栓形成,引起冠状动脉狭窄、心肌缺血缺氧所致。根据心电图显示的心肌缺血特征,常将AMI分为ST段抬高型急性心肌梗死(ST-segment elevation acute myocardial infarction, STEMI)和非ST段抬高型急性心肌梗死(Non-ST-segment elevation acute myocardial infarction, NSTEMI),且STEMI患者较为常见。STEMI常合并心力衰竭的发生,严重影响患者生活质量,威胁患者生命安全[1]。目前研究显示[2],心肌缺氧超过20 min时,部分心肌会发生不可逆性坏死。因此如何尽早诊断心肌梗死,挽救受损的心肌细胞是关键。近年来随着对STEMI的不断研究,人们发现坏死的心肌细胞会释放大量肌酸激酶、肌红蛋白等进入血液,导致血液中肌酸激酶、肌红蛋白等明显升高,成为临床常用的心肌坏死标志物[3]。但目前临床常用的心肌坏死标志物灵敏度较低,常在发生心肌坏死后较长时间才能测出,诊断价值有限[4]。脑钠肽(Brain natriuretic peptide, BNP)是近年来研究的热点,其在STEMI患者心肌坏死的诊断中具有较高灵敏度和特异度。因此多数学者认为BNP对心力衰竭同样具有较高诊断价值[5]。本文对我院STEMI患者进行研究,观察不同时间点心力衰竭和非心力衰竭患者BNP水平变化情况,分析不同时间点BNP对STEMI患者心力衰竭的诊断价值,进一步为临床诊断STEMI患者心力衰竭提供理论依据,现报道如下。
资料和方法
1 一般资料 选取我院2015年8月至2017年8月期间收治的118例STEMI患者作为研究对象。纳入标准:①经检查和诊断符合STEMI诊断标准[6]的患者;②年龄≥18岁;③STEMI发病≤12 h进行经皮冠状动脉介入治疗(Percutaneous coronary intervention, PCI)手术治疗的患者。排除标准:①陈旧性心肌梗死、慢性心力衰竭患者;②合并恶性肿瘤、肺心病、肺动脉高压等影响研究的患者;③合并严重的脑、肝和肾功能障碍者;④不愿参加本次研究的患者。参照欧洲心脏学会标准[7],结合左侧胸痛等症状及心电图检查结果及将STEMI患者分为心力衰竭组(n=42)和非心力衰竭组(n=76)。心力衰竭组中男30例,女12例,年龄42~76岁,平均年龄(61.4±4.3)岁。体质指数(Body mass index, BMI)为17.6~28.2 kg/m2,平均BMI(23.2±1.9) kg/m2。基础疾病:高血压26例,糖尿病19例,高脂血症6例。非心力衰竭组中男52例,女24例,年龄41~78岁,平均年龄(61.2±4.5)岁。BMI为17.4~28.5 kg/m2,平均BMI(23.4±1.6) kg/m2。基础疾病:高血压40例,糖尿病35例,高脂血症10例。两组患者性别、年龄、BMI及基础疾病等均有可比性(P>0.05),见表1。

表1 两组患者一般资料比较
2 研究方法 采集所有患者发病6、12、24、48 h外周静脉血,每次4 ml,室温下采用BNP定量仪(深圳微点生物科技有限公司)并严格按照检测试剂盒进行操作检测BNP水平。观察两组患者不同时间点的BNP水平情况和STEMI患者BNP水平,分析不同时间点BNP水平与Killip分级的关系。
结 果
1 两组患者不同时间点的BNP水平情况对比 见表2。心力衰竭患者在发病6、12、24、48 h时BNP水平分别为(52.96±10.12)pg/ml、(172.43±25.38)pg/ml、(471.24±51.72)pg/ml和(374.69±33.42)pg/ml,均明显高于非心力衰竭患者的(12.58±2.69)pg/ml、(75.82±12.36)pg/ml、(179.27±20.64)pg/ml和(118.42±19.76)pg/ml(均P<0.05),发病6~24 h,所有患者BNP水平随着时间的延长而增高,发病24~48 h,所有患者BNP水平随着时间的延长而降低(均P<0.05)。
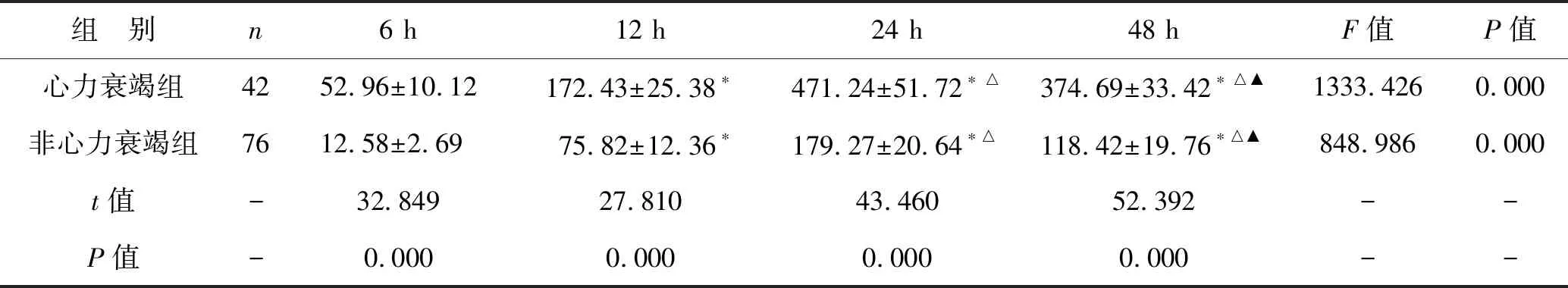
表2 两组患者不同时间点BNP水平情况对比(pg/ml)
注:与6 h比较,*P<0.05,与12 h比较,△P<0.05,与24 h比较,▲P<0.05
2 STEMI患者BNP水平的影响因素分析 见表3。等级Logistic回归分析显示Killip分级较低、前壁心肌梗死、男性和发病至球囊扩张时间较短是STEMI患者BNP水平较低的影响因素(均P<0.05)。
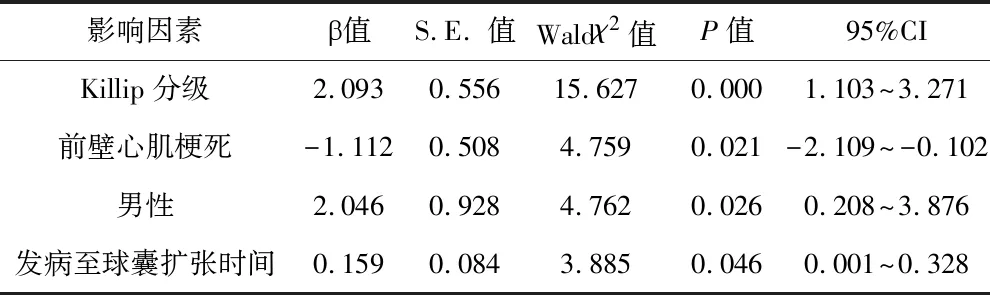
表3 STEMI患者BNP水平的影响因素分析
3 不同时间点BNP水平与Killip分级的关系 见表4。BNP水平在发病6、12 h时与Killip分级呈较弱正相关,发病24、48 h时,BNP浓度与Killip分级呈较强正相关(均P<0.05)。

表4 不同时间点BNP水平与Killip分级的关系
讨 论
STEMI是临床常见的心血管疾病类型,好发于中老年患者,容易引发心力衰竭,威胁患者健康安全。目前临床上采用PCI技术治疗AMI患者取得较好效果,早期接受再灌注治疗使STEMI患者死亡率明显降低[8]。但部分研究发现[9],STEMI患者合并心力衰竭是导致STEMI患者死亡率升高的主要原因,降低了PCI治疗带来的临床效益,因此如何早期诊治STEMI合并心力衰竭是改善STEMI患者预后的关键[10]。
STEMI患者发生心肌缺血后,导致心肌收缩力减弱,顺应性降低,梗死区和非梗死区心肌收缩不协调,引起左心室舒张末期压力升高,收缩、舒张末期容积增大,射血分数降低,心功能下降,容易合并心力衰竭[10]。本次研究对我院118例STEMI患者进行分析,合并心力衰竭患者42例(35.59%),与近年来国内统计的AMI发生心力衰竭的数据相似[11]。
由于STEMI患者心肌部分坏死,导致心肌处于缺血缺氧状态,心功能降低,刺激BNP快速合成并释放进入血液,血液中BNP水平明显升高。本文研究结果显示,心力衰竭患者在发病6、12、24、48 h时BNP水平明显高于非心力衰竭患者,由于合并心力衰竭的患者心肌损伤更严重,BNP释放水平更高[12]。同时,无论STEMI患者是否合并心力衰竭,BNP水平均呈现先升高后降低的变化趋势,即倒钟型,发病6~24 h BNP明显升高,24 h达峰值,24 h后BNP降低。陈佳等[13]人对AMI患者发病后2~24 h内BNP水平的研究也显示,AMI随着发病时间的延长,BNP水平明显升高,但发病24 h后BNP变化未做研究。Yancy等[14]研究发现,AMI患者在发病24 h后BNP水平下降,发病24 h呈明显峰值,AMI患者发病第5天出现了第二峰值,这是由于梗死区与心机膨胀、室壁张力增大所致。本文研究中对我院STEMI患者进行发病48 h内观察,结果显示BNP呈单峰变化,结果与上述研究相符。倘或若延长观察时间或可观察到BNP的第二峰。
目前BNP对心力衰竭的诊断价值已经有较多研究证实,临床上也推荐采用BNP对心力衰竭患者心功能进行快速评估。相关研究显示[15],慢性心力衰竭由于长期处于血流动力学障碍状态,舒张末期容积、心室壁张力负荷,持续刺激BNP分泌,因此BNP水平与心力衰竭心功能呈正相关。研究发现STEMI患者BNP水平与Killip分级呈正相关[16]。邓诗武[17]、赵旭林等[18]研究中也发现,STEMI患者BNP水平与Killip分级呈较弱的正相关。本文对我院STEMI患者进行观察,患者发病≤12 h,BNP水平与Killip分级呈较弱正相关性,应证了上述文献研究结果,但发病24、48 h时,STEMI患者BNP水平与Killip分级呈较强正相关性,表明随着STEMI患者发病时间的延长,BNP水平与Killip分级相关性逐渐增强,发病12~24 h时相关性最强,24 h后相关性有所减弱,该结果与上述文献报道类似。
本课题的不足之处:2017欧洲心脏病学会(European Society of cardiology, ESC)急性ST段抬高型心肌梗死指南报道显示,不同区域的STEMI的住院病死率为4%~12%[19-21],本课题纳入的案例没有住院期间的病死情况,检测BNP水平只能对STEMI患者发生心力衰竭的评估有一定的指导价值,但本文未对这部分内容进行考察,下一步的研究有必要纳入更多案例,将STEMI患者住院期间的生存情况纳入考察。另一方面,已有大量研究显示尽管STEMI是女性致死原因中的首位,但女性发生STEMI的平均年龄晚于男性,一般为7~10年,且STEMI女性患者的预后总体差于男性[22-23],由此可见,分性别分年龄分析BNP对STEMI患者心力衰竭诊断价值对于临床具有更实际的指导价值,本文纳入的男女患者的年龄相当,并未将不同年龄的男女患者进行分层研究,因此,下一步的研究除了纳入更多案例,还有必要将性别、年龄及性别年龄的交互效应进行分别考察。
综上所述,BNP水平随着STEMI患者发病时间的延长而升高,24 h达峰值,随后BNP水平降低。BNP在STEMI患者发病≤12 h对心力衰竭的诊断价值较低,发病12~24 h BNP对心力衰竭的诊断价值明显升高,超过24 h,BNP对STEMI患者心力衰竭诊断价值有所降低。

