LPS对丙型肝炎病毒复制以及Ⅰ型干扰素信号通路的影响
朱紫衣,王文博,刘 媛,江忠勇,常 凯,叶雨笙,熊 杰
丙型肝炎病毒(hepatitis C virus,HCV)感染是引起慢性肝病的重要病原体之一,并且HCV感染通常不会产生适当的固有免疫反应,导致80%的感染者转为慢性感染,其中一部分随之诱发为HCV感染相关性肝硬化及肝癌,严重威胁人类健康[1]。Toll样受体(toll-like receptors,TLRs)作为一种病原体识别受体,在固有免疫和适应免疫中发挥重要作用,其中最早被鉴定为TLRs的TLR4作为革兰阴性细菌脂多糖(lipopolysaccharide,LPS)受体,具有抗细菌和抗病毒感染的作用[2]。既往研究[3-4]表明,LPS可以抑制巨噬细胞内登革热病毒以及HIV的复制,体内体外实验[5-7]也表明LPS可以抑制HBV的复制,然而关于LPS体外对于HCV复制的影响尚未见报道。该研究拟通过相关实验来研究LPS对HCV复制以及对Huh7Ⅰ型干扰素(interferon-Ⅰ,IFN-Ⅰ)信号通路的影响。
1 材料与方法
1.1 实验材料Huh7细胞及感染性HCV病毒颗粒(cell-culture-derived infectious HCV,HCVcc)由本实验室保存,Huh7培养于DMEM培养基,内含10%胎牛血清、100 mg/L链霉素和100 U/ml青霉素,置于 37 ℃、5% CO2、相对饱和湿度的细胞培养箱中进行培养,待细胞生长至融合,按1 ∶2或1 ∶3进行传代,取对数生长期细胞进行实验。
DMEM培养基、胎牛血清购自美国GIBCO公司;脂多糖购自美国Sigma公司;TRIzol试剂盒、CCK8细胞增殖和毒性检测试剂盒购自北京全式金生物技术有限公司;细胞周期及凋亡检测试剂盒购自上海碧云天生物技术有限公司;实时定量PCR试剂盒购自天根生化科技(北京)有限公司;HCV感染者血清收集自本科室检测标本。
1.2 实验方法
1.2.1LPS对Huh7生长增殖的影响 采用CCK8法。将Huh7按1×104个/孔接种96孔板,贴壁后分别加入浓度为100、10、1、0.1 mg/L的LPS,继续培养24、48 h后,每孔加入培养基总体积10%的CCK8溶液,在培养箱中继续培养2 h,用酶标仪测定450 nm处的吸光值(OD)。
1.2.2LPS对HCV复制的影响 将Huh7按1×104个/孔接种96孔板,培养24 h后,以0.5感染复数(multiplicity of infection,MOI) HCVcc感染Huh7,并加入100 mg/L LPS,以未加LPS作为对照,培养24 h以及48 h后,用TRIzol试剂抽提细胞总RNA,进行PCR扩增。
1.2.3免疫荧光(IFA)检测LPS对HCVcc感染 Huh7的影响Huh7按1×104个/孔接种96孔板,24 h后加入0.5 MOI HCVcc,并加入LPS,48 h后弃上清液,PBS洗2遍,加入甲醇100 μl/孔,置于-20 ℃ 冰箱固定20 min,PBS洗1遍,加入3% BSA,室温封闭2 h;而后加入用100 μl HCV感染者血清(1 ∶100),室温孵育2 h后,PBS洗涤3次,加入Alex-488羊抗人IgG(1 ∶100),避光孵育40 min后,用PBS洗涤2遍,荧光显微镜观察并拍照。
1.2.4LPS对Huh7细胞凋亡及细胞周期的影响 将对数生长期的Huh7按1×105个/ml接种6孔板,贴壁后加入100 mg/L LPS,48 h后消化、离心收集细胞,加入5 μl Annexin V-FITC后,再加入5 μl碘化丙啶(propidium iodide,PI)混匀,室温、避光反应15 min,流式细胞仪检测细胞凋亡情况。
Huh7按1×105个/ml接种6孔板,贴壁后更换不含血清的培养基,使其同步,8 h后加入100 mg/L的LPS,孵育48 h后消化、离心收集细胞,70%冰乙醇固定24 h后,PBS洗涤、离心,加入PI染色工作液,避光染色30 min,流式细胞仪检测细胞周期。
1.2.5Real-time PCR 按照TRIzol试剂盒说明书操作,提取待测细胞总RNA,并以之为模板采用SYBRGreen法进行qPCR扩增反应,以GAPDH作为内参基因,反应条件为:45 ℃ 5 min,94 ℃ 30 s,94 ℃ 5 s,59 ℃ 15 s,72 ℃ 10 s,循环进行40次,采用2-ΔΔCt法分析各处理组HCV RNA水平。所用引物由上海生工生物工程技术服务有限公司合成,具体引物序列如下:HCV上游引物:5′-CTTCACGCAGAAAGCGTCTA-3′,下游引物:5′-CAAGCACCCTATCAGGCAGT-3′;GAPDH上游引物:5′-TGGGCTACACTGAGCACCAG-3′,下游引物:5′-AAGTGGTCGTTGAGGGCAAT-3′。
1.2.6Western blot检测IFN-α、IFN-β蛋白水平 将Huh7调整细胞浓度为1×105个/ml接种到24孔板中,置于培养箱中培养。贴壁长至70%时,分别加入100 mg/L LPS以及0.5 MOI HCVcc,分别孵育2、4 h后预冷PBS洗涤2次,裂解、提取蛋白进行蛋白定量检测。SDS-PAGE电泳后转膜、封闭,再分别孵育鼠抗IFN-α抗体(1 ∶500)、兔抗IFN-β抗体(1 ∶500)、鼠抗GAPDH 抗体(1 ∶1 000),4 ℃过夜;TBST洗膜3次,每次10 min,加二抗(1 ∶1 000),室温孵育2 h;TBST洗膜3次,使用BCIP/NBT碱性磷酸脂酶显色试剂盒进行显色。Image J软件对结果进行灰度分析。
2 结果
2.1 LPS对Huh7的细胞增殖的影响Huh7接种96孔板,加入不同浓度的LPS,24 h及48 h后行CCK8试验,检测细胞增殖活性。本研究实验均独立重复进行3次,结果见图1、表1。与对照组比较,10 mg/L LPS对Huh7有促进细胞增殖的作用(P<0.05),余各浓度LPS对Huh7生长增殖无明显影响(P>0.05),因此余后续实验采用100 mg/L处理。
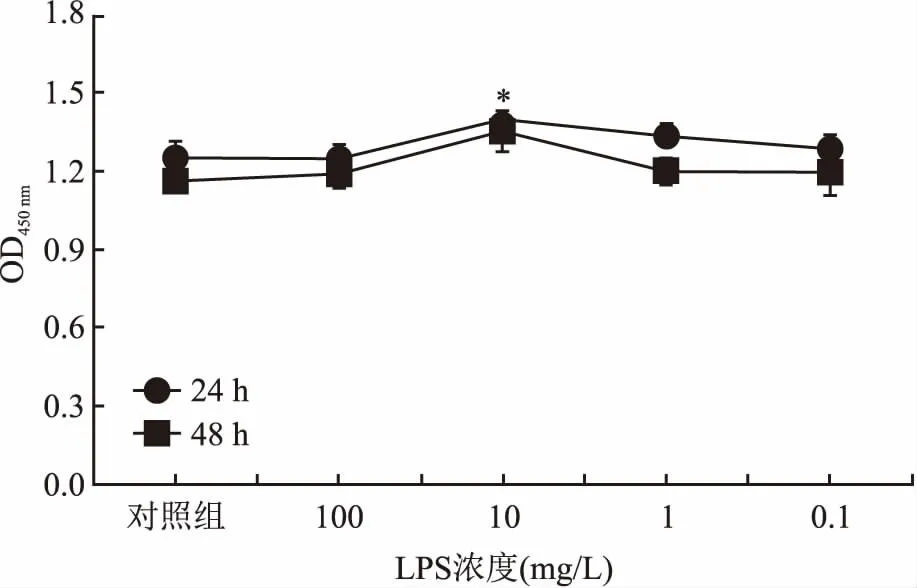
图1 不同浓度的LPS对Huh7细胞增殖的影响
2.2 LPS在细胞水平上抑制对HCV的感染及复制结果显示用100 mg/L LPS处理细胞后,HCV mRNA显著降低,24 h对照组和实验组(LPS 100 mg/L)HCV相对mRNA水平分别为(0.902±0.169)、(0.269±0.138),差异有统计学意义(t=5.016,P=0.007);48 h对照组和实验组HCV相对mRNA水平分别为(0.930±0.121)、(0.647±0.065),差异有统计学意义(t=3.567,P=0.023),见图2。
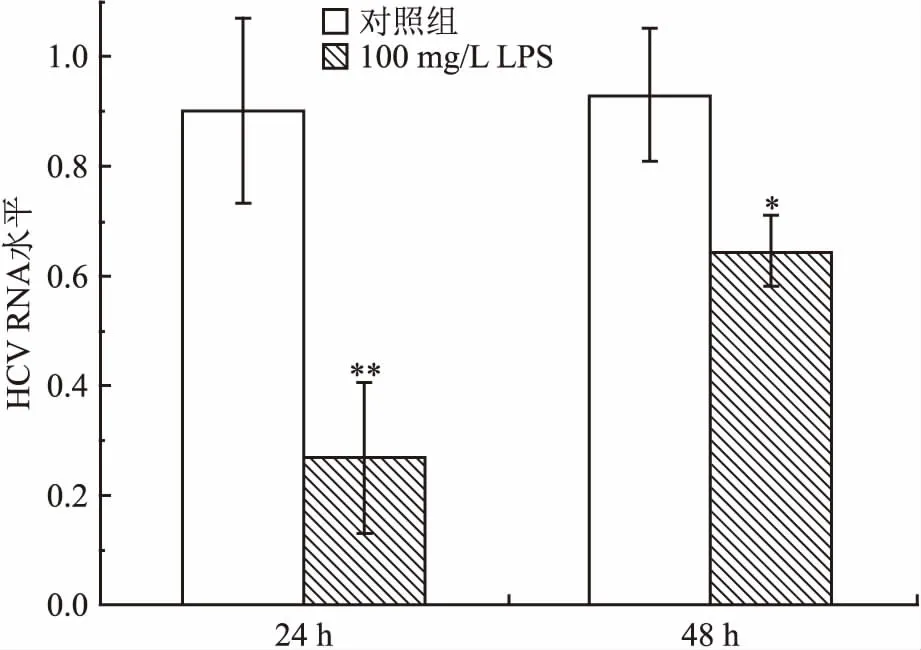
图2 LPS对HCV复制的影响
表1 各浓度LPS处理组的OD450 nm值
为进一步明确LPS对HCV感染的抑制作用,以HCV感染者血清为一抗,通过免疫荧光法检测LPS处理Huh7后细胞内抗核心蛋白抗体的表达。结果如图3所示,100 mg/L的LPS处理组HCV结构蛋白水平明显减低。
2.3 LPS对Huh7细胞周期和凋亡的影响通过流式细胞仪检测细胞周期及凋亡,结果如图4所示:以100 mg/L LPS作用于Huh7 48 h后,与对照组比较,实验组细胞凋亡率减低,分别为(2.130±0.001)% 、(1.070±0.002)%,差异有统计学意义(t=11.314,P=0.001)。LPS作用Huh7 48 h后,细胞周期发生明显改变,实验组进入分裂期(G2+M期)的细胞比例明显低于对照组,而S期细胞明显增多(图5、表2)。
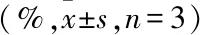
表2 LPS对Huh7细胞周期的影响
与对照组比较:*P<0.05,**P<0.01
2.4 LPS对Huh7细胞IFN-α、IFN-β表达的影响结果如图6所示,LPS刺激细胞后,IFN-α、IFN-β均表达上调(P<0.05)。HCV感染引起IFN-α、IFN-β表达增加,尤其是IFN-β;此外,LPS抑制了HCV引起的IFN-β的表达上调,但对IFN-α表达无明显影响。
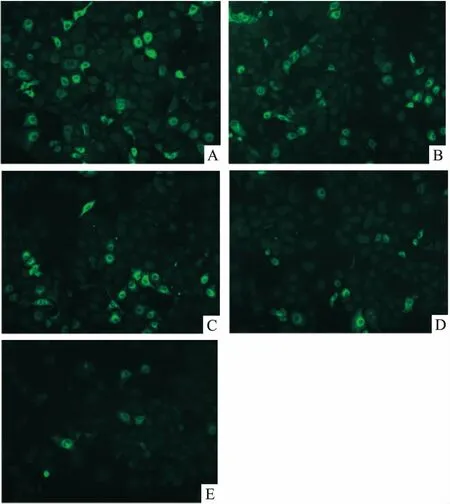
图3 以HCV感染者血清为一抗检测Huh7细胞中的HCV蛋白表达×100
A:对照组;B:0.1 mg/L LPS;C:1 mg/L LPS ;D:10 mg/L LPS;E:100 mg/L LPS
3 讨论
据世界卫生组织统计,全球约有1.85亿人感染HCV ,HCV感染已成为全球关注的重要公共健康问题[8-9]。近年来,直接抗病毒药物(DAA)药物的上市为HCV的患者带来了福音[10],但DAA药物价格昂贵,且安全性和有效性有待于长期追踪。TLR在防御病原体感染发挥重要作用,病毒感染能够刺激TLR信号,使机体发挥免疫清除的作用。然而,HCV感染激活TLR信号的同时,也通过不同机制损害TLR信号,从而逃避免疫清除,所以理论上来说通过使用TLR激动剂恢复TLR信号是一种潜在的治疗方法[11]。本研究显示TLR4的配体LPS可以在细胞水平抑制HCV的复制及感染。细胞凋亡与周期实验结果显示LPS处理后能够使Huh7细胞凋亡减低,S期细胞明显增多,这与既往研究[12]结果相符。细胞毒性实验也说明100 mg/L LPS对Huh7细胞生长增殖无明显作用,说明LPS抑制HCV的复制与感染并非通过细胞毒性作用来实现的。
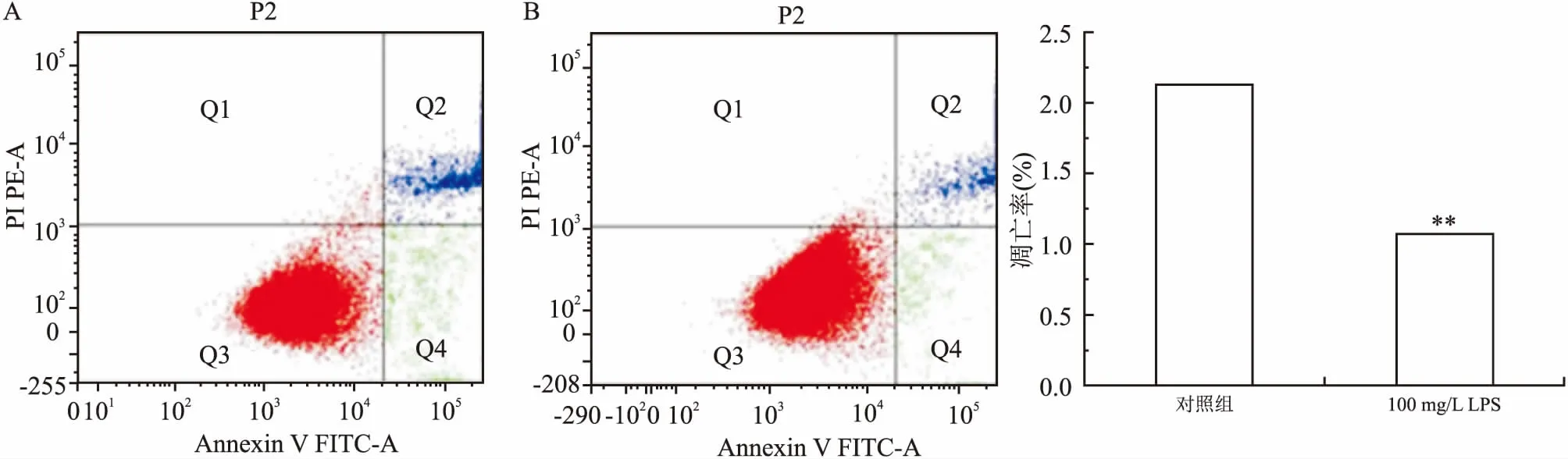
图4 LPS对Huh7细胞凋亡的影响
图5 LPS对Huh7细胞周期的影响
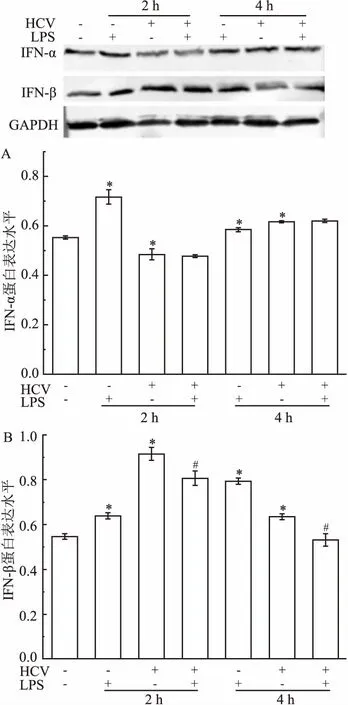
图6 Western blot法检测IFN-α、IFN-β蛋白的表达情况
A:IFN-α;B:IFN-β;与未处理组比较:*P<0.05;与HCV组比较:#P<0.05
IFN-Ⅰ能够抵抗多种病原体的感染,且HCV刺激机体免疫系统所产生抗病毒和免疫调节物质主要是IFN-Ⅰ[13],本研究检测LPS对Huh7细胞IFN-Ⅰ信号通路影响,以期为LPS抑制HCV的复制提供些许理论依据。实验结果显示LPS刺激细胞后,IFN-α、IFN-β均表达上调,而IFN-α、IFN-β参与抑制HCV的复制是非常明确的[14]。Barjesteh et al[15]认为TLR配体处理鸡巨噬细胞后可抑制禽流感病毒的复制,可能与其配体诱导IFN-α、IFN-β等抑制病毒复制的基因表达增加有关,但未对TLR配体对流感病毒感染引起的相关抗病毒基因的表达影响进行研究。本研究显示HCV感染可以迅速激活IFN-Ⅰ信号通路,使IFN-α、IFN-β表达上调,同时LPS抑制了HCV感染引起的IFN-β表达上调,而对IFN-α表达无明显影响。这说明LPS可能通过干扰HCV感染细胞引起天然免疫应答,从而影响HCV的感染与复制,但LPS具体通过何种机制影响病毒感染引起干扰素信号通路表达变化,尚未见明确报道,有待于进一步研究。

