Xp11.2易位性肾癌的临床特点、治疗及预后*
周琦,李志平,赵娅琴,宋坤,胡前程
610041 成都, 四川大学华西医院 肿瘤中心(周琦、李志平、赵娅琴、胡前程);614000 四川 乐山, 武警四川总队医院 肿瘤科(周琦);620010 四川 眉山, 眉山肿瘤医院 肿瘤科(宋坤)
Xp11.2易位/TFE3基因融合相关性肾癌(简称Xp11.2肾细胞癌)是2004年WHO对肾细胞癌(renal cell carcinoma,RCC)重新分类的新增病理类型,其特征在于涉及染色体Xp11.2的几种不同的易位,导致TFE3的基因融合[1]。2016版WHO新分类中将其划分为MIT家族异位性肾癌[2]。因异位性肾癌与非异位性肾癌之间临床和病理特征没有显著差异[3],临床易被误诊。目前关于该病的报道多为小样本、单中心病例报道,且对该病的认识非常有限。本文通过分析我院诊治的15例病例,探讨其临床特点、治疗及预后。
1 资料与方法
1.1 临床资料
统计2008年1月至2018年6月在我院病理诊断为Xp11.2易位/TFE3融合基因相关性肾癌的15例病例。占同期523例确诊的原发性肾细胞癌患者的2.87%。其中男性6例,女性9例(60%);年龄5~60岁,中位年龄28岁;18岁以下5例,小于46岁者共13例(86.7%)。其中该病18岁以下病例数占我院确诊的18岁以下肾细胞癌患者病例数约45.5%。见表1。
患者的主要临床症状包括血尿6例(40%)、腰部胀痛3例(20%)、尿频、尿痛1例(6.7%),无症状由体检发现者6例(40%)。所有患者中均无典型的肾癌三联症(血尿、腰痛、腹部肿块)。肾脏各部位均可发病,肿瘤平均最大径(7.4±4.9)cm(2.8~22.0cm)。见表2。
表1 15例患者的一般资料
Table 1. General Data of 15 Patients with Xp11.2 Renal Cell Carcinoma
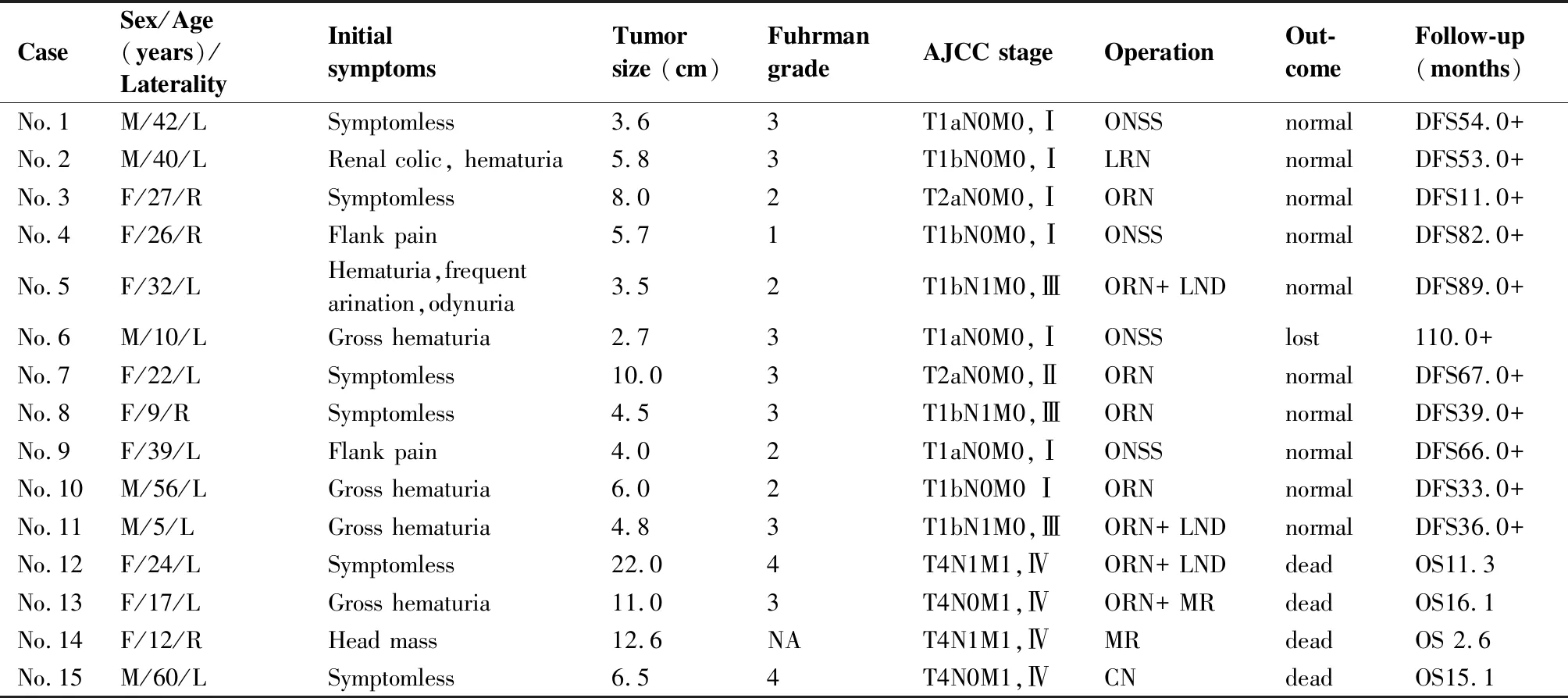
CaseSex/Age(years)/LateralityInitial symptomsTumorsize (cm)FuhrmangradeAJCC stageOperationOut-comeFollow-up(months)No.1M/42/LSymptomless3.63T1aN0M0,ⅠONSSnormalDFS54.0+No.2M/40/LRenal colic, hematuria5.83T1bN0M0,ⅠLRNnormalDFS53.0+No.3F/27/RSymptomless8.02T2aN0M0,ⅠORNnormalDFS11.0+No.4F/26/RFlank pain5.71T1bN0M0,ⅠONSSnormalDFS82.0+No.5F/32/LHematuria,frequent arination,odynuria3.52T1bN1M0,ⅢORN+ LNDnormalDFS89.0+No.6M/10/LGross hematuria2.73T1aN0M0,ⅠONSSlost110.0+No.7F/22/LSymptomless10.03T2aN0M0,ⅡORNnormalDFS67.0+No.8F/9/RSymptomless4.53T1bN1M0,ⅢORNnormalDFS39.0+No.9F/39/LFlank pain4.02T1aN0M0,ⅠONSSnormalDFS66.0+No.10M/56/LGross hematuria6.02T1bN0M0 ⅠORNnormalDFS33.0+No.11M/5/LGross hematuria4.83T1bN1M0,ⅢORN+ LNDnormalDFS36.0+No.12F/24/LSymptomless22.04T4N1M1,ⅣORN+ LNDdeadOS11.3No.13F/17/LGross hematuria11.03T4N0M1,ⅣORN+ MRdeadOS16.1No.14F/12/RHead mass12.6NAT4N1M1,ⅣMRdeadOS 2.6No.15M/60/LSymptomless6.54T4N0M1,ⅣCNdeadOS15.1
M=male; F=female; R=right; L=left; AJCC=American Joint Committee on Cancer; LRN=laparoscopic radical nephrectomy; ORN=open radical nephrectomy; ONSS= Open nephron sparing surgery; LND= lymph node dissection;MR= metastasis resection;CN=Cytoreductive nephrectomy;NA= not available;DFS=disease free survival;OS=overall survival.
表2 4例Ⅳ期患者的临床特点、治疗
Table 2. Clinical Data and Treatment of 4 Patients with Stage IV Disease

VariableCase 12Case 13Case 14Case 15ECOG 0011MSKCC 2143DFS(m)5.811.005.5Clinical featuresImaging and pathologyaPathology and complicationbInitial symptomscComplicationdFirst transfer siteLungIpsilateral adrenal glandBoneBilateral adrenal glandSystemic therapyAxitinibnoneBest supportive careSunitinib
a.Focal calcification could still be seen in CT of recurrent lesions, and mild to moderate inhomogeneity could be seen after enhancement.b.Multi-room, cystic, with hemorrhage and calcification, rich blood supply, and invasion of the collecting system. Transthoracic transfer led to paraplegia.c.The largest diameter of the occipital tumor was 5.7cm, which was infiltrated into the skull.d. The left renal vein had a full-thickness tumor thrombus. Transthoracic transfer led to paraplegia
1.2 检查方法
1.2.1 影像学检查 15例患者均行增强CT检查,表现为密度不均肿块影,肾髓质期可见不均匀强化,部分强化明显,而皮质期强化稍减低,CT增强幅度明显小于肾透明细胞癌。CT出现特征性的环形钙化者6例,突出包膜者4例,广泛血管内癌栓者1例,2例合并有出血及坏死。
1.2.2 病理检查 15例患者免疫组化均提示TFE-3(+),且其中4例联合FISH检查,检检出有意义的TFE3基因分离信号,存在TFE3基因易位。Ki67阳性率最高为10%。
1.3 治疗方法
1.3.1 手术治疗 全组患者除病例14未行原发灶手术外,其余14例患者均在全身麻醉下接受肾脏手术治疗。行保留肾单位手术者4例,其余11例行肾切除术。另外,术前CT考虑淋巴结转移者行淋巴结清扫术。病例13原发灶位于左肾下份,出现同侧肾上腺转移,在排除全身其他部位转移后行左肾上腺转移肿瘤切除+根治性左肾癌切除术。
1.3.2 全身治疗 患者12、15分别口服阿昔替尼及舒尼替尼,患者14给予最佳支持治疗。余12例患者均未行全身治疗。
1.4 随访方法
全组患者采用门诊复查、电话定期随访,掌握患者相关检查结果,包括腹部超声检查或增强CT、胸部X光或CT,第一年每3个月评估一次,2~4年内每6个月复查一次,5年后每年复查一次。
1.5 统计学方法
统计分析使用SPSS软件,版本24.0。应用Kaplan-Meier法分析总生存率并进行单因素分析,Log-rank法检验各组间生存率差异,以P<0.05为差异有统计学意义。
2 结 果
2.1 分期
按最新国际TNM分期标准(AJCC 2010),病理T分期T1期9例,T2期2例,T3期0例,T4期4例。N分期中,N0者10例,N1者5例。TNM分期I期7例,Ⅱ期1例,Ⅲ期3例,Ⅳ期4例。
2.2 转移部位
组内4例T4患者确诊时均已出现远处转移。随着病情进展,远处转移部位包括:骨(4例)、肺(3例)、胸膜转移(2例)、腹腔种植(1例)、纵膈淋巴结转移(1例)、肾上腺(1例)。其中,骨转移发生率最高(4/4),其中椎体转移(3/4),髂骨(1/4)、枕骨(1/4)。
2.3 随访情况
随访截止时间为2018年6月。全组随访11~89个月,中位随访时问37.5个月;失访1例,随访率93.3%。Ⅰ~Ⅲ期患者11例,目前均病情稳定。病例1于术后第44月随访时胸部CT发现左肺下叶背段占位,确诊为原发性肺腺癌,行左肺癌根治术,术后行多西他赛+卡铂化疗4周期,现病情稳定。
2.4 生存分析
全组15例患者失访1例,Kaplan-Meier法分析中位总生存期(5.48±0.81)年,1、3、5年生存率分别为92.9%、85.7%、70.1%。Log-rank法检验对比T4/Ⅳ期组与非T4/Ⅳ期、肿瘤最大径>7cm组与≤7cm组,各组间生存率存在统计学显著性差异。(图1,2),而淋巴结转移较无淋巴结转移生存率差异无统计学意义(图3)。
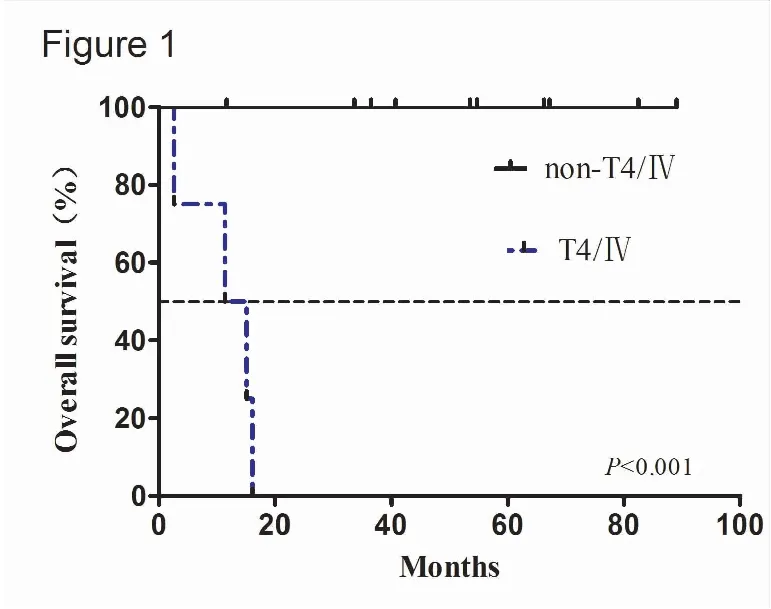
图1 T4/Ⅳ对生存率的影响
Figure 1. Overall Survival between T4/Ⅳ Phase and Non-T4/Ⅳ Phase Patients.The difference was statistically significant.

图2 肿瘤最大径>7cm对生存率的影响
Figure 2. Overall Survival between Patients with Maximum Tumor Diameter >7cm and Those with Maximum Tumor Diameter≤7cm.The difference was statistically significant.

图3 淋巴结转移对生存率的影响
Figure 3. Overall Survival between Lymph Node Metastasis-positive and-negative Patients.The difference was statistically significant.
另外,将是否成人、ECOG评分、肿瘤边界是否清楚、及Fuhrman核分级进行单因素分析,组间均不存在统计学差异。并且经Cox回归模型将上述因素进行多因素分析,尚未找到独立预后不良因素。
而在4例Ⅳ期患者中得出MSKCC评分越高无病生存时间(disease free survival,DFS)越短,但总生存时间(overall survival,OS)并无此规律。见表3。
表3 Log-rank法检验生存分析
Table 3. Survival Analysis by the Log-rank Test
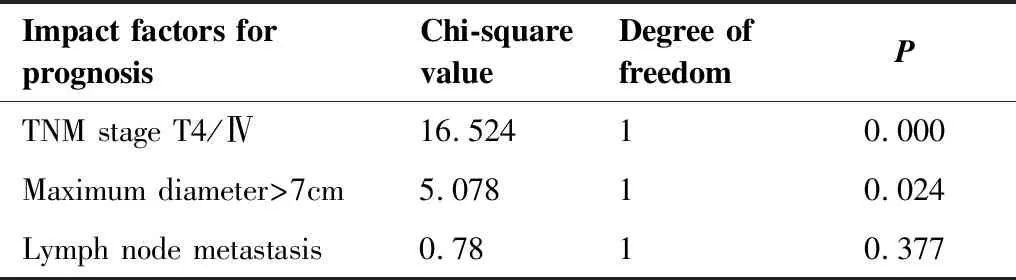
Impact factors for prognosisChi-square valueDegree of freedomPTNM stage T4/Ⅳ16.52410.000Maximum diameter>7cm5.07810.024Lymph node metastasis0.7810.377
3 讨 论
Xp11.2易位/TFE3基因融合相关性肾癌主要发生于儿童和青少年。多数报道为女性发病率较男性高。也有研究表明,发病率在成年人中虽女性较男性高,但在儿童患者中无性别差异[4]。Shuch等认为小于46岁患者可能与遗传有关[5]。本病例共15例,占我院同期523例确诊的原发性肾细胞癌患者的2.87%。其中男性6例,女性9例(60%);年龄5~60岁,中位年龄28岁;18岁以下5例,小于46岁者共13例(86.7%)。其中该病18岁以下病例数占我院确诊的18岁以下肾细胞癌患者病例数约45.5%。
尽管有人指出动态对比增强CT检查根据肿瘤的直径、边界、衰减、性质和圆形钙化灶,结合人口统计学信息和症状,可能有助于区分Xp11.2 RCC与乳头状肾细胞癌[6]。术前诊断尚还难以明确此病,确诊方式仍依靠病理诊断。但与FISH检测相比,TFE3 IHC的假阳性和假阴性率分别为6.7%(2/30)和4.3%(2/46)[7],目前建议免疫组化及FISH联合应用[8-9]。
关于其治疗尚无统一标准。既往有人认为手术是唯一的办法[10]。有学者认为保留肾单位手术适应症为病变测量<7厘米,边缘清晰[11-12]。随着手术的发展,应用水刀进行 3D 腹腔镜下肾部分切除术是一种安全、有效、可行的手术方式[13]。本组Ⅰ~Ⅲ期的病例中行保留肾单位手术者4例,其中T1a患者3例,T1b患者1例,其余7例行根治性肾癌切除术±淋巴结清扫术,均未见复发及转移。术后免疫治疗如干扰素-2α、白介素-2、肿瘤抗原致敏树突状细胞疫苗和放化疗治疗Xp11.2易位性肾细胞癌的效果均不佳[14],故全组患者术后均未行辅助治疗。
关于靶向药物治疗,本组病例12、病例15在原发灶切除术后接受靶向治疗,PFS分别为5.75m、5.52m,OS分别为11.33m、15.08m。这与CHOUEIRI[15]等报道的7.1m的中位PFS和14.3m的OS较为相似。
对于转移灶的手术处理目前尚无报道。本组出现远处转移的病例中OS最长的患者即病例13,初始转移灶仅为同侧肾上腺,手术方式为左肾上腺肿瘤切除+根治性左肾切除术,故切除原发灶同时切除寡转移灶。该患者虽未口服靶向药物,但PFS却较其他口服靶向药物患者长,达到11.04m。由此笔者推测原发灶行根治性手术联合寡转移灶切除术是重要的治疗手段。
关于影响此病预后的因素,有作者认为TNM分期是Xp11.2易位性肾癌影响预后的重要因素[16]。亦有作者报道在多变量分析中,没有一个参数与生存率独立相关,其中Fuhrman和WHO/ISUP分级系统都不适用于Xp11.2易位性肾癌,相反,核大小的评估可能是Xp11.2 tRCC患者的新结果预测因子[17]。研究本组患者治疗及预后,可发现T4/Ⅳ期者较非T4/Ⅳ期者生存率低、肿瘤最大径>7cm者较≤7cm者生存率低。笔者认为该病早发现、早治疗尤为重要。而本组患者中6例(40%)为无症状发病,Ⅳ期患者中(3/4)无泌尿系症状,故定期体检十分重要。而此病发病年龄多系46岁以下患者(13/15),且18岁以下占5例,这部分人对定期体检重视可能不足,故早诊早治确实困难。
因样本量较小,经Cox风险评估目前尚未能找出影响生存率的独立预后因素。大多专家认为MSKCC评分是转移性肾癌患者PFS的独立影响因素[18]。从表2中不难看出,4例Ⅳ期患者MSKCC评分越高则PFS越短。故笔者认为MSKCC评分可作为Xp11.2易位相关性肾癌Ⅳ期患者评价预后的指标。
Xp11.2易位相关性肾癌早期患者5年存活率较高,前期研究尚无该病出现第二原发肿瘤的相关报道。笔者认为该病早期患者随访过程中罹患第二肿瘤时可按原发性肿瘤处理。但全身治疗时建议使用对肾功影响相对较小的药物。另外,因本病肺、骨转移发生率高,初诊及随访过程中需重点关注肺及骨有无转移。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测。

