维持性血液透析患者血脂联素改变及与心脑血管事件的关系*
陈荣荣, 俞燕, 范亚平, 袁莉, 曹英杰, 方丽
1盐城市第一人民医院肾内科(江苏盐城 224005); 2南通大学附属医院肾内科(江苏南通 226001)
随着现代医疗技术的不断进展,维持性血液透析(maintenance hemodialysis, MHD)可以部分纠正尿毒症患者的内环境紊乱,改善症状,延长生命,并可以提高生活质量,有助于其回归社会[1];尽管如此,MHD患者由于功能肾单位丧失,肾脏排泄和代谢功能严重下降,尿毒症毒素蓄积于体内,导致体内水电解质和酸碱平衡失调,此外持续微炎症状态、营养物质缺乏以及动静脉瘘的存在,动脉粥样硬化往往进展迅速,除冠状动脉外,脑动脉和全身周围动脉亦可发生粥样硬化病变,心脑血管事件发生率居高不下[2],严重影响患者生活质量及长期生存率。脂联素(adiponectin, ADPN)是由脂肪组织产生的一种细胞因子,在生理条件下,ADPN具有抗炎、胰岛素增敏、抗动脉粥样硬化作用,并在糖脂代谢和能量平衡中发挥一定的作用,血ADPN含量增加有益于健康成人心脑血管代谢,故被视为心脑血管系统的保护因子。抵抗素是由脂肪细胞分泌的另一种脂肪因子,其生理功能与促炎、胰岛素抵抗及血管损伤有关,抵抗素也参与心脑血管疾病的发生、发展,是心脑血管疾病的独立危险因素[3-4]。本研究通过检测MHD患者血ADPN水平并分析其与MHD患者心脑血管事件间的关联,探讨能否通过监测血ADPN水平从而筛查心脑血管事件高危人群,并进行及早干预,为改善其生存预后、提高生活质量提供新途径。
1 资料与方法
1.1 一般资料 经医院伦理委员会批准,收集2016年3月至2017年3月在南通大学附属医院肾内科血液净化中心行MHD的患者178例,其中男109例,女69例;年龄26~79岁,平均(53.06±12.89)岁;从体检中心随机抽取健康体检者30例。MHD的入选标准:透析龄超过3个月;签署知情同意书。排除标准:(1)1个月内有皮肤、呼吸道、消化道或泌尿道的系统感染;(2)近1个月内有手术与外伤史;(3)近1个月内发生急性冠脉综合征、心力衰竭、脑卒中;(4)近3个月内有输血史;(5)近期接受调脂药物治疗或口服噻唑烷二酮类降糖药。
1.2 分组 MHD患者据其慢性肾衰竭的基础病因分为5组:原发性肾小球疾病102例(A组)、糖尿病肾病24例(B组)、多囊肾17例(C组)、痛风性肾病15例(D组)、其他20例(E组)。MHD组患者与对照组人群性别、年龄、体质指数(body mass index, BMI)、白蛋白、血钙、空腹血糖等比较,差异均无统计学意义(P>0.05);MHD组透析前血肌酐、尿素和尿酸、C反应蛋白(CRP)、甲状旁腺激素(PTH)、血磷、抵抗素均显著高于对照组,血红蛋白(Hb)显著低于对照组,差异均有统计学意义(P<0.01),见表1。178例MHD患者血ADPN平均为(22.53±8.67) mg/L,根据血ADPN的中位数22.31 mg/L为切点分为低ADPN组和高ADPN组各89例。两组患者性别、年龄、透析时间、透前血肌酐、尿素和尿酸、白蛋白、PTH、血钙、血磷、空腹血糖等比较,差异均无统计学意义(P>0.05);低 ADPN组BMI、Hb、CRP、抵抗素均高于高ADPN组,差异有统计学意义(P<0.05),见表2。
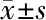

项目MHD组(n=178)对照组(n=30)P值性别0.414 男10916 女6914年龄(岁)53.06±12.8948.87±12.740.104BMI(kg/m2)22.80±3.2221.85±3.430.140透析前肌酐(μmol/L)1 118.60±259.3670.35±10.630.000透析前尿素(mmol/L)28.98±6.125.18±1.800.000透析前尿酸(μmol/L)475.66±91.18283.88±92.320.000Hb(g/L)100.65±17.32143.77±17.950.000白蛋白(g/L)40.67±2.4640.69±3.590.979CRP(mg/L)7.08±5.923.41±1.990.000PTH(pg/mL)427.90±391.6748.49±18.710.000血钙(mmol/L)2.08±0.402.26±0.690.164血磷(mmol/L)2.06±0.571.35±0.640.000空腹血糖(mmol/L)5.01±1.155.12±0.910.561抵抗素(μg/L)30.82±7.0412.54±4.210.000
1.3 研究方法
1.3.1 患者基本资料的收集 登记每例入组患者的一般情况(包括性别、年龄、身高、体重);肾脏病史(慢性肾功能不全的基础病因、透析方式及透析时间等);既往史(高血压、糖尿病、心脑血管疾病、肿瘤等慢性病史,近1个月内感染、手术、外伤史,近3个月内输血史,近期有无接受调脂药物治疗或口服噻唑烷二酮类降糖药等用药情况)等。
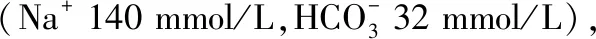
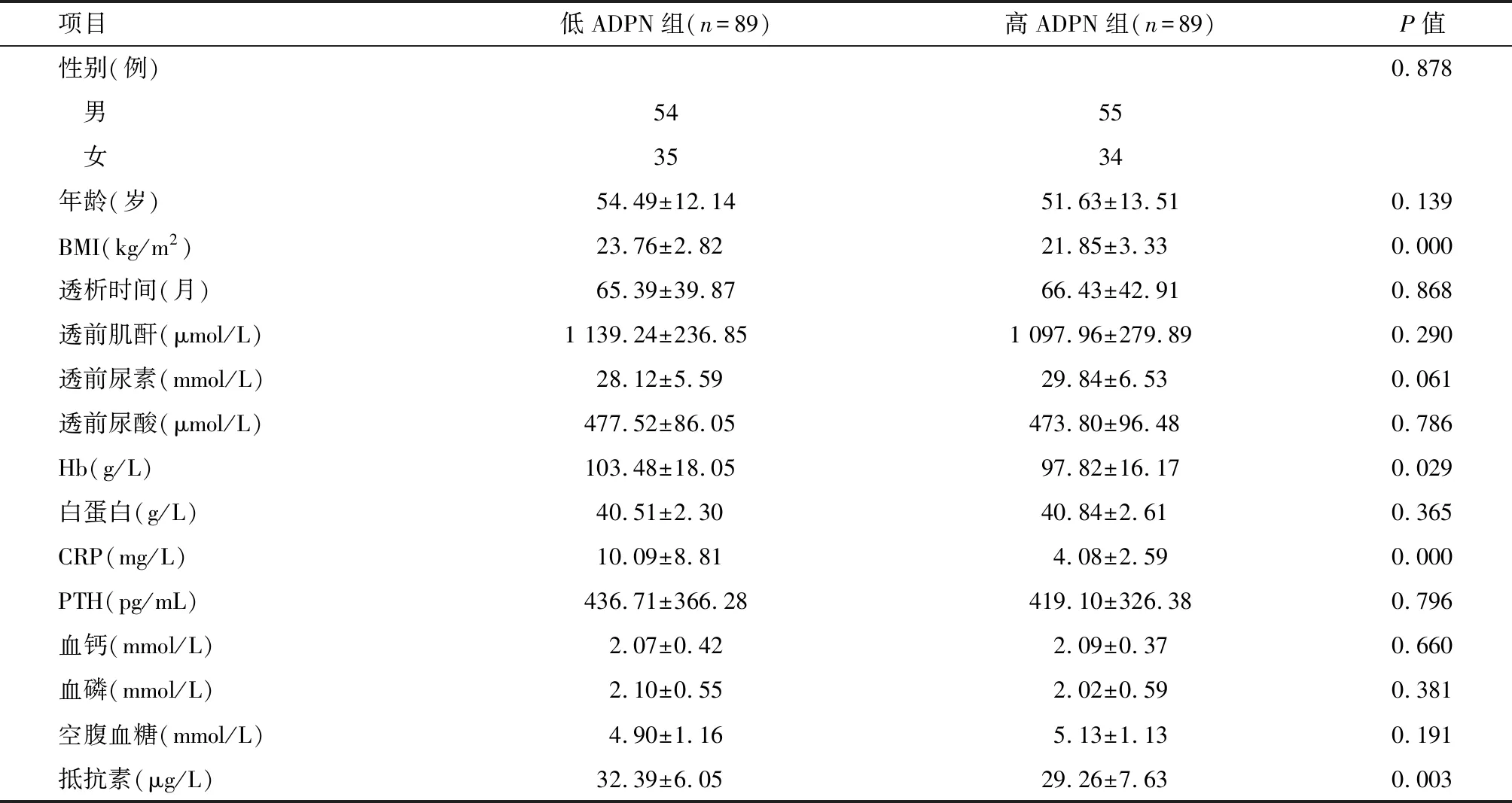
项目低ADPN组(n=89)高ADPN组(n=89)P值性别(例)0.878 男5455 女3534年龄(岁)54.49±12.1451.63±13.510.139BMI(kg/m2)23.76±2.8221.85±3.330.000透析时间(月)65.39±39.8766.43±42.910.868透前肌酐(μmol/L)1 139.24±236.851 097.96±279.890.290透前尿素(mmol/L)28.12±5.5929.84±6.530.061透前尿酸(μmol/L)477.52±86.05473.80±96.480.786Hb(g/L)103.48±18.0597.82±16.170.029白蛋白(g/L)40.51±2.3040.84±2.610.365CRP(mg/L)10.09±8.814.08±2.590.000PTH(pg/mL)436.71±366.28419.10±326.380.796血钙(mmol/L)2.07±0.422.09±0.370.660血磷(mmol/L)2.10±0.552.02±0.590.381空腹血糖(mmol/L)4.90±1.165.13±1.130.191抵抗素(μg/L)32.39±6.0529.26±7.630.003
1.3.3 观察指标与检测 收集MHD组每周首次血液透析日透析前空腹外周静脉血,对照组体检日晨空腹采集外周静脉血,于4℃冰箱静置30 min分层后,置于低速离心机以3 000 r/min离心5 min,分离血清,普通生化检查当天完成,余血清分装置-80℃冰箱保存备用。其中,血常规、肝肾功能、电解质、血糖、CRP及PTH测定由我院检验科生化室检测,HIS系统收集数据。血ADPN、抵抗素测定采用ELISA法(试剂盒购自上海西塘生物公司)。
1.3.4 随访监测 以采血时间为随访开始时间,通过门诊随访、住院记录查询及电话询问方式记录观察对象1年内新发心脑血管事件,包括急性冠脉综合征、心力衰竭、心源性猝死、脑出血、脑梗死,诊断由本科医师和心脑血管专业医师共同确定。
1.3.5 心脑血管事件的诊断标准 心脑血管事件均根据相应的指南进行诊断,心血管事件主要有急性冠脉综合征[5]、心力衰竭[6]、心源性猝死[7];脑血管事件主要有脑梗死[8]和脑出血[9]。
1.4 统计学方法 采用SPSS 22.0统计软件,计量资料数据以均数±标准差表示,两组之间比较采用t检验,多组间比较采用单因素方差分析(one-way ANOVA),多组间两两比较采用LSD法,计数资料比较采用2检验,两因素间的关系采用Pearson相关分析,应用单因素logistic回归分析发生心脑血管事件的危险因素。以P<0.05为差异有统计学意义。
2 结果
2.1 MHD组与对照组血ADPN水平比较 178例MHD患者血ADPN水平为(22.53±8.67) mg/L,30例正常对照组人群血ADPN水平为(6.56±3.50) mg/L。MHD组血ADPN显著高于对照组,差异有统计学意义(P<0.01)。
2.2 不同病因所致MHD患者血ADPN水平比较 A组、B组、C组、D组、E组患者血ADPN水平差异无统计学意义(P>0.05),见表3。
2.3 随访期间内MHD患者新发心脑血管事件情况 178例患者均完成随访,平均随访时间为 (11.09±2.55)个月,随访期间新发心脑血管事件31例次,发生率17.42%,其中急性冠脉综合征16例次(8.99%),心力衰竭10例次(5.62%),心源性猝死2例次(1.12%),脑血管事件3例次(1.69%)。
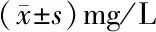

组别例数血ADPNA组10222.90±0.78B组2422.97±2.06C组1721.46±2.27D组1518.48±3.07E组2024.04±1.62
2.4 MHD患者血ADPN与随访期间新发心脑血管事件的关系 低ADPN组患者发生心脑血管事件的比例明显高于高ADPN组,差异有统计学意义(P<0.05),见表4。单因素logistic回归分析显示低ADPN增加MHD患者发生心脑血管事件的风险,达ADPN组2倍以上,见表5。

表4 不同ADPN水平MHD患者新发心脑血管事件发生情况的比较

表5 MHD患者血ADPN水平与新发心脑血管事件的关系
2.5 MHD患者血ADPN水平变化的相关因素分析 Pearson相关分析显示,MHD患者血ADPN与年龄、白蛋白、PTH、血钙、血磷无相关性(相关系数r分别为-0.064、0.027、-0.040、0.053、-0.090,P>0.05);而与BMI、Hb、CRP、抵抗素均呈负相关(相关系数r分别为-0.376、-0.228、-0.375、-0.302,P<0.01)。
3 讨论
ADPN由脂肪组织最丰富的基因转录产物1(adipose most abundant gene transcript 1, APM1)基因编码,该基因定位于染色体3q27(与2型糖尿病及肥胖遗传易感性相关的区域)[10]。ADPN在正常人血循环中含量为2~20 μg/mL,约占血清总蛋白的0.01%,在机体通过肾小球滤过及近端小管分泌排出体外[11]。血液透析的关键是半透膜的透析膜构成的透析器,允许水和小分子物质如肌酐、尿素等通过,大分子物质如蛋白质等被截留,ADPN分子量为30 kD,属于大分子物质,不能被普通透析所清除,文献报道在血液透析患者中,血ADPN浓度大多为对照者的3倍左右[12]。本研究也证实MHD患者血ADPN水平明显高于正常对照组(P<0.01),并且与导致MHD患者的原发病因无关(P>0.05)。
血ADPN在MHD患者中升高的可能原因有:(1)肾清除率下降的反应,研究发现慢性肾脏病(chronic kidney disease, CKD)患者血ADPN水平与肾小球滤过率(GFR)呈负相关[13],并且腹膜透析患者血ADPN水平与残余肾功能呈负相关[12],此外,肾移植后血ADPN水平下降,这一现象提示肾脏在生物降解或清除ADPN中起重要作用[14]。因此,肾脏对ADPN的清除下降可能系MHD患者血ADPN升高原因之一[15]。(2)MHD患者由于功能肾单位减少,肾脏排泄和代谢功能严重下降,引起水、电解质和酸碱平衡失调,加之尿毒症毒素的蓄积以及肾脏内分泌功能障碍等,导致MHD患者出现如血脂异常、贫血和蛋白尿等代谢紊乱状态及体内多系统器官损害的症状,MHD患者血ADPN水平增加可能是机体对代谢紊乱的生理代偿反应及对心脑血管的一种保护机制[13,16]。(3)脂联素抵抗的存在,研究发现与正常肾功能组相比,终末期肾脏病患者ADPN下游信号转导通路受阻,影响其正常生理效应的发挥,机体代偿性地分泌过多ADPN对此进行代偿,以对抗尿毒症患者体内生化代谢的紊乱[17]。
本研究对MHD患者进行为期近1年的随访研究表明,低ADPN组患者发生心脑血管事件的比例明显高于高ADPN组(P<0.05),单因素logistic回归分析显示低ADPN增加MHD患者发生心脑血管事件的风险,是高ADPN组约2倍(P=0.033, 95%CI1.075~5.539),提示低ADPN对MHD患者具有预测心脑血管事件发生的作用。血ADPN对MHD患者心脑血管系统的保护作用机制可能有:(1)抗炎作用。由脂肪组织产生的脂肪细胞因子中,ADPN是主要的抗炎因子,可通过降低巨噬细胞的吞噬活性、抑制巨噬细胞及脂肪组织中炎症因子的产生发挥其抗炎作用[18]。本研究显示低 ADPN组CRP、抵抗素均高于高ADPN组(P<0.05),血ADPN与CRP、抵抗素等炎症因子呈负相关(P<0.05),ADPN与炎症指标间的负相关关系提示低ADPN水平可作为MHD患者的炎症状态增高和识别预测心脑血管事件的生物学标志。(2)抗动脉粥样硬化。ADPN通过抑制内皮细胞炎症反应、抑制巨噬细胞向泡沫细胞的转化以及抑制血管平滑肌细胞增殖等机制减少内皮损伤及动脉粥样硬化的发生发展,对心脑血管系统起保护作用[19-21]。(3)调节能量平衡。蛋白质能量消耗(protein-energy wasting, PEW)是CKD的重要并发症,在透析患者中更是普遍存在,与心脑血管事件的发生及高病死率密切相关,是临床预后不良的一个重要因素,高ADPN水平可改善MHD患者PEW状态,降低其心脑血管事件的发生率及病死率[22]。但高ADPN组患者仍有较高的心脑血管事件发生率(11.24%),并未因ADPN水平的上升而显著下降,推测MHD患者体内尿毒症毒素可减弱ADPN对心脑血管的保护作用。
综上所述,本临床观察发现MHD患者血ADPN水平明显增高,且低ADPN患者发生心脑血管事件的风险明显高于高ADPN患者,MHD患者是发生心脑血管事件的高危人群,这也是导致其预后不良的重要因素。本研究提示血ADPN可作为识别和预测MHD患者心脑血管事件的生物学指标,但有关MHD与ADPN间的确切作用及其机制仍有待进一步深入研究。

