紫草素对大鼠心肌缺血再灌注损伤的保护作用及其机制
孟凡清,张辉,张歆杰,王东
(1 潍坊医学院,山东潍坊261053;2 山东省千佛山医院)
在冠状动脉血运重建及各种心内直视手术中,心肌均会经历缺血再灌注(I/R)过程。I/R会引起心肌组织氧化应激反应和能量代谢障碍等改变,继而导致心肌细胞损伤,即使恢复血运,心肌细胞也难以避免发生凋亡或坏死,患者临床表现为术后突发心律失常、心力衰竭等,严重者甚至死亡[1,2]。紫草属于紫草科紫草属,是一种药用价值非常丰富的多年生草本植物。传统医学认为,紫草具有活血、清热、解毒、凉血等功效,主要用于治疗血热毒盛、温热斑疹、热结便秘等[3]。现代药理学研究发现,紫草的主要药用成分为紫草素,具有一定抗氧化应激、抗细胞凋亡等作用[4~6]。但其能否减轻心肌I/R损伤目前尚不清楚。2017年9月~2018年9月,我们观察了紫草素在大鼠离体心肌I/R过程中对心肌的保护作用,并探讨其可能的作用机制。现报告如下。
1 材料与方法
1.1 材料 健康成年雄性SD大鼠40只,SPF级,体质量260~300 g,购自山东大学实验动物中心,动物许可证号:SYXK(鲁)2013-0001。所有动物分笼饲养,自由摄食、饮水,饲养环境温度22~25 ℃、湿度50%~60%、光照12 h明暗交替。紫草素,纯度≥99%,美国Adooq Bioscience公司。离体动物心脏灌流装置,成都泰盟软件有限公司;Epoch全波长酶标仪,美国BioTek公司;ChemiDocTMImaging System,美国Bio-Rad公司;光学显微镜,日本Olympus公司。超氧化物歧化酶(SOD)、丙二醛(MDA)、还原型谷胱甘肽/氧化型谷胱甘肽(GSH/GSSG)、肌酸激酶(CK)、乳酸脱氢酶(LDH)ELISA试剂盒,美国TSZ公司;TUNEL细胞凋亡原位检测试剂盒,瑞士Roche公司;PI3K、Akt、β-actin一抗,美国Cell Signaling Technology公司;辣根过氧化物酶标记的山羊抗兔IgG二抗,北京中杉金桥生物技术有限公司。
1.2 动物分组处理 所有SD大鼠适应性喂养1周,随机分为对照组、模型组及紫草素1、5、25 mg/L组,每组8只。各组2%戊巴比妥钠55 mg/kg腹腔注射麻醉,麻醉完全后舌下静脉注射普通肝素250 U/kg。注射完毕,经双侧胸肋三角入路迅速取出心脏,通过离体动物心脏灌流装置建立离体心脏灌注模型[7]。模型组灌注K-H液30 min,停灌20 min,再灌注K-H液45 min。紫草素1、5、25 mg/L组灌注K-H液20 min,分别再灌注含紫草素1、5、25 mg/L的K-H液10 min,停灌20 min,再灌注K-H液45 min。对照组持续灌注K-H液95 min。
1.3 指标观察
1.3.1 LDH、CK含量 模型组与紫草素1、5、25 mg/L组分别于停灌前10 min及再灌注20、40 min,对照组于同时间(即灌注20、70、90 min),收集离体灌注心脏的冠脉流出液,4 ℃冰箱保存。按照LDH、CK ELISA试剂盒说明,采用Epoch全波长酶标仪检测冠脉流出液LDH、CK含量。
1.3.2 心肌变性坏死率、心肌细胞凋亡率 各组灌注结束,立即从灌流装置上取下心脏,用预冷的PBS冲洗干净,-20 ℃快速冷冻5 min,分离心室。①心肌变性坏死率检测:横向切取部分左、右心室肌,1~2 mm厚切片。将切片置于1% TTC溶液,37 ℃水浴锅中避光染色30 min,10%甲醛固定24 h。TTC染色后,将切片置于蓝色背景板上拍照,用Image J软件分析图像。采用面积求积法计算心肌变性坏死率。②心肌细胞凋亡率检测:取各组部分心室肌组织,-80 ℃冷冻,超薄切片机切片。切片经二甲苯浸洗、梯度乙醇水化、甲醛固定后,蛋白酶K室温孵育15 min。将标本置于TUNEL反应混合液中,37 ℃避光反应60 min;然后将标本浸泡于POD反应液中,37 ℃孵育30 min;最后DAB显色,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片,光镜下拍照观察。每张切片随机选取8个视野,计数凋亡细胞数,计算心肌细胞凋亡率。
1.3.3 MDA、SOD含量和GSH/GSSG 取各组部分心室肌组织,用组织匀浆器将待检标本制成10%组织匀浆。按MDA、SOD、GSH/GSSG ELISA试剂盒说明,采用Epoch全波长酶标仪检测心室肌组织MDA、SOD含量和GSH/GSSG。
1.3.4 心肌组织PI3K、Akt蛋白表达 取对照组、模型组及紫草素25 mg/L组心室肌组织各50 mg,RIPA裂解液提取组织总蛋白,BCA法蛋白定量合格,加入5×loading buffer 75 μL,100 ℃水浴使蛋白充分变性。取适量变性蛋白,行SDS-PAGE。电泳至溴酚蓝刚跑出分离胶时结束,然后将蛋白电泳产物转印至PVDF膜上。5%脱脂牛奶37 ℃封闭1 h,分别加入PI3K一抗(稀释比1∶500)、Akt一抗(稀释比1∶500)、β-actin一抗(稀释比1∶1 000),4 ℃孵育过夜。次日,加入辣根过氧化物酶标记的山羊抗兔IgG二抗(1∶2 000),37 ℃孵育1 h。ECL发光,暗室中曝光、显影。ChemiDocTMImaging System扫描图像,Image J软件分析各蛋白电泳条带灰度值。以β-actin为内参,以目的蛋白电泳条带灰度值与内参蛋白电泳条带灰度值的比值作为目的蛋白相对表达量。
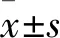
2 结果
2.1 各组不同时间冠脉流出液LDH、CK含量比较 见表1。

表1 各组不同时间冠脉流出液LDH、CK含量比较
注:与对照组同期比较,*P<0.05 ;与模型组同期比较,#P<0.05 ;与紫草素1 mg/L组同期比较,△P<0.05;与紫草素5 mg/L组同期比较,▽P<0.05。
2.2 各组心肌变性坏死率、心肌细胞凋亡率比较 见表2。
2.3 各组心肌组织SOD、MDA含量及GSH/GSSG比较 见表3。

表2 各组心肌变性坏死率、心肌细胞凋亡率比较
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05 ;与紫草素1 mg/L组比较,△P<0.05;与紫草素5 mg/L组比较,▽P<0.05。

表3 各组心肌组织SOD、MDA含量及GSH/GSSG比较
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05; 与紫草素1 mg/L组比较,△P<0.05;与紫草素5 mg/L组比较,▽P<0.05。2.4 各组心肌组织PI3K、Akt蛋白表达比较 见表4。

表4 各组心肌组织PI3K、Akt蛋白相对表达量比较
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
3 讨论
心肌细胞正常代谢过程中ROS产生与清除处于动态平衡状态。当心肌I/R后,可引起心肌细胞代谢紊乱,产生大量ROS[8,9],超过抗氧化系统的清除能力,导致心肌细胞内ROS异常蓄积。ROS是一种强氧化剂,能够破坏细胞膜完整性,使功能蛋白质和DNA降解,严重时引起细胞凋亡[10~13]。在心肌I/R过程中,线粒体会释放大量凋亡因子,造成心肌细胞凋亡增多。心肌细胞内ROS异常沉积或心肌细胞凋亡增多均会引起心肌组织损伤,导致患者术后心律失常、心力衰竭等并发症,继而影响患者预后和生活质量。
紫草素是从传统中药紫草中提取的一类萘醌类化合物。基础研究发现,紫草素具有抗氧化、抗凋亡、抗感染等药理作用,且在实验中未发现明显不良反应[5,6]。本课题组前期研究发现,具有抗氧化作用的药物能够减轻心肌I/R损伤[10,12]。但紫草素能否减轻I/R引起的心肌损伤尚不清楚。
CK、LDH及羟丁酸脱氢酶等心肌细胞内的酶类物质统称为心肌酶,对维持心肌细胞正常代谢功能具有重要作用。由于心肌细胞膜具有选择通透性,生理情况下只有极少量心肌酶能够穿过细胞膜,因此血液中心肌酶含量较低。心肌细胞损伤可导致细胞膜通透性改变,大量心肌酶得以释放入血,血液中心肌酶含量明显升高,并且其含量与心肌损伤程度具有较好的相关性。故可通过检测血液中心肌酶含量来评估心肌损伤程度。本研究结果显示,停灌前10 min,各组冠脉流出液CK、LDH含量比较无统计学差异,表明本次建立的离体灌注模型稳定;再灌后20、40 min,模型组、各紫草素组冠脉流出液CK、LDH含量较对照组同期明显升高,即大鼠心肌出现了I/R损伤,证实大鼠离体心肌I/R损伤模型建立成功;再灌后20、40 min,紫草素5、25 mg/L组冠脉流出液CK、LDH含量较模型组同期明显下降,而紫草素1 mg/L组与模型组同期比较无统计学差异,说明5、25 mg/L紫草素能够减轻大鼠离体心肌I/R损伤,而1 mg/L紫草素的作用效果不明显。本研究还发现,除再灌后40 min冠脉流出液CK含量外,紫草素25 mg/L组冠脉流出液CK、LDH含量均低于紫草素5 mg/L组同期,说明25 mg/L紫草素的心肌保护作用效果更好。
本研究结果发现,与对照组比较,模型组和各紫草素组心肌变性坏死率、心肌细胞凋亡率均有不同程度升高,即心肌I/R可引起心肌细胞不同程度损伤。与模型组比较,各紫草素组心肌变性坏死率、心肌细胞凋亡率均有不同程度下降,且以紫草素25 mg/L组效果最明显,说明1、5、25 mg/L紫草素均能减轻I/R引起的心肌变性坏死和心肌细胞凋亡。本研究结果发现,与对照组比较,模型组和各紫草素组心肌组织MDA含量均明显增加,SOD含量、GSH/GSSG均明显下降,说明I/R可引起大鼠心肌细胞氧化损伤。与模型组比较,紫草素5、25 mg/L组心肌组织MDA含量明显下降,SOD含量、GSH/GSSG明显升高,而紫草素1 mg/L组上述指标变化不明显,表明5、25 mg/L紫草素均能减轻I/R引起的心肌氧化损伤,而1 mg/L紫草素的作用效果不明显。本研究还发现,紫草素25 mg/L组抗心肌氧化损伤的效果优于紫草素5 mg/L组。
目前认为,PI3K/Akt信号通路激活能够减轻I/R损伤引起的细胞凋亡,其作用机制与抑制Caspase活性、参与调解NF-κB作用以及抑制线粒体释放凋亡因子等有关。有研究发现,PI3K/Akt信号通路还能通过激活一氧化氮合酶来减轻I/R所致的氧化损伤[14]。本研究结果发现,与对照组比较,模型组心肌组织PI3K、Akt蛋白相对表达量均明显降低,表明心肌I/R能抑制PI3K/Akt信号通路激活。与模型组比较,紫草素25 mg/L组心肌组织PI3K、Akt蛋白相对表达量均明显升高,表明25 mg/L 紫草素预处理能够逆转心肌I/R对PI3K/Akt信号通路激活的抑制作用。
综上所述,紫草素能够减轻大鼠离体心肌I/R损伤,其作用机制可能与激活PI3K/Akt信号通路有关。

