非小细胞肺癌组织ZNF217蛋白表达变化及其与患者临床病理特征和预后的关系
常世川,朱川,任必勇,黄小平,邓超,刘良忠
(重庆三峡中心医院,重庆404000)
非小细胞肺癌(NSCLC)是肺癌中最常见的类型,约占肺癌总数的85%[1],其早期确诊率不高,大部分患者确诊时已进展为局部晚期或晚期,错过了最佳手术时机,预后较差。随着分子生物学的不断发展,NSCLC被细分为不同的分子亚型,并由此研发了各类分子靶向药物。分子靶向药物的应用能够明显改善NSCLC患者预后,但大部分患者用药6~12个月出现获得性耐药[2]。因此,寻找NSCLC新的治疗靶点具有重要意义。人类20号染色体,特别是20q13区域基因扩增与乳腺癌、卵巢癌、胃癌等肿瘤发生、发展密切相关[3~6]。1998年,Collins等[7]在人染色体20q13区域发现了一个含260 kb的基因,命名为锌指基因217(ZNF217),其表达产物为ZNF217蛋白。但目前ZNF217蛋白与NSCLC的关系尚不明确。本研究观察了NSCLC组织ZNF217蛋白表达变化,并分析其表达变化与患者临床病理特征和预后的关系。现报告如下。
1 资料与方法
1.1 临床资料 选择2010年1月~2012年1月重庆三峡中心医院收治的NSCLC患者85例。所有患者经术后组织病理检查明确诊断。纳入标准:①符合NSCLC诊断,初诊;②年龄>18岁;③TNM分期(IASLC第七版)Ⅰ~Ⅲ期;④均行肺癌根治术,术前未行任何抗肿瘤治疗;⑤ECOG评分0~2分;⑥临床病理资料完整。排除标准:①非NSCLC者;②术前已发生远处转移者;③术前接受其他抗肿瘤治疗者;④术后残留病灶者;⑤合并其他肿瘤或心、脑、肾等重要器官严重疾病者;⑥临床病理资料不完整者。其中,男59例,女26例;年龄≤60岁51例,>60岁34例;有吸烟史53例,无吸烟史32例;ECOG评分:0分46例,1分33例,2分6例;病理类型:腺癌35例,鳞癌43例,其他7例;T分期:T1期37例,T2期37例,T3期11例;N分期:N0期36例,N1期44例,N2期5例;TNM分期:Ⅰ期20例,Ⅱ期57例,Ⅲ期8例;手术方式:肺叶切除80例,单侧全肺切除5例。本研究经重庆三峡中心医院医学伦理委员会批准,患者或其家属知情同意。
1.2 ZNF217蛋白表达检测 采用免疫组化法。取手术切除的NSCLC组织及其配对的癌旁正常组织(距肿瘤组织边缘>3 cm),10%中性甲醛固定,常规脱水、透明,石蜡包埋,4 μm厚连续切片。将切片置于80 ℃烤箱30 min,二甲苯脱蜡,梯度乙醇脱水,3%过氧化氢室温避光孵育10 min,0.01 mol/L枸橼酸钠缓冲液加热抗原修复,自然冷却至室温。10%正常山羊血清封闭30 min,然后加入兔抗人ZNF217抗体(稀释比1∶800),4 ℃孵育过夜。次日加入生物素标记的山羊抗兔IgG二抗,37 ℃孵育30 min。DAB显色,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。以PBS代替一抗作为阴性对照,用已知ZNF217蛋白阳性切片作为阳性对照。所有操作严格按Envision试剂盒说明进行。
由两位病理科医师采用双盲法独立阅片。ZNF217蛋白阳性染色定位于细胞核,呈淡黄色至棕褐色颗粒。每张切片随机至少选取5个400倍视野,评价染色强度,计数阳性细胞,计算阳性细胞比例。以染色强度评分和阳性细胞比例评分综合判定ZNF217蛋白阳性表达。染色强度评分:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞比例评分:<10%为0分,10%~<25%为1分,25%~<50%为2分,≥50%为3分。两项评分乘积≥1为ZNF217蛋白阳性表达。
1.3 随访 所有患者术后定期随访,随访方式包括电话、门诊、信件等,随访截至2017年1月。统计患者总生存期(OS)。OS是指患者首次诊疗至因任何原因引起死亡的时间(失访患者为最后一次随访时间,研究结束仍然存活患者为随访截至日期)。
1.4 统计学方法 采用SPSS19.0统计软件。计数资料比较采用χ2检验。生存分析采用Kaplan-Meier法,生存率比较采用Log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 NSCLC组织与癌旁正常组织ZNF217蛋白表达比较 NSCLC组织与癌旁正常组织ZNF217蛋白阳性表达率分别为55.3%(47/85)、25.9%(22/85)。NSCLC组织ZNF217蛋白阳性表达率明显高于癌旁正常组织(χ2=23.999,P<0.01)。
2.2 NSCLC组织ZNF217蛋白表达与患者临床病理特征的关系 NSCLC组织ZNF217蛋白表达与肿瘤T分期、N分期和TNM分期有关(P均<0.05),与性别、年龄、吸烟史、ECOG评分、病理类型、手术方式无关(P均>0.05)。见表1。
2.3 ZNF217蛋白表达与NSCLC患者预后的关系 所有患者术后随访截至2017年1月,随访6~78个月、中位随访时间50.6个月。ZNF217蛋白阳性表达者中位OS为39个月,ZNF217蛋白阴性表达者为61个月。ZNF217蛋白阳性表达者中位OS明显低于ZNF217蛋白阴性表达者(χ2=7.770,P<0.01)。见图1。
3 讨论
NSCLC是现阶段全球范围内肿瘤相关死亡的主要原因之一。随着分子生物学的不断发展,NSCLC系列致癌驱动基因相继确定,肺癌分型也由过去单纯的组织病理学分类,进一步细分为基于驱动基因的分子亚型[8],并由此研发了各类分子靶向药物。分子靶向药物的临床使用明显改善了携带相应驱动基因的NSCLC患者预后。但大部分患者用药一段时间后易出现获得性耐药。因此,需要不断寻找NSCLC新的致癌驱动基因。
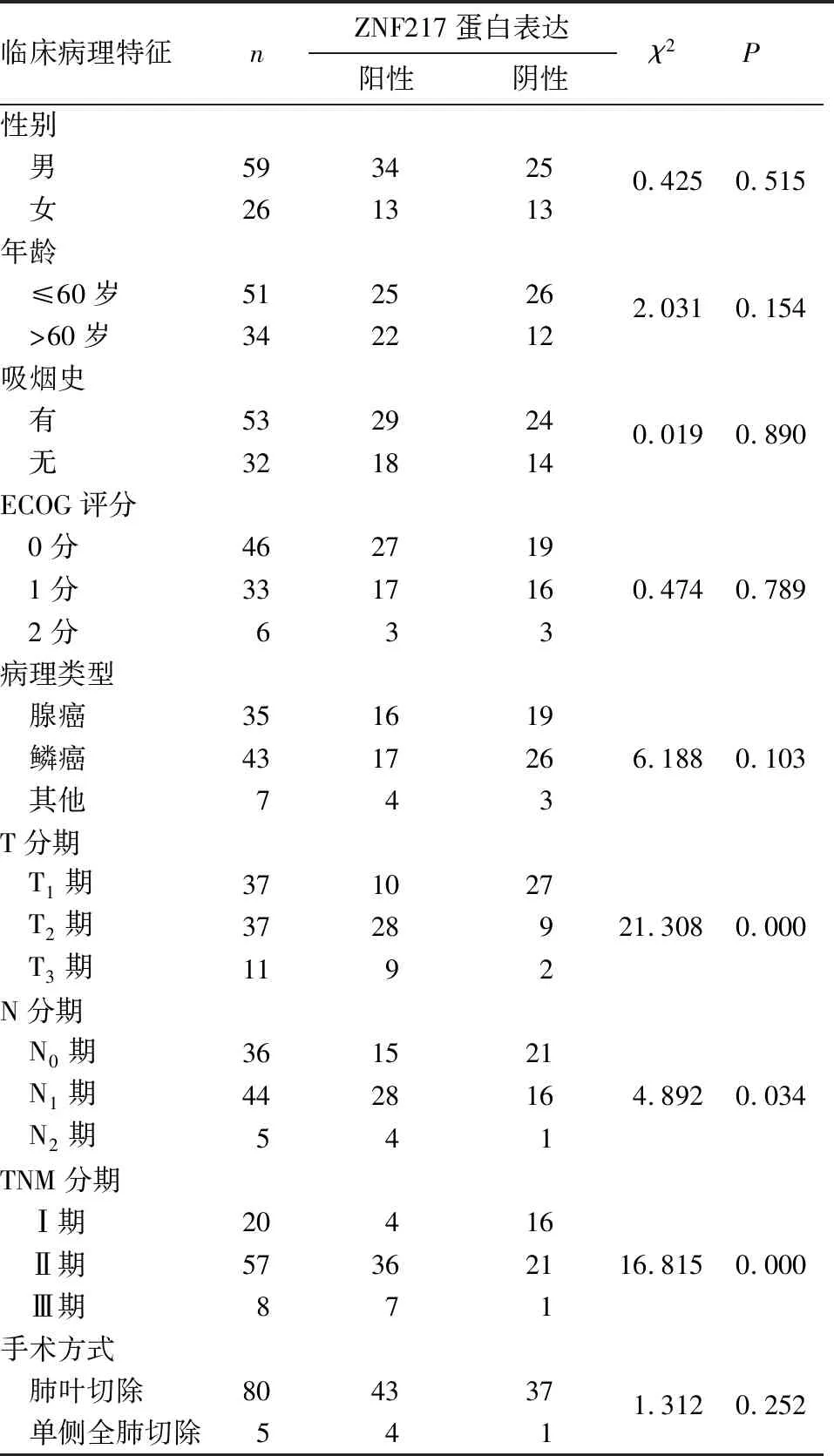
表1 NSCLC组织ZNF217蛋白表达与患者临床病理特征的关系(例)
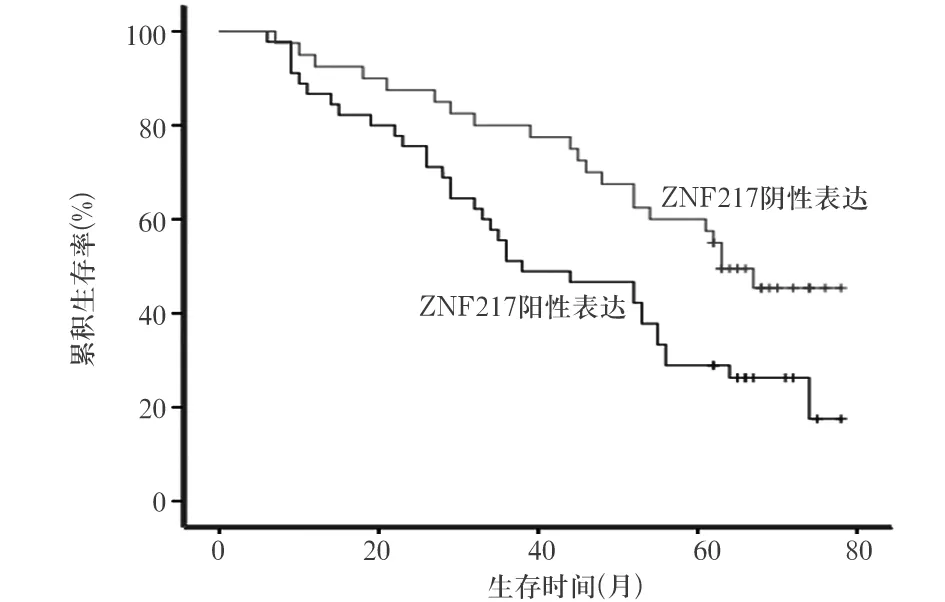
图1 不同ZNF217蛋白表达者生存曲线
ZNF217定位于人染色体20q13.2,是新发现的候选癌基因。有研究证实,ZNF217与乳腺癌、胃癌、结直肠癌等肿瘤的发生、发展有关[9]。ZNF217编码产物为ZNF217蛋白,属于锌指蛋白家族成员。研究表明,锌指蛋白家族成员在多种肿瘤的发生、发展过程中具有重要作用。但目前ZNF217蛋白与NSCLC的关系尚不明确。
季婷婷等[10]研究发现,胰腺癌组织ZNF217蛋白表达明显高于癌旁正常组织,且其高表达与肿瘤体积、TNM分期、神经浸润、淋巴结转移有关。有研究认为,ZNF217可能在mRNA转录层面上抑制E-cadherin表达,从而促进细胞上皮-间质转化(EMT),最终导致肿瘤的发生、发展[11,12]。Luo等[13]通过慢病毒介导shRNA来抑制胶质瘤细胞ZNF217表达,发现PI3K/AKT信号通路失活,该信号通路的下游基因E-cadherin表达明显上调,N-cadherin、c-myc表达明显下调,肿瘤细胞增殖、侵袭和迁移能力均明显降低。本研究结果发现,NSCLC组织ZNF217蛋白阳性表达率明显高于癌旁正常组织,提示ZNF217蛋白可能与NSCLC的发生、发展有关。进一步研究发现,ZNF217蛋白表达与肿瘤T分期、N分期和TNM分期有关,而与性别、年龄、吸烟史、ECOG评分、病理类型、手术方式无关。提示ZNF217蛋白可能在NSCLC的侵袭和转移过程中发挥重要作用。
韩亮等[14]研究发现,ZNF217蛋白低表达胃癌患者生存时间明显长于ZNF217蛋白高表达胃癌患者。Shida等[15]研究发现,ZNF217蛋白阴性表达肿瘤患者无复发生存期和总生存期均长于ZNF217蛋白阳性表达肿瘤患者。Jiang等[16]研究发现,抑制ZNF217蛋白表达,可抑制前列腺癌进展。Cheng等[17]荟萃分析发现,ZNF217蛋白可作为预测恶性肿瘤患者预后的指标。以上研究表明,ZNF217蛋白可作为预测肿瘤患者预后的指标。但其能否用于预测NSCLC患者预后尚不清楚。本研究结果显示,ZNF217蛋白阳性表达NSCLC患者中位OS明显低于ZNF217蛋白阴性表达NSCLC患者。说明ZNF217蛋白亦可用于预测NSCLC患者预后。
综上所述,NSCLC组织ZNF217蛋白表达明显升高,其表达变化与肿瘤进展和患者预后不良有关。ZNF217有可能成为NSCLC精准治疗的一个潜在靶点。

