腹膜后黏液样脂肪肉瘤误诊1例并文献复习
吴汶钊 雷银 刘浩林 林叶远 桂绍涛 罗韬 刘孝东
患者,男,62岁,10 d前体检发现右侧肾上腺区占位,血压正常,平素无头晕、头痛,无心悸、多汗,无尿频、尿急、尿痛,无肉眼血尿,无腰腹部疼痛等不适。昆明医科大学第一附属医院门诊B超:右肾上腺区解剖位置处探及一偏强回声实性包块,大小约9.0 cm×8.0 cm。入院后实验室检查:血皮质醇、血浆醛固酮/肾素活性比值及24 h尿香草苦杏仁酸均无异常。CT:右肾上腺区软组织肿块,大小约9.7 cm×7.0 cm,病灶密度不均,其内可见脂肪密度影,增强扫描实性部分不均匀轻度强化,右肾上腺受压显示欠清并其内密度不均,与病灶分界欠清,右肾受压下移,右肾上腺区占位多考虑良性肿瘤,髓质脂肪瘤可能(图1)。术前诊断:右肾上腺髓样脂肪瘤(adrenal myelolipoma, AML)。行腹腔镜下右侧肾上腺区占位切除术,术中可见淡黄色肿瘤与右侧肾上腺、右肾上部脂肪囊、腹膜重度粘连,肉眼未见肿瘤侵犯右肾,保留部分肾上腺后,切除肿瘤。术后病检:黏液样脂肪肉瘤(myxoidliposarcoma, MLS)(1级)。免疫组化:VIM(+),CD34(-),SMA(-),CD31(-),S-100(+),Ki-67(+20%)。
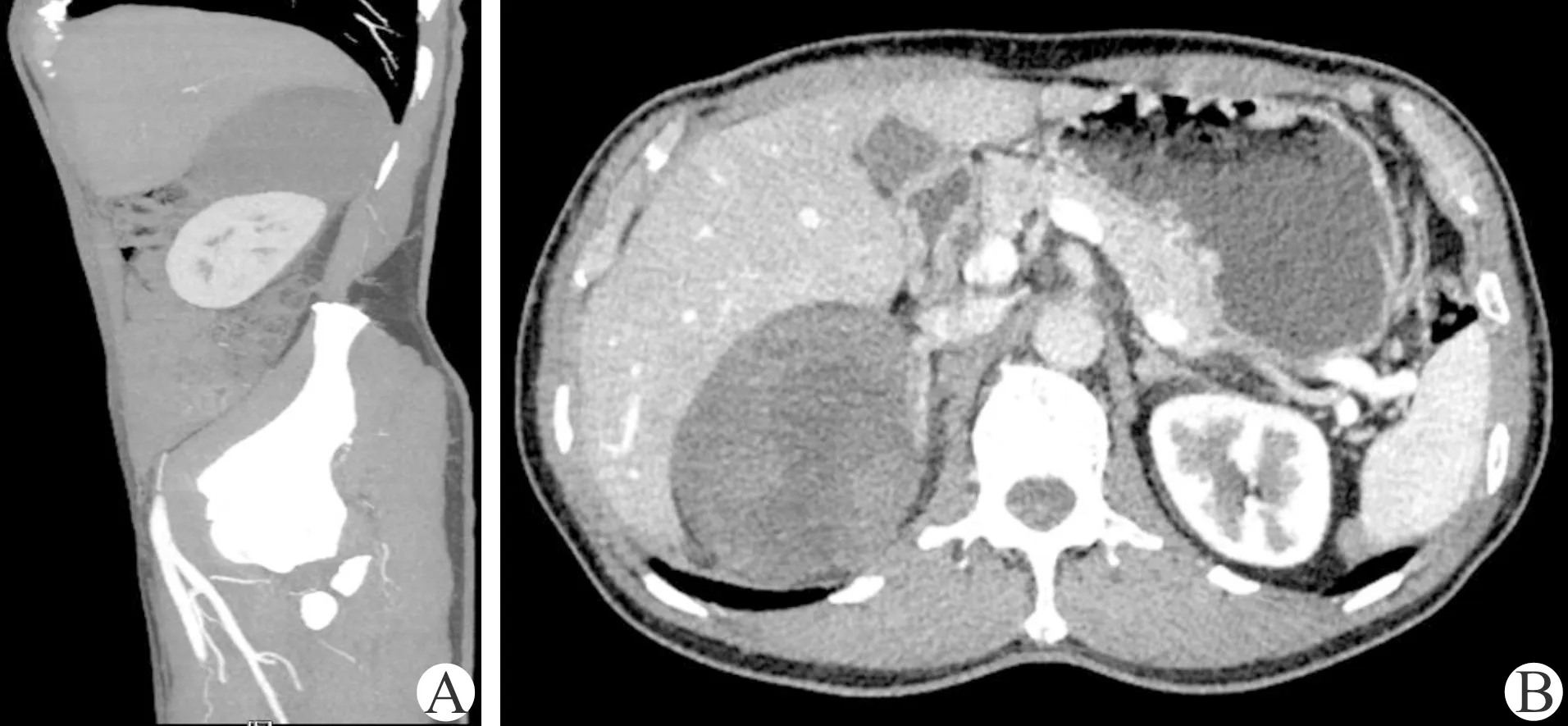
A:矢状位;B:横断位图1 泌尿系CT增强
讨论腹膜后脂肪肉瘤是一种罕见的软组织肉瘤,在软组织肉瘤中占比15%,其中有三分之一来自肾周脂肪[1-2]。脂肪肉瘤起源于间质细胞,好发部位依次为四肢、臀部、腹膜后、躯干[3]。该病在男性中更为常见,多发生于50岁左右[4]。2013年WHO基于4种组织学细胞类型将脂肪肉瘤分为高分化脂肪肉瘤、MLS、去分化脂肪肉瘤和多形性脂肪肉瘤4类。MLS由不同分化阶段的脂肪母细胞、毛细血管丛和黏液样基质构成。
腹膜后脂肪肉瘤在早期体积较小时多无症状,因腹膜后间隙的存在,肿瘤往往长到很大时才得以诊断,94%的腹膜后脂肪肉瘤诊断时>5 cm[5]。随着肿瘤的增大,相继会出现一些非特异性症状,均与肿瘤周围器官和组织被肿瘤压迫和侵袭相关。当神经被肿瘤侵犯后,受其支配区域会出现功能障碍和疼痛;胃受到肿瘤压迫会出现呕吐;肿瘤侵犯胃或压迫引起继发性门静脉高压可导致胃出血;当肠道受累时可出现便秘、腹泻、里急后重、排便疼痛等;肿瘤压迫或侵犯肾脏和输尿管可导致肾积水、继发性泌尿道感染、血尿等[6]。AML也是到肿瘤较大时压迫周围器官后出现一些非特异性症状,和MLS难以区分。
常用的影像学诊断方法有B超、CT和MRI。B超无创、经济,多用于疾病的初步诊断和复查,亦可在B超引导下行穿刺活检以明确诊断。最可靠的影像诊断方法是CT和MRI,它们可以正确定位腹膜后肿瘤并评估肿瘤大小和周围器官的受累情况。MLS的CT表现有3型:①假囊肿型:水样密度,似囊性病变;②实体型:肿瘤主要由纤维组织组成,脂肪组织较少,CT值>20 HU;③混合型:纤维组织和脂肪组织混和,密度不均,CT值<-20 HU[7]。MRI相较于CT能更好地反映腹膜后脂肪肉瘤和周围软组织的关系。缺乏脂肪成分的MLS在MRI上多表现为T1WI等低信号,T2WI高信号,含有大量脂肪母细胞和毛细血管丛的MLS其MRI增强扫描强化非常明显[3,8]。AML在MRI上表现为T1WI高信号,T2WI在压脂和反相位成像表现低信号[9]。该患者入院后未行MRI检查,也没有在B超引导下行穿刺活检,并且该患者的MLS中脂肪占比较高,增强CT扫描不均匀强化,与AML的CT影像相似。故术前误诊为右侧AML。
手术切除肿瘤是MLS的主要治疗方法,必要时还需切除被肿瘤侵犯的器官。因为肿瘤完整的切除是良好的预后和无病生存的基础[10]。若肿瘤与周围组织粘连较重,可能导致腹膜后器官和结构识别困难,肿瘤中高度分化的脂肪细胞也可能难以与腹膜后脂肪区分,使得术中判断切除范围变得困难。一些MLS患者在术后2年内局部复发,有时也可能出现多处转移[11]。已知有几个因素与肿瘤复发或患者生存相关,如年龄超过50岁、肿瘤切除不完全、手术导致种植、转移灶的存在、肿瘤分化较差和淋巴结浸润等[12]。因此,有必要通过手术前的成像检查尽可能地确定肿瘤的大小及与周围器官、血管之间的位置关系,以便在手术过程中尽可能切除所有肿瘤和转移灶,以减少或延缓术后的复发。MLS患者行根治术前的炎症标志物也能预测患者预后,术前淋巴细胞/单核细胞比率与术后患者的预后呈负相关[13]。法国联邦癌症中心(FNCLCC)分级系统通过分析软组织肉瘤分化、核分裂比率和肿瘤坏死体积几个组织学特征进行评分分级,也能较好地预测MLS患者的复发和生存。本文患者FNCLCC分级为1级,术后定期复查,暂无需特殊处理。由于MLS具有放疗和化疗敏感性,当FNCLCC评为3级或由于肿瘤较大、粘连较重、有微小转移灶等而导致手术后肿瘤残余,可进行术后辅助放疗,改善MLS患者预后[6]。总体而言,分化良好的MLS的5年存活率超过70%[14]。
总结该患者误诊的原因:①鉴别诊断不够全面,未能仔细排除腹膜后含脂肪成分的占位类别;②在临床诊断时思路不清晰,带着思维定势,仅根据患者术前B超和增强CT的报告就先入为主诊断为AML;③对于腹膜后性质不明占位的诊断,未能在条件允许的情况下行术前B超引导下穿刺活检;④术前影像学检查不全面,未行MRI检查,失去进一步判断肿瘤性质的机会。

