“素养”维度下例析化学实验题创新
■湖北省武汉市洪山高级中学 张 杰
在近年高考化学试题中,都无一例外地设置了化学实验主观题。无论其命题素材如何改变,实验装置如何转换,考查的重心始终没有出离“物质制备与纯化”“物质组成与性质探究”“定量测定”“实验方案设计、评价”四大热门主题。但若从化学学科核心素养维度出发,仔细分析比对,就不难发现其中的新意:强调化学思想观念的建构,强调无机、有机知识的适当融合;要求考生能发现和提出有探究价值的问题,能从问题的假设出发,确定探究目的,设计探究方案,富有科学探究精神和探究能力。
例1“银-菲洛嗪法”是检测居室内甲醛(化学式CH2O)含量的常用方法之一。化学学习小组利用其原理设计如图1所示装置测定新装修居室内空气中甲醛的含量。(夹持装置略去)

图1
已知:甲醛能被银氨溶液、酸性KMnO4溶液氧化生成CO2;10-5mol·L-1的紫色KMnO4溶液遇甲醛气体即褪色;毛细管内径不超过1mm。
请回答下列问题:
(1)银氨溶液的制备。打开K3,打开分液漏斗活塞,将饱和食盐水慢慢滴入圆底烧瓶中。饱和食盐水的作用是____,当观察到三颈烧瓶中____时,关闭K3和分液漏斗活塞。
(2)室内空气中甲醛含量的测定。
①用热水浴加热三颈烧瓶,打开K1,将滑动隔板慢慢由最右端抽到最左端,吸入1L室内空气,关闭K1。打开K2,缓慢推动滑动隔板,将气体全部推出,关闭K2。装置中毛细管的作用是____。
再重复上述操作4次。
②向充分反应后的溶液中加入稀硫酸调节溶液pH=1,再加入足量Fe2(SO4)3溶液,写出加入Fe2(SO4)3溶液后发生反应的离子方程式:___。立即加入菲洛嗪,Fe2+与菲洛嗪形成有色物质,在562nm 处测定吸光度,测得生成Fe2+1.12mg。空气中甲醛的含量为____mg·L-1。
(3)关闭K3,将三颈烧瓶中的溶液换为24.00mL10-4mol· L-1的KMnO4溶液,量取KMnO4溶液使用的仪器是____(量筒、酸式滴定管、碱式滴定管)。再加入2 mL 6mol·L-1的硫酸酸化后重新测定空气中甲醛的含量。当三颈瓶中溶液恰好褪色时,向容器A 中共抽气_____次。
解析:(1)参考CaC2的水解反应,可知氮化镁和水反应的产物中含有氨气(用于B 中制备银氨溶液);用饱和食盐水代替水,以减缓反应速率;氨水溶液和硝酸银溶液反应,先产生白色沉淀AgOH,而后逐渐溶解在氨水中,银氨溶液的配制过程要求氨水不宜过量,故白色沉淀恰好溶解时,应及时关闭K3和分液漏斗活塞。
(2)①装置中毛细管的作用是减小气体通入的速度,使空气中所含的甲醛气体被完全吸收,若气流过快则难以保证;②甲醛被氧化为CO2,银氨被还原为银,生成的银又被加入的Fe2(SO4)3氧化,离子方程式为Ag+Fe3+══Ag++Fe2+;甲 醛与Ag(NH3)2OH反应中,碳元素化合价由0价→+4价,银元素由+1 价→0 价;生成的银又被铁离子氧化,铁离子本身又被还原为亚铁离子,m(Fe2+)=1.12mg,n(Fe2+)=2×10-5mol,根据得失电子守恒,若消耗的甲醛为a mol,则4a=2×10-5×1,解得a=5×10-6;由于实验共进行了5次操作,所以测得1L空气中甲醛的含量为1×10-6mol,即为1×10-6mol·L-1×30×103mg·mol-1=0.03mg·L-1。
(3)使用量筒无法达到0.01 mL 的精度要求,而高锰酸钾溶液具有强氧化性,会腐蚀碱式滴定管下端的橡胶管,所以用酸式滴定管(或移液管)量取;根据(2)中计算结果:1L空气中甲醛的含量为1×10-6mol,它被KMnO4溶液氧化为二氧化碳,KMnO4被还原为Mn2+,若向容器A 中共抽气b 次,根据得失电子守恒:b×4×1×10-6=24×10-3×10-4×(7-2),b=3。
答案:(1)饱和食盐水和氮化镁反应制备氨气,并减缓反应速率 白色沉淀恰好溶解
(2)①减小气体的通入速度,使空气中甲醛气体被完全吸收 ②Ag+Fe3+══Ag++Fe2+0.03
(3)酸式滴定管(或移液管) 3
素养视角点评:解答(1)需要由已学习过的“乙炔的实验室制法”进行迁移,能识别化学中常见的物质模型和化学反应的理论模型。(2)中书写的离子方程式虽简单,但并不是常规反应,若从氧化还原或元素化合物知识角度推演,容易产生纠结,需紧扣“Fe2+与菲洛嗪形成有色物质”这一信息,确定是Fe3+与生成的Ag发生了氧化还原反应从而产生Fe2+。具有证据意识,建立观点、结论和证据之间的逻辑关系,能从定性与定量结合上收集证据,推出合理的结论。
改编价值延伸:a.在导管末端放置多孔球泡达到与毛细管相同的作用。b.就三颈烧瓶右侧的导气管管口所处的位置提问(考查氨气极易溶于水的特性及防倒吸措施)。c.将“向充分反应后的溶液中加入稀硫酸调节溶液pH=1”设置为一个待填的实验步骤,考查考生对银氨溶液及银镜反应认知的完整性及逻辑的严密性。
例2硫化钠又称硫化碱,为无色、易溶于水和热乙醇的固体,常用于制造硫代硫酸钠、多硫化钠、硫化染料等。实验室中用工业硫化钠(因含重金属硫化物和煤粉等而呈褐色)、纯碱等物质制备硫代硫酸钠晶体(Na2S2O3·5H2O)的原理如下:
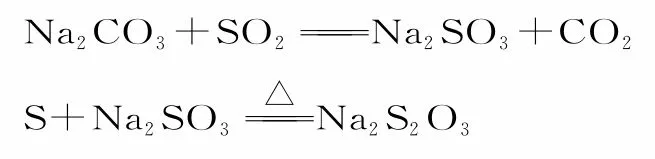
回答下列问题:
(1)工业硫化钠的纯化。
将18g工业硫化钠加入烧瓶中,再加入150 mL 95%的乙醇溶液和8 mL水。用如图2所示装置进行沸水浴加热,并回流40min,趁热过滤,冷却、搅拌、结晶、倾析,除去上层母液;最后用95%的乙醇溶液洗涤、烘干,得到Na2S·9H2O 晶体。图2中仪器a 的名称是_____,该过程中回流40min的目的是_____。
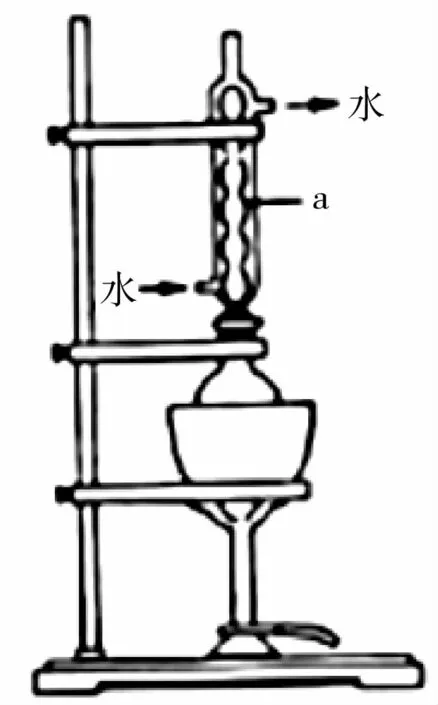
图2
(2)硫代硫酸钠的制备。
称取纯化后的Na2S·9H2O 晶体14.4g和m gNa2CO3,混合后置于锥形瓶中,加入150mL蒸馏水,微热后按下页图3所示组装仪器;然后,打开分液漏斗的活塞和螺旋夹6,并适当调节该螺旋夹,向锥形瓶中通入SO2气体,当溶液呈中性时,停止通入SO2气体,对反应后溶液进行后续处理,即可制得硫代硫酸钠(Na2S2O3·5H2O)。
①适当调节螺旋夹6的目的是____。
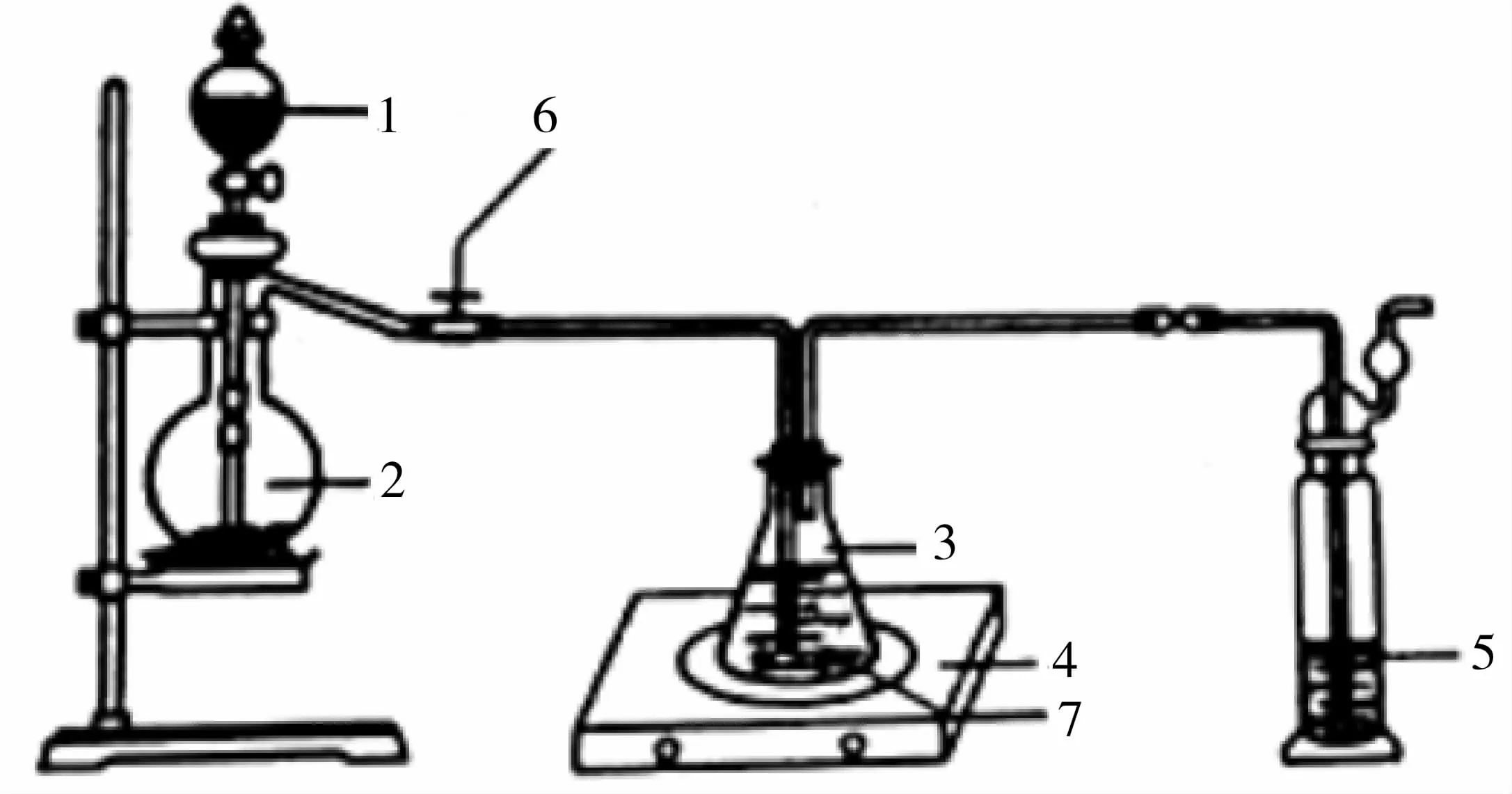
图3
②实验过程中,通入SO2一段时间后,溶液中会生成大量淡黄色沉淀,然后又变澄清。生成淡黄色沉淀的化学方程式为____。若通入SO2气体时间过长,会降低硫代硫酸钠的产率,原因是____。
③为提高产品纯度,节约原料,m=____g。
④反应结束后,需对溶液进行后续处理,得到硫代硫酸钠晶体(Na2S2O3·5H2O),其操作是蒸发浓缩、冷却结晶、过滤、____、烘干。称量所得产品,质量为a g,则Na2S2O3·5H2O 的产率为____(用含a 的代数式表示)。
解析:(1)仪器a为(球形)冷凝管;回流40min的目的是为了保证硫化钠完全溶解在热的乙醇中。
(2)①适当调节螺旋夹6 可以控制二氧化硫的流速,若流速过快,二氧化硫来不及充分反应,同时也可能引起倒吸。
②通入SO2一段时间后,溶液中生成的大量淡黄色沉淀是单质S,追溯其反应根源,可以分步理解为:酸性较强的亚硫酸(SO2溶于水形成的)与Na2S 反应制得 H2S 和Na2SO3;H2S与SO2继续反应生成单质S,故反应为2Na2S+3SO2══3S ↓+2Na2SO3。若通入的SO2时间过长,就会使溶液呈现较强的酸性,而硫代硫酸钠会与酸反应H2O),导致产率降低。
③制备Na2S2O3的反应为2Na2S+Na2CO3+4SO2══3Na2S2O3+CO2,n(Na2S)∶n(Na2CO3)=2∶1。加 入 了m(Na2S·9H2O)=14.4g,n(Na2S·9H2O)=0.06 mol,所以n(Na2CO3)=0.03 mol,m(Na2CO3)=3.18g。
④从溶液中得到晶体的具体过程为:蒸发浓缩、冷却结晶、过滤、洗涤、烘干。n(Na2S·9H2O)=0.06 mol,所以生成物中n(Na2S2O3)=0.09 mol,m (Na2S2O3)=0.09mol×248g·mol-1=22.32g,实际得到ag,产率为
答案:(1)球形冷凝管 保证硫化钠充分溶解 (2)①控制气体流速,保证SO2充分反应,防倒吸 ②2Na2S+3SO2══3S↓+2Na2SO3通入SO2时间过长,会使溶液酸性较强,导致Na2S2O3因反应而损耗 ③3.18 ④洗涤
素养视角点评:(1)解答本问题需要对化学常规仪器有较全面的了解,需要深刻地理解固液萃取的含义,并构建热乙醇溶解硫化钠固体这一实验情景。(2)中调节螺旋夹6的目的考查,凸显了培养实验意识的重要性,关注反应效率、实验安全,具有理论联系实际的观念;求m 的值并非单纯地考查化学计算,通过研究方程式2Na2S+3SO23S↓+2Na2SO3的两种产物,发现若用于下一个反应则 会 多 出1 molS;引导考生利用反应Na2CO3+SO2══Na2SO3+CO2,再补足1 molNa2SO3,从而确定了三种反应物Na2S、Na2CO3、SO2的计量关系,也从S元素的角度体现了“原子经济性”。这要求考生有将化学成果应用于生产、生活的意识,在实践中逐步形成节约成本、循环利用、保护环境等观念。
改编价值延伸:a.考查“趁热过滤”的目的(滤去重金属硫化物和煤粉,而硫化钠不会析出)。b.书写Na2S、Na2CO3、SO2三者反应制备Na2S2O3的方程式。c.设置产品纯度测定的滴定实验,比如用高锰酸钾标准液滴定的方法测样品的纯度,考查滴定原理、滴定终点现象、纯度计算等。
——硫代硫酸钠

