高考化学实验专题测试(B卷)
■湖北省武汉外国语学校 孟凡盛(特级教师)
一、单选题
1.下列实验操作规范且能达到目的是( )。
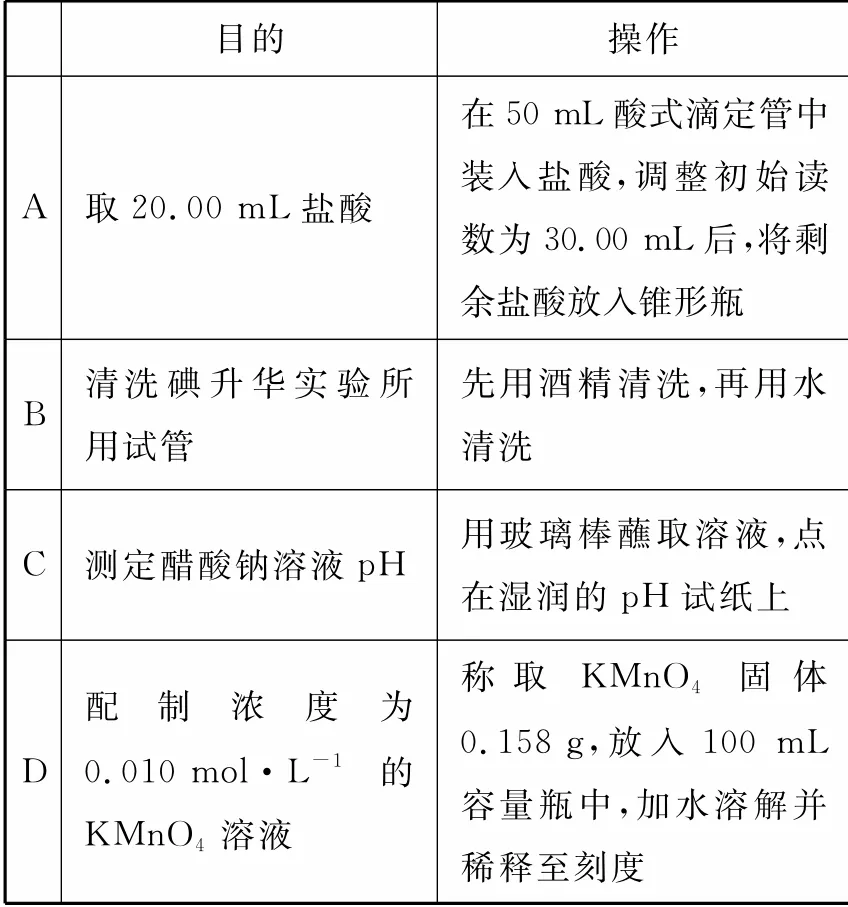
目的 操作A 取20.00mL盐酸在50mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸放入锥形瓶B清洗碘升华实验所用试管先用酒精清洗,再用水清洗C 测定醋酸钠溶液pH 用玻璃棒蘸取溶液,点在湿润的pH 试纸上D配 制 浓 度 为0.010mol·L-1 的KMnO4 溶液称 取 KMnO4 固 体0.158g,放入100 mL容量瓶中,加水溶解并稀释至刻度
2.下列操作正确的是( )。

3.下列说法正确的是( )。
A.广泛pH 试纸测得某氢氧化钠溶液的pH 为12.5
B.焰色反应实验火焰呈黄色,则试样中一定含Na+,不含K+
C.配制氯化铁溶液时,可将氯化铁溶解在较浓的盐酸中,然后再加水稀释
D.氯化钠溶液中混有少量硝酸钾,可经蒸发浓缩、冷却结晶、过滤得纯净氯化钠
4.室温时,甲、乙两位同学配制氯化钠溶液。甲同学配制5%的NaCl溶液100g,乙同学 配 制0.5 mol·L-1的NaCl 溶 液100mL(20 ℃时,氯化钠的溶解度为36.0g)。下列说法正确的是( )。
A.两位同学所需溶质的质量相同
B.两位同学所配溶液的质量相同
C.两位同学所需实验仪器种类相同
D.甲同学所配的溶液浓度比乙同学的大
5.某KCl 样品中含有少量K2CO3、K2SO4和不溶于水的杂质,为了提纯KCl,先将样品溶于适量水中,搅拌、过滤,再将滤液按如下步骤进行提纯(过滤操作已略去)。下列说法不正确的是( )。
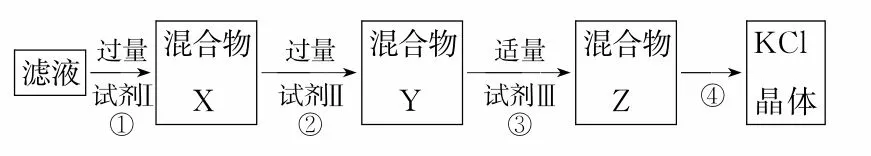
A.起始滤液常温下pH>7
B.试剂Ⅰ为BaCl2溶液
C.上述过程必须经2次过滤
D.步骤③目的是除去CO2-3
6.用下列装置(如图1)进行相应的实验,能达到实验目的的是( )。

图1
A.图1①所示装置用于粗盐提纯中除掉泥沙
B.图1②所示装置用于蒸干氯化镁溶液制无水MgCl2
C.图1③所示装置用于以己烯为萃取剂萃取溴水中的溴单质
D.图1④所示装置用于验证乙烯的生成
7.某同学采用硫铁矿焙烧,取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确( )。
A.溶解烧渣选用足量硫酸,试剂X 选用铁粉
B.固体1中一定含有SiO2,控制pH 是为了使Al3+转化为Al(OH)3,进入固体2
C.若改变方案,在溶液1 中直接加NaOH 至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
D.从溶液2得到FeSO4·7H2O 产品的过程中,须控制条件防止其氧化和分解
8.工业上常用水蒸气蒸馏的方法(蒸馏装置如图2所示)从植物组织中获取挥发性成分。这些挥发性成分的混合物统称精油,大都具有令人愉快的香味。从柠檬、橙子和抽子等水果的果皮中提取的精油90%以上是柠檬烯提取柠檬烯的实验操作步骤如下:
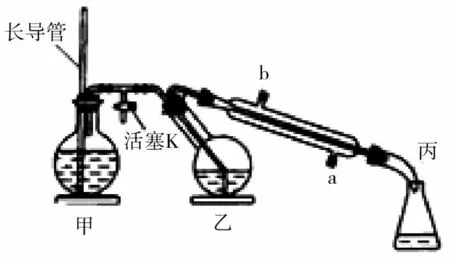
图2
(1)将1~2 个橙子皮剪成碎片,投入乙装置中,加入约30mL水
(2)松开活塞K。加热水蒸气发生器至水沸腾,活塞K 的支管口有大量水蒸气冒出时旋紧,打开冷凝水,水蒸气蒸馏即开始进行,可观察到在馏出液的水面上有一层很薄的油层。
下列说法不正确的是( )。
A.当馏出液无明显油珠,澄清透明时,说明蒸馏完成
B.蒸馏结束后,为防止倒吸,立即停止加热
C.长玻璃管作安全管,平衡气压,防止由于导管堵塞引起爆炸
D.要得到纯精油,还需要用到以下分离提纯方法:萃取、分液、蒸馏
9.用如图3所示装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下列选项中现象与结论均正确的是( )。
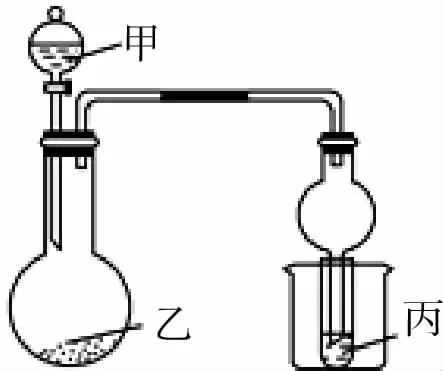
图3
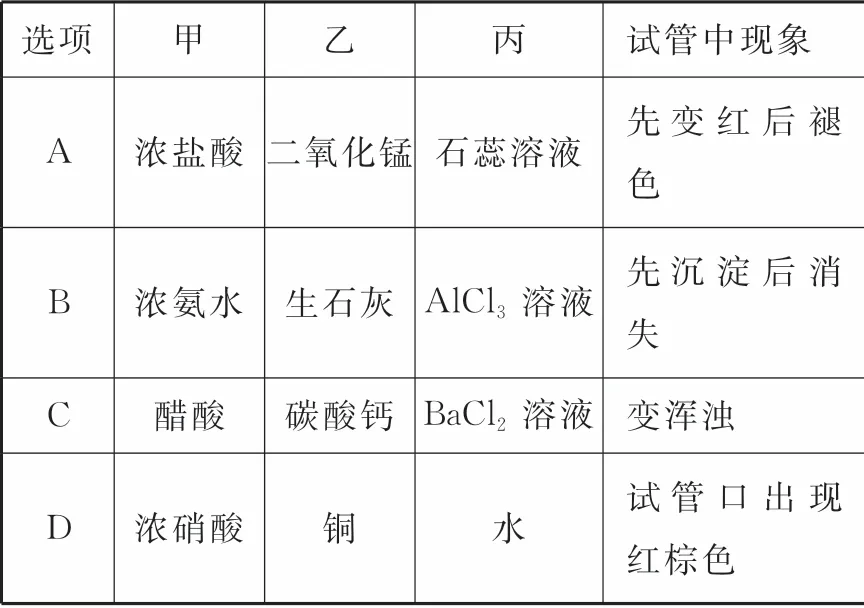
选项 甲 乙 丙 试管中现象A 浓盐酸 二氧化锰 石蕊溶液 先变红后褪色B 浓氨水 生石灰 AlCl3 溶液 先沉淀后消失C 醋酸 碳酸钙 BaCl2 溶液 变浑浊D 浓硝酸 铜 水 试管口出现红棕色
10.下列各组溶液,不用其他试剂就可以将它们区别开来的是( )。
A.HCl、NaCl、Na2CO3、Na2SO4
B.Na2CO3、NaOH、BaCl2、HCl
C.HNO3、Ba(NO3)2、NaCl、Na2SO4
D.BaCl2、Ca(NO3)2、NaCl、Na2CO3
11.下列有关滴定的说法正确的是( )。
A.用标准的KOH 溶液滴定未知浓度的盐酸,若配制标准溶液的固体KOH 中混有NaOH 杂质,则结果偏低。
B.用c1mol·L-1酸性高锰酸钾溶液滴定V2mL未知浓度的H2C2O4溶液,至滴定终点,用去酸性高锰酸钾溶液体积为V1mL,则H2C2O4溶液的浓度为
C.用未知浓度的盐酸滴定已知浓度的NaOH 溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏低
D.用25mL 滴定管进行中和滴定时,用去标准液的体积为21.7mL
12.利用石墨电极电解1mol·L-1氯化钠溶液,并收集阳极气体检验其成分。已知:O2能使酸性的KI-淀粉溶液变蓝,不能使中性的KI-淀粉溶液变蓝。
实验:①将气体通入中性的KI-淀粉溶液中,溶液变蓝。②用足量NaOH 溶液充分洗气,气体体积减少,将剩余气体通入中性的KI-淀粉溶液中,溶液颜色不变,再向溶液中滴加2滴H2SO4溶液,溶液变蓝。③向酸性的KI-淀粉溶液中通入空气,溶液颜色不变。
下列对实验现象的解释或推测不合理的是( )。
A.根据实验现象可以判断电解时阳极的电极反应式为2Cl--2e-══Cl2↑B.根据实验可以得出,反应物的浓度和溶液的pH 会影响物质的氧化性
C.根据实验可以得出中性条件下,氧化性Cl2>O2
D.NaOH 溶液洗气时发生反应的离子方程式为2OH-+Cl2══Cl-+ClO-+H2O
13.某化学兴趣小组为探究草酸分解的产物,设计的实验装置如图4所示,下列说法正确的是( )。
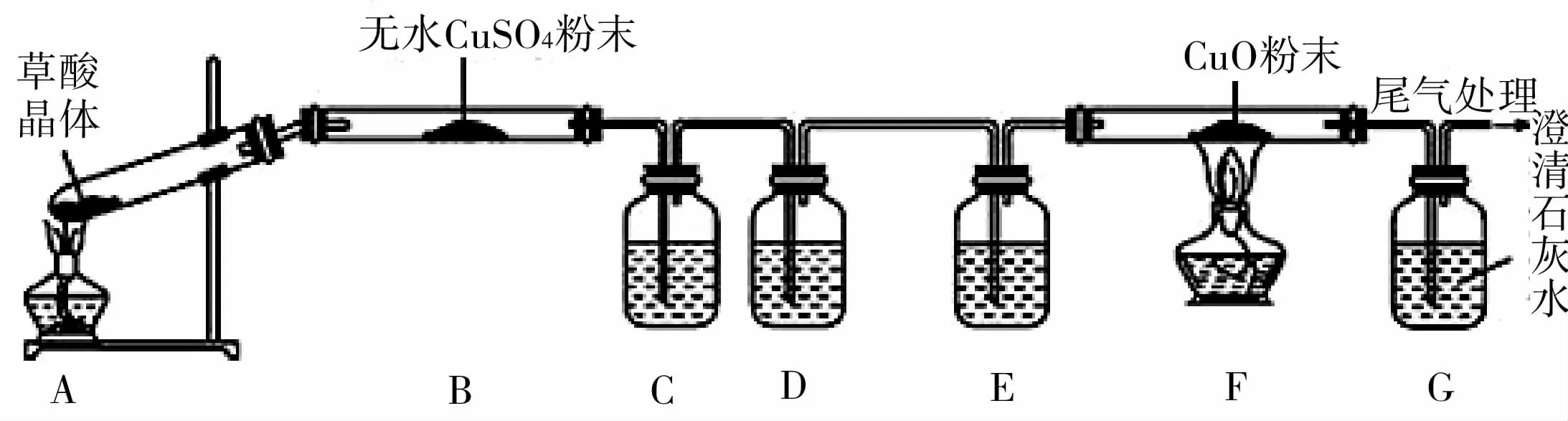
图4
A.实验开始时,先点燃A 装置处的酒精灯,后点燃F装置处的酒精灯
B.B 装置中的现象为蓝色粉末变白,说明分解产物中有水生成
C.G 装置中澄清石灰水变浑浊,说明分解产物中有CO 生成
D.C、D、E 装置中分别盛放澄清石灰水、浓硫酸、氢氧化钠溶液
14.以下关于化学实验中“先与后”的说法中正确的是( )。
①蒸馏时,先点燃酒精灯,再通冷凝水
②加热氯酸钾和二氧化锰的混合物制备氧气,用排水法收集气体后,先移出导管,后撤酒精灯
③实验室制取某气体时,先检查装置气密性,后装药品
④分液时,先打开分液漏斗上口的塞子,后打开分液漏斗的旋塞
⑤H2还原CuO 实验时,先检验气体纯度,后点燃酒精灯
⑥使用托盘天平称量物体质量时,先放质量较小的砝码,后放质量较大的砝码
⑦蒸馏时加热一段时间,发现忘记加沸石,应迅速补加沸石后继续加热
A.②③④⑤⑦ B.①②③④⑦
C.②③④⑤ D.全部
二、填空题
15.氨基羧酸盐在工业、农业、生活中都有着十分广泛的应用。氨基甲酸铵(NH2COONH4)可用做肥料、灭火剂、洗涤剂等,甘氨酸亚铁[(NH2CH2COO)2Fe]可用作补铁剂等。
已知:ⅰ.氨基甲酸铵:白色固体,易分解,易水解;
ⅱ.甘氨酸亚铁:易溶于水,难溶于乙醇。
ⅲ.甘氨酸:易溶于水,微溶于乙醇,两性化合物。
ⅳ.柠檬酸:易溶于水和乙醇,有较强酸性和还原性。
实验室制备方法如下:
Ⅰ.制备氨基甲酸铵:反应的化学方程式为2NH3(g)+CO2(g) NH2COONH4(g) ΔH <0。
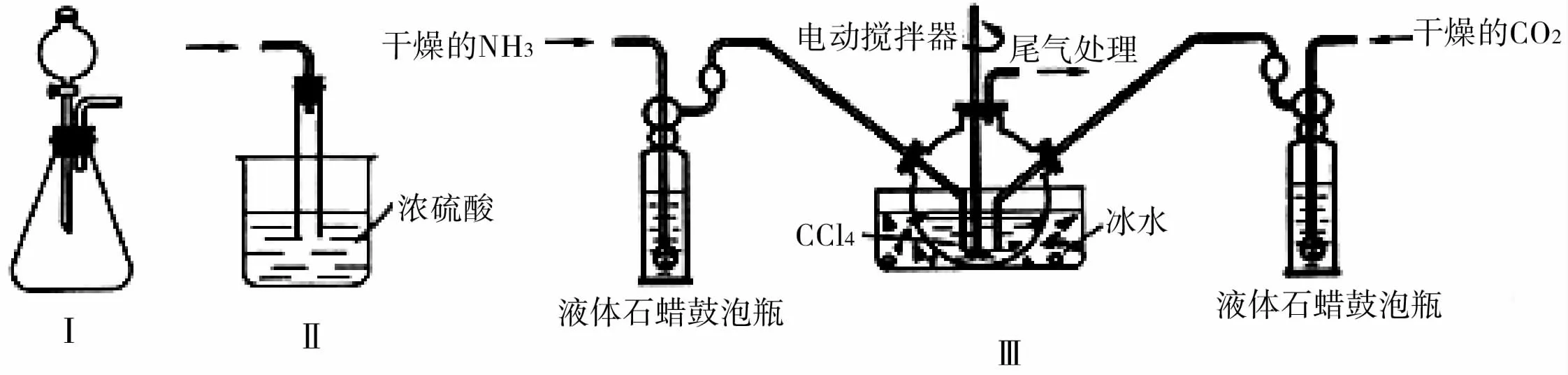
图5
(1)用如图5所示的装置Ⅰ制备NH3,则所选试剂为_____。
(2)用如图5所示的装置Ⅲ制备氨基甲酸铵,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。(注:四氯化碳与液体石蜡均为惰性介质。)
①从反应后的混合物中分离出产品的实验操作是____(填操作名称)。
②用如图5所示的装置Ⅱ进行尾气处理,则双通玻璃管的作用是____。
③液体石蜡鼓泡瓶的作用是_____。
④发生器用冰水冷却的原因是____。
Ⅱ.制备(NH2CH2COO)2Fe:装置如图6所示(夹持和加热仪器已省略),用CO2气体将装置中空气排净,加入药品后,滴入柠檬酸并加热。反应结束后过滤,将滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品。

图6
(3)烧杯中澄清石灰水的作用是____。
(4)柠檬酸可调节pH,体系pH 与产率的关系如表1。

表1
分析pH 过低,使产率下降的原因是_____;柠檬酸的作用还有____(填序号)。
a.作反应终点指示剂
b.防止二价铁被氧化
c.作催化剂
d.促进FeCO3溶解
(5)乙醇的作用是____。
(6)若产品的质量为mg,则产率为____。
16.CuSO4溶液与Na2CO3溶液混合时产生蓝绿色沉淀,某实验小组进行实验,探究蓝绿色沉淀的组成。
【查阅资料】
ⅰ.氢氧化铜是一种蓝色絮状沉淀,难溶于水,溶于酸、氨水等,受热会分解。
ⅱ.碳酸铜是蓝绿色粉末状固体,受热易分解,遇水转化为氢氧化铜和碱式碳酸铜的混合物。
ⅲ.碱式碳酸铜呈孔雀绿颜色,又叫孔雀石,难溶于水,溶于酸、氨水等,在空气中加热会分解。
【提出假设】
假设1:沉淀为Cu(OH)2。
假设2:沉淀为CuCO3。
假设3:沉淀为碱式碳酸铜[化学式可表示为xCuCO3·yCu(OH)2]。
(1)假设1中产生沉淀Cu(OH)2的离子方程式是____。
(2)甲同学认为假设2不成立,理由是_____。
【定性实验】
(3)实验小组同学将沉淀从溶液中分离并净化,取少量净化后的固体于试管中,滴加稀硫酸,观察到_____,证明假设3成立。
【定量实验】
为了确定碱式碳酸铜化学式中x 与y 的关系,实验小组称取净化后的蓝绿色固体m1g,使用如图7所示装置(夹持仪器未画出)进行实验。

图7
(4)B、C、D中的试剂依次为_____(填标号)。
a.澄清石灰水 b.碱石灰
c.氯化钙溶液 d.浓硫酸
(5)各装置接口的连接顺序:a→____(填字母序号)。
(6)装置D 的作用是_____。
(7)加热到固体完全分解,硬质玻璃管中得到黑色固体,其余产物被相应装置完全吸收。实验结束后,测得装置B 的质量增加m2g,则xCuCO3·yCu(OH)2中_____(列式表示)。若无D 装置,则的值____(填“偏大”“偏小”或“无影响”)。
17.三氯氧磷(POCl3)是重要的基础化工原料,广泛用于制药、染化、塑胶助剂等行业。某兴趣小组模拟PCl3直接氧化法制备POCl3,实验装置设计如图8所示。

图8
有关物质的部分性质如表2。
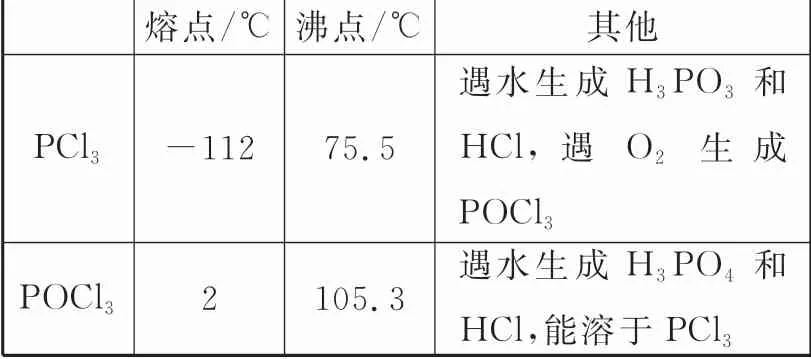
表2
回答下列问题:
(1)仪器a的名称是____,装置A 中发生反应的化学方程式为_____。
(2)装置B 的作用除观察O2的流速之外。还有____。
(3)装置C 中控制反应在60~65 ℃进行,其主要目的是____。
(4)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取x g 产品于锥形瓶中,加入足量NaOH 溶液,待完全反应后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·L-1的AgNO3溶液40.00mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL 硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用cmol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积V mL。
已 知:Ksp(AgCl)= 3.2 × 10-10,Ksp(AgSCN)=2×10-12。
①滴定选用的指示剂是_____(填标号),滴定终点的现象为____。
a.FeCl2b.NH4Fe(SO4)2
c.淀粉 d.甲基橙
②Cl元素的质量百分含量为(列出算式)____。
③步骤Ⅲ加入硝基苯的目的是____,如无此操作,所测Cl元素含量将会____(填“偏大”“偏小”或“不变”)。
18.青蒿素是一种有效的抗疟药。常温下,青蒿素为无色针状晶体,难溶于水,易溶于有机溶剂,熔点为156~157 ℃。提取青蒿素的方法之一是乙醚浸取法,提取流程如下:
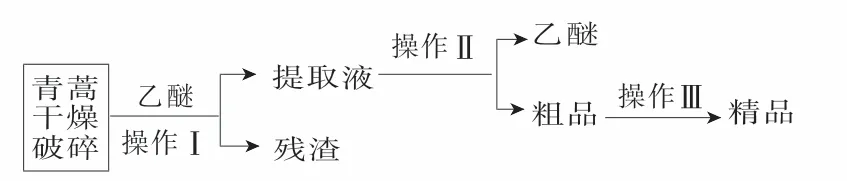
请回答下列问题:
(1)对青蒿进行破碎的目的是____。
(2)操作Ⅰ用到的玻璃仪器是_____,操作Ⅱ的名称是____。
(3)用图9所示实验装置测定青蒿素的化学式,将28.2g青蒿素放在燃烧管C 中充分燃烧。
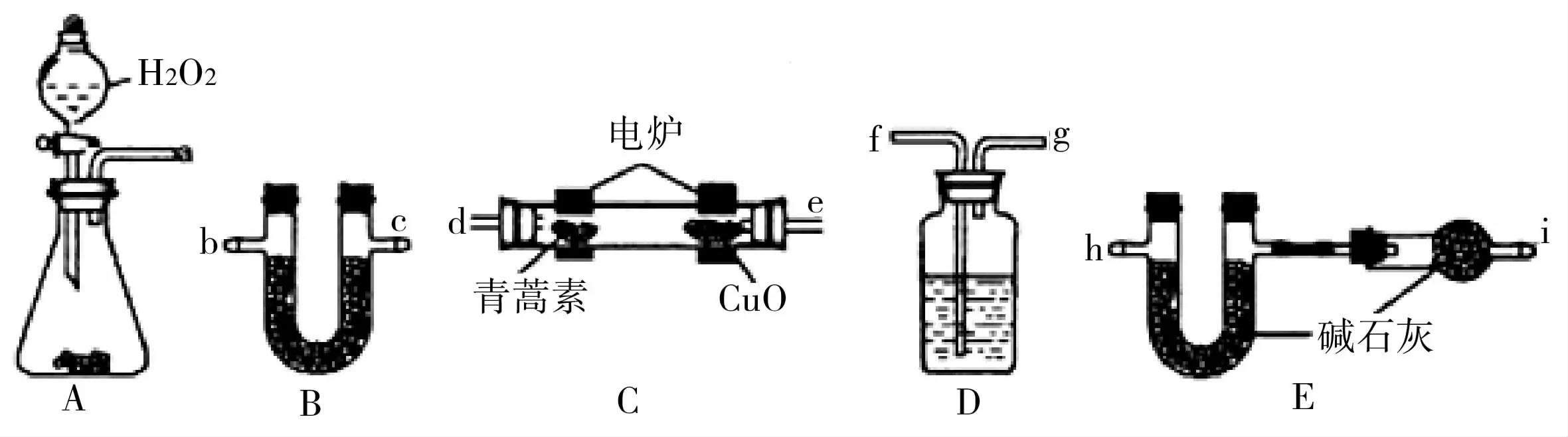
图9
①仪器各接口的连接顺序从左到右依次为_____(每个装置限用一次)。装置A 中发生的化学反应方程式为_____。
②装置C中CuO 的作用是_____。
③装置D 中的试剂为_____。
④已知青蒿素是烃的含氧衍生物,用合理连接后的装置进行实验.测量数据如表3。
则青蒿素的最简式为____。
(4)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解度较小,加热并搅拌,青蒿素的溶解度增大,且溶液红色变浅,与青蒿素化学性质相似的物质是_____(填字母代号)。
A.乙醇 B.乙酸
C.乙酸乙酯 D.葡萄糖

