高考化学实验专题测试(B卷)参考答案
1.B 提示:酸式滴定管下端无刻度,则50mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL 后,剩余盐酸体积大于20mL,A 项错误;碘易溶于酒精,可用酒精清洗碘,又由于酒精与水互溶,再用水清洗即可洗净,B项正确;湿润pH 试纸相当于稀释溶液,会造成醋酸钠溶液pH 偏低,C 项错误;容量瓶是定容容器,不能在容量瓶中溶解KMnO4固体,D 项错误。
点睛:选项C为解答的易错点,使用湿润的pH 试纸测定溶液pH,水稀释了被测溶液,如果溶液为中性则没有影响,如果溶液显酸性,则pH 测定值偏大,如果显碱性,测定值偏小,即使用湿润的pH 试纸测溶液pH的操作不规范,测试结果可能有误差,平时应该注意养成实验操作的规范性。
2.D 提示:胶头滴管不能伸入试管内,应垂直悬空,A 项错误;把试管放桌面上,用手拿橡皮塞硬往试管口按,易压破试管,应左手拿试管,离开桌面,右手拿橡皮塞稍稍用力转动塞入,B项错误;用pH 试纸测定未知溶液的pH 时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH 试纸上,与标准比色卡对比来确定pH,直接进入溶液会污染试剂,C项错误;检查装置气密性时关闭止水夹,从长颈漏斗注入水,长颈漏斗下端形成一段水柱,不再下降,说明装置气密性好,D项正确。
3.C 提示:广泛pH 试纸测得的pH 只能是整数,A 项不正确;焰色反应实验火焰呈黄色,则试样中一定含Na+,但是不能确定是否含K+,要确定是否含K+,必须透过蓝色的钴玻璃观察火焰是否呈紫色,B 项不正确;配制氯化铁溶液时,可将氯化铁溶解在较浓的盐酸中,然后再加水稀释,以抑制氯化铁水解,C 项正确;氯化钠溶液中混有少量硝酸钾,可经蒸发浓缩至有大量晶体析出,趁热过滤,冰水洗涤得较纯净氯化钠,D 项不正确。
点睛:由于氯化钠的溶解度随温度变化很小,把混有少量硝酸钾的氯化钠溶液蒸发浓缩、冷却结晶、过滤,只能得到少量的氯化钠(不可能是纯净的),大部分氯化钠仍溶在水中,氯化钠的产率太低。
4.D 提示:配制100g5%的NaCl溶液需要氯化钠质量为100g×5%=5g,配制100mL0.5 mol·L-1的NaCl溶液需要氯化钠 质量 为0.1 L×0.5 mol·L-1×58.5g·mol-1=2.9g,二者需要氯化钠的质量不相等,A 项错误;氯化钠溶液的密度大于1g·mL-1,100mL氯化钠溶液的质量大于100g,B项错误;配制一定质量分数的氯化钠溶液,需要用天平称量氯化钠的质量,用药匙取药品,用量筒量取水的体积,在烧杯内溶解,用玻璃棒搅拌,所需仪器有托盘天平、量筒、烧杯、玻璃棒、药匙等;配制一定体积一定物质的量浓度的氯化钠溶液,需要用天平称量氯化钠的质量,用药匙取药品,在烧杯内溶解,用玻璃棒搅拌,洗涤后移入100 mL 容量瓶,加水定容,距离刻度线1~2cm 改用胶头滴管滴加,配制需要的仪器有托盘天平、烧杯、玻璃棒、药匙、100 mL 容量瓶、胶头滴管等,两种配制需要的仪器不同,C 项错误;20 ℃时,NaCl溶液的密度大于1g·mL-1,则100mLNaCl溶液的质量大于100g,进而可以推断浓度大小,D 项正确。
5.C 提示:KCl 样品中含有少量K2CO3、K2SO4和不溶于水的杂质,为了提纯KCl,先将样品溶于适量水中,搅拌、过滤,再向滤液中加入过量的BaCl2溶液以除去SO2-4,过滤,得到的混合物X 中含有KCl、BaCl2,再加过量的K2CO3以除去Ba2+,过滤,得到的混合物Y 中含有KCl、K2CO3,再加适量的盐酸以除去CO2-3,再通过加热浓缩、蒸发结晶得KCl晶体。
6.A 提示:图1①所示装置用于过滤,粗盐提纯中泥沙不溶于水而氯化钠可溶,通过过滤除掉泥沙,选项A 正确;由MgCl2溶液制备无水MgCl2,由于氯化镁易水解,氯化氢易挥发,若将MgCl2溶液加热蒸干,最终得到的是MgO,应该在HCl气流中加热氯化镁溶液制取无水氯化镁,选项B错误;己烯含有碳碳双键,可与溴水发生加成反应,萃取时不可发生化学反应,选项C错误;制备乙烯时产生的碳与浓硫酸发生氧化还原反应生成的二氧化硫也能使酸性高锰酸钾溶液褪色,干扰乙烯的检验,选项D 错误。
7.C 提示:由流程分析可知,溶解烧渣选用足量硫酸,X 为铁粉,故A 项正确;由流程分析可知,固体1 中一定含有SiO2,调节pH 使铝离子完全生成氢氧化铝沉淀,则固体2为氢氧化铝,故B项正确;在溶液1中含有铁离子和铝离子,加过量的氢氧化钠,铝离子转化为偏铝酸根离子,铁离子与氢氧根离子结合生成氢氧化铁沉淀,所以最终得到的是硫酸铁而不是硫酸亚铁,故C项错误;亚铁离子易被空气中的氧气氧化,而且受热易失去结晶水,所以从溶液2 得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解,故D 项正确。
8.B 提示:柠檬烯不溶于水,密度比水小,因此当馏出液无明显油珠,澄清透明时,说明蒸馏完成,A 项正确;蒸馏结束后,先把乙中的导气管从溶液中移出,再停止加热,B项错误;长玻璃管与大气相通,能够起到平衡气压的作用,防止由于导管堵塞引起爆炸,C项正确;得到的精油中含有其他成分,想要得到柠檬烯,要进行萃取、分液、蒸馏操作才能实现目的,D 项正确。
9.D 提示:浓盐酸与MnO2在加热时发生反应产生Cl2,该装置未加热,反应不能发生,故A 项错误;把浓氨水滴加在生石灰上,由于CaO 与水发生反应,消耗水,产生的Ca(OH)2溶解放热,会加速氨水的分解,产生氨气,把氨气通入到A1Cl3溶液中,发生反应 Al3++3NH3+3H2══O 3NH+4+Al(OH)3↓,因为NH3·H2O 是弱碱,不能溶解产生的Al(OH)3沉淀,因此现象有误,故B项错误;把醋酸加入到碳酸钙中,发生反应2CH3COOH+CaCO3══(CH3COO)2Ca+H2O+CO2↑,把气体通入到BaC12溶液中时,因为酸性HCl>H2CO3,所以不会发生反应,试管中不会出现浑浊现象,故C 项错误;浓硝酸在常温下与Cu 发生反应Cu+4HNO3(浓══) Cu(NO3)2+2NO2↑+2H2O,3NO2+H2══O 2HNO3+NO,O2+2NO══2NO2,NO2是红棕色的气体,故D项正确。
10.B 提示:HCl、NaCl和Na2SO4两两混合均没有明显现象,不加其他试剂无法鉴别,故A 项错误;B组内四种物质的溶液两两混合时,其中有一种溶液与其他三种溶液混合时出现一次白色沉淀和一次放出气体,该溶液为碳酸钠溶液,与碳酸钠溶液产生气体的溶液为盐酸,产生白色沉淀的为BaCl2,与碳酸钠溶液混合无任何明显现象的为氢氧化钠溶液,故不加其他试剂可以鉴别,B 项正确;C组中Ba(NO3)2与Na2SO4混合产生白色沉淀,其他物质两两混合均没有明显现象,故不加其他试剂无法鉴别,C 项错误;D 组内四种物质的溶液两两混合时,BaCl2、Ca(NO3)2和Na2CO3溶液与反应均能产生白色沉淀,但其余两两混合均没有明显现象,故不加其他试剂无法鉴别,D 项错误。
11.A 提示:用标准的KOH 溶液滴定未知浓度的盐酸,若配制标准溶液的固体KOH 中混有NaOH 杂质,由于氢氧化钠的摩尔质量较小,则所配标准溶液中OH-浓度较大,滴定时消耗标准溶液体积偏小,所以测定结果偏低,A 项正确;用c1mol·L-1酸性高锰酸钾溶液滴定V2mL 未知浓度的H2C2O4溶液,至滴定终点,用去高锰酸钾溶液体积为V1mL,由两者反应中化合价升降总数相等(或电子转移守恒)可得到关系式5H2C2O4~2KMnO4,则n (H2C2O4)=2.5n(KMnO4)=2.5×V1mL×c1mol·L-1,所以 H2C2O4溶 液 的 浓 度 为不正确;用未知浓度的盐酸滴定已知浓度的NaOH 溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,则未知盐酸的体积偏小,导致测定结果偏高,C项不正确;滴定管的读数要精确到0.01mL,D 项不正确。
12.A 根据实验现象可以判断电解时阳极放出氯气和氧气,则电极反应式为2Cl--2e-══Cl2↑,4OH--4e-══O2↑+2H2O,A 项错误;根据实验②③得出,O2能使酸性的KI-淀粉溶液变蓝,不能使中性的KI-淀粉溶液变蓝,空气也不能使酸性的KI-淀粉溶液变蓝,所以反应物的浓度和溶液的pH 会影响物质的氧化性,B 项正确;根据实验得出,阳极依次发生2Cl--2e-Cl2↑,4OH--4e-══O2↑+2H2O,将气体通入中性的KI-淀粉溶液中,溶液变蓝,说明氯气氧化碘化钾,所以氧化性Cl2>O2,C 项正确;用足量NaOH 溶液充分洗气,气体体积减少,即氯气被吸收,反应的离子方程式为2OH-+Cl2══Cl-+ClO-+H2O,D 项正确。
13.A 提示:草酸分解生成二氧化碳和一氧化碳、水,用硫酸铜固体检验水蒸气,然后用石灰水检验二氧化碳,用氢氧化钠吸收二氧化碳,用浓硫酸吸收水蒸气,让一氧化碳和氧化铜反应生成铜和二氧化碳,再用石灰水检验二氧化碳。实验开始时,先点燃A 装置处的酒精灯,排出装置中的空气,一段时间后点燃F装置处的酒精灯,故A 项正确;B装置中的现象应为白色粉末变蓝,说明分解产物中有水生成,故B项错误;G 装置中澄清石灰水变浑浊,可知F 中一氧化碳还原氧化铜生成二氧化碳,说明分解产物中有CO 生成,故C项正确;根据以上分析可知C、D、E 装置中分别盛放澄清石灰水、浓硫酸、氢氧化钠溶液,故D 项正确。
14.C 提示:①蒸馏时,应先通冷凝水,再点燃酒精灯加热,故①错误;②加热氯酸钾和二氧化锰的混合物制备氧气,用排水法收集气体后,为防止液体倒吸炸裂试管,应该先移出导管,后撤酒精灯,故②正确;③制取气体时,一定要先检查装置气密性,后装药品,故③正确;④分液操作时,先打开分液漏斗上口的塞子,使内外压强相通,再打开分液漏斗的旋塞,故④正确;⑤做H2还原CuO 实验时,为防止爆炸要先验纯后点燃,故⑤正确;⑥托盘天平的砝码在加取时,先放质量较大的砝码,后放质量较小的砝码,故⑥错误;⑦蒸馏时加热一段时间,发现忘记加沸石,应冷却后再补加沸石,再继续加热,故⑦错误。
15.(1)浓氨水和生石灰 (2)①过滤 ②防止倒吸 ③通过观察气泡,调节氨气和二氧化碳通入比例 ④降低温度,提高反应物转化率 (3)判断装置中空气是否排尽 (4)H+会与甘氨酸反应 bd (5)降低甘氨酸亚铁在水中的溶解度,提高产率×100%
提示:该装置为固液不加热型制备NH3,则所选试剂可以为浓氨水和生石灰(或浓氨水和固体氢氧化钠等)。
(2)①生成的氨基甲酸铵小晶体悬浮在四氯化碳中,分离互不相溶的固体和液体应采用过滤方法;②双通玻璃管的作用是防止液体倒吸;③液体石蜡鼓泡瓶的作用是控制反应进行的程度,控制气流流速和原料气体的 配 比;④2NH3(g)+CO2(g)NH2COONH4(g) ΔH <0是放热反应,降低温度平衡正向进行,温度升高,发生器用冰水冷却可降低温度,提高反应物转化率。
(3)烧杯中澄清石灰水的作用是判断装置中空气是否排尽,若产生沉淀,则需要继续通CO2排空气,以免对实验产生干扰。
(4)pH 过低使产率下降的原因是H+会与甘氨酸中的氨基反应,柠檬酸具有强酸性和还原性,作用有防止二价铁被氧化,促进FeCO3溶解。
(5)因为甘氨酸亚铁易溶于水,难溶于乙醇,故乙醇的作用是降低甘氨酸亚铁在水中的溶解度,提高产率和纯度。
(6)若产品的质量为m g,碳酸亚铁过量,0.20 mol 甘氨酸完全反应,生成0.10mol(NH2CH2COO)2Fe,其质量为100%。
16.(1)Cu2++CO2-3+H2══O Cu(OH)2↓+CO2↑ (2)碳酸铜遇水会发生双水解,转化为氢氧化铜和碱式碳酸铜的混合物 (3)蓝绿色沉淀溶解,产生气泡,溶液呈蓝色 (4)adb (5)c→b→d (6)防止空气中的二氧化碳进入装置B,影响测定结果
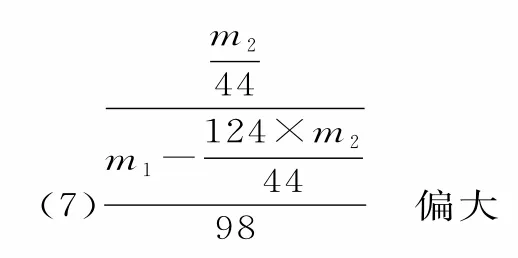
提示:(1)假设1 中产生沉淀Cu(OH)2的离子方程式是Cu2++CO2-3+H2══O Cu(OH)2↓+CO2↑。
(2)甲同学认为假设2不成立,理由是碳酸铜遇水转化为氢氧化铜和碱式碳酸铜的混合物。
(3)实验小组同学将沉淀从溶液中分离并净化,取少量净化后的固体于试管中,滴加稀硫酸,观察到蓝绿色沉淀溶解,产生气泡,溶液呈蓝色,证明假设3成立。
(4)装置C 用来吸收水蒸气,装置B 用来吸收二氧化碳,装置D 用来吸收空气中的二氧化碳,所以装置B、C、D 中的试剂依次为a、d、b。
(5)各装置接口的连接顺序:a→c→b→d。
(6)装置D 的作用是防止空气中的二氧化碳进入装置B而影响测定结果。
17.(1)冷凝管(或球形冷凝管) 2Na2O2+2H2══O 4NaOH+O2↑(或(2)平衡气压、干燥O2(或平衡气压和除去水,防止PCl3和POCl3遇水反应引入杂质) (3)加快反应速率,同时防止PCl3气化,逸出损失 (4)①b
提示:本题主要考查PCl3直接氧化法制备POCl3的探究实验。
(1)仪器a的名称是冷凝管(或球形冷凝管),装置A 中产生氧气,发生反应的化学方程式 为2Na2O2+2H2══O 4NaOH+O2↑(或2H2O2
(2)装置B的作用除观察O2的流速外,还有平衡气压、干燥O2(或平衡气压和除去水,防止PCl3和POCl3遇水反应引入杂质)。
(3)装置C 中控制反应在60~65 ℃进行,其主要目的是加快反应速率,同时防止PCl3气化,逸出损失。
(4)①过量NH4SCN 溶液遇Fe3+变红,所以滴定选用的指示剂是b,滴定终点的现象为溶液刚好变为红色,且半分钟内不褪色。
②C1 元素的质量百分含量为(0.1000mol·L-1×40.00×10-3L-cV×10-3mol)×35.5 g· mol-1÷x g=
③步骤Ⅲ加入硝基苯的目的是防止在滴加NH4SCN 时,将AgCl沉淀转化为AgSCN沉淀,导致多消耗NH4SCN 溶液,若无此操作,所测Cl元素含量将会偏小。
18.(1)增大青蒿与乙醚的接触面积,提高青蒿素的浸取率 (2)漏斗、玻璃棒、烧杯 蒸馏 (3)①a、f、g、d、e、b、c、h、i 2H2O2②使青蒿素充分氧化生成CO2和H2O ③浓硫酸 ④C15H22O5(4)C
提示:(1)对青蒿进行破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸取率。
(2)操作Ⅰ是过滤,用到的玻璃仪器是漏斗、玻璃棒、烧杯,操作Ⅱ将乙醚溶液中的乙醚分离出来,其名称是蒸馏。
(3)①装置A 产生的氧气需要经过装置D 干燥,纯净的氧气进入装置C,产生的水蒸气被装置B 吸收,二氧化碳被装置E 吸收,仪器各接口的连接顺序从左到右依次为a、f、g、d、e、b、c、h、i。装置A中发生反应 的化学方程式为
②装置C 中CuO 的作用是使青蒿素充分氧化生成CO2和H2O。
③装置D 中的试剂为干燥剂浓硫酸。
④装置B 吸收水42.4g-22.6g=19.8g,其中含氢2.2 mol,即2.2g,E 吸收二氧化碳66g,其中含碳1.5mol,即18g,28.2g青蒿素含氧8g,即0.5mol,则青蒿素的最简式为C15H22O5。
(4)在含有NaOH、酚酞的水溶液中,乙酸乙酯水解,生成物乙酸与氢氧化钠反应使溶液红色变浅,所以与青蒿素化学性质相似的物质是乙酸乙酯。

