ACO患者血清Fbg、FeNO、IgE水平变化与肺功能相关性研究
赵明明 葛林阳 杭燕萍
在我国,支气管哮喘和慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)都属于发病率较高的气道阻塞性肺疾病,并且部分患者会出现哮喘和慢阻肺共存的情况,临床上将其定义为哮喘-慢阻肺重叠综合征(asthma-chronic obstructive pulmonary disease overlap syndrome, ACO),尤其多见于80岁以上的老年人群[1]。2014年,支气管哮喘全球倡议修订版[2]中首次提出ACO的概念,但是并未明确其诊断标准和治疗方案,目前临床上依然是根据2012年提出的一项共识[3],在确诊为COPD的基础上,将呼出气一氧化氮(fractional exhaled nitrie oxide, FeNO)作为其中一项最主要的诊断指标。FeNO不仅与机体特异性反应、气道高反应性密切相关,同时众多研究还发现与患者血浆、痰液、支气管肺泡灌洗液中的免疫球蛋白E(immunoglobulin E, IgE)浓度也有关[4]。IgE作为免疫球蛋白家族成员之一,主要介导速发型变态反应,参与气道炎症反应和气道重塑过程[5]。FeNO和IgE作为ACO生物标志物已得到普遍认可,但是与各项肺功能指标的相关性尚无统一结论。除此以外,由于受到反复感染、缺氧等因素的影响,哮喘和慢阻肺患者均存在不同程度的凝血功能异常。但是鲜少见到关于ACO纤溶状态的相关研究。纤维蛋白原(fibrinogen, Fbg)是一种具有凝血功能、可反映血流动力学状态的蛋白分子。有研究认为Fbg可预测慢阻肺患者急性加重的发生风险[6]。但其是否可作为评估ACO疾病进展的分子指标以及与肺功能的关系尚缺乏相关研究。因此本文对ACO患者血清中Fbg、FeNO、IgE水平变化以及与肺功能的相关性进行探讨,旨在为指导临床个体化治疗提供理论依据。
资料与方法
一、临床资料
选择2016年1月至2018年5月期间在我院呼吸内科住院治疗的哮喘、COPD及ACO患者共152例,其中男性患者84例,女性患者68例,年龄为42~89岁,平均年龄为65.42岁。其中支气管哮喘急性发作期患者56例,COPD急性加重期患者51例,ACO急性加重期患者45例。另外选取同时期在我院体检中心进行体格检查的健康研究对象50例作为对照组,其中男性25例,女性25例,年龄40~85岁,平均年龄为(63.71±7.49)岁。本项研究获得本院伦理委员会批准,且入选患者均获知情同意。
二、入选和排除标准
1. 入选标准:根据指南诊断明确入选标准: (1)支气管哮喘患者:符合中华医学会呼吸病学分会哮喘学组制定的《支气管哮喘防治指南》(2008年版)[7]关于支气管哮喘急性发作期的诊断标准;(2)COPD患者:符合《慢性阻塞性肺疾病诊治指南(2013年修订版)》[8]关于COPD急性加重期的诊断标准;(3)ACO患者:根据2012年发表的西班牙专家共识关于COPD-哮喘重叠综合征急性加重期的诊断标准,主要标准:①支气管舒张剂反应性≥15%,且较基线值改善≥400 m;②痰嗜酸性粒细胞浸润;③既往已确诊为支气管哮喘。次要标准:①COPD患者血清总IgE升高;②有过敏史;③至少2次支上述2条主要标准,或者1条主要标准+2条次要标准则可诊断为ACO。(4)精神状态正常,神志清楚,无沟通障碍者。
2. 排除标准: ①不符合上述诊断标准的患者;②入组前1个月内有糖皮质激素治疗史者;③合并肺栓塞、肺间质纤维化、活动性肺结核史者;④入组前1个月内发生其他感染症状者或大便常规有寄生虫者;⑤合并其他血液系统,消化系统疾病,严重心、肝、肾或全身疾病,恶性肿瘤患者;⑥近半年内接受过大手术治疗者。
三、研究方法
所有患者由我科室同一主治医师领导小组完成血液样本的采集、生化指标检测、肺功能检查、FeNO检测。检测方法如下:
1. 血液样本采集: 所有患者于确诊当天、健康对照组于查体当天采集3 ml肘静脉血,以离心半径8 cm,3 000 r/min离心10 min,取血清,检测血液生化指标。
2. 生化指标检测: 采用SYSMEX XS-800i全自动血液细胞分析仪(日本希森美康公司)检测外周血嗜酸性粒细胞计数。使用免疫散射比浊法测定,采用BN2全自动特种蛋白分析仪(德国西门子公司)测定血清总IgE。采用SYSMEX CA-7000全自动血凝仪(日本希森美康公司)检测血浆Fbg水平。严格按照仪器操作手册进行操作,所有检测在2 h内完成。
3. 肺功能检查: 采用FGC-A+型全自动肺功能测试仪测试所有患者的肺部功能指标,包括1 s用力呼气容积(forced expiratory volume in one second, FEV1),用力肺活量(forced vital capacity, FVC),FEV1/FVC。FEV1/FVC<70%为气流受限。患者吸入沙丁胺醇200~400 μg后测定肺功能,具体方法严格按照试剂盒说明书进行。另外,ACO患者进行肺功能检查时均进行舒张试验。若FEV1≥12%,且较基线值改善≥200 ml或FEV1≥15%,且较基线值改善≥400 ml则为阳性。
4. FeNO检测: 受试者取坐位,进行最大呼气,将过滤器迅速含入嘴中,呼气至最大肺活量,采用NIOX一氧化氮测定仪(瑞典尼尔斯公司)检测FeNO(ppb)(1 ppb= 1×10-9mo1/L),立即以持续50 ml/s的速率呼气10 s,进行3次,取平均值。
四、统计学方法

结 果
一、受试者一般资料比较
四组受试者的年龄、性别、吸烟史、体重量指数(body mass index, BMI)比较基本一致,无统计学差异(P<0.05),见表1。
二、受试者血液生化资料比较
哮喘组、COPD组和ACO组患者嗜酸性粒细胞数量和血浆IgE水平明显高于对照组,差异有统计学意义(P<0.05);但是三组患者之间比较,未见统计学差异(P>0.05)。另外,ACO患者血清Fbg水平与COPD患者基本一致(P>0.05),但是高于对照组和哮喘组受试者,差异有统计学意义(P<0.05)。而ACO组患者FeNO检测值与支气管哮喘组患者基本一致,未见统计学差异(P>0.05),但是均高于COPD患者,差异有统计学意义(P<0.05),见表2。

表1 受试者一般资料分析
注:与对照组比较,aP<0.05;与哮喘组比较,bP<0.05;与COPD组比较,cP<0.05
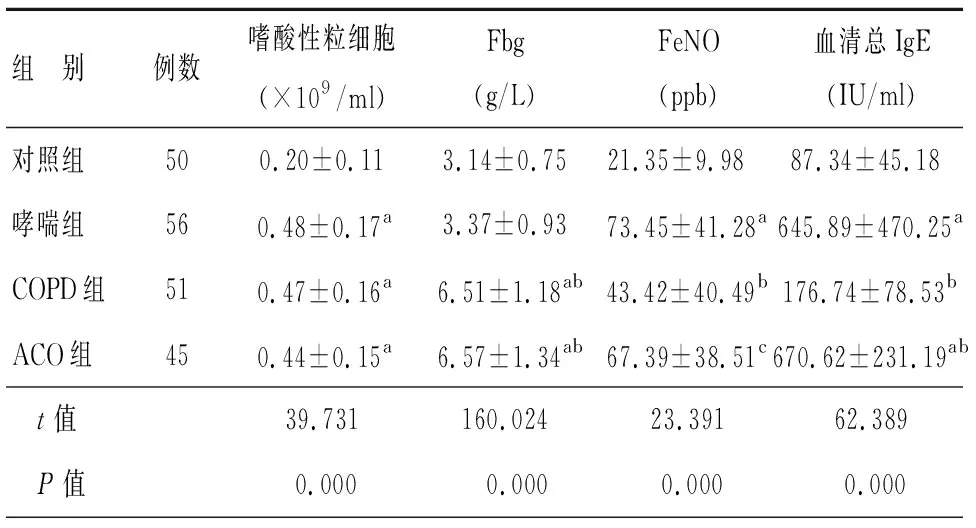
表2 受试者的血液生化资料比较
注:与对照组比较,aP<0.05;与哮喘组比较,bP<0.05;与COPD组比较,cP<0.05
三、受试者肺功能指标比较
ACO患者FEV1、FEV1改善值和FVC值明显高于对照组和COPD组受试者,但是FEV1值高于哮喘组患者,而FEV1改善值和FVC值低于哮喘组患者,差异有统计学意义(P<0.05)。另外,哮喘组、COPD组和ACO组患者FEV1/FVC虽然明显低于对照组,但是三组患者之间未见统计学差异(P>0.05),见表3。
四、ACO组患者Fbg、FeNO、IgE与肺功能的关系
ACO患者血浆Fbg水平与FEV1、FEV1改善值和FVC值均呈负相关性(P<0.05),而FeNO值仅与FEV1值呈负相关性(P<0.05)。而血浆IgE水平与FEV1改善值呈正负关性(P<0.05),见表4。

表3 受试者肺功能指标比较
注:与对照组比较,aP<0.05;与哮喘组比较,bP<0.05;与COPD组比较,cP<0.05

表4 ACO患者Fbg、FeNO、IgE与肺功能的关系
五、Fbg、FeNO、IgE 3项指标对ACO诊断的ROC曲线
以Fbg、FeNO、IgE和Fbg+FeNO+IgE作为测试变量,以临床诊断作为状态变量,绘制ROC曲线,结果显示Fbg+FeNO+IgE在诊断ACO时其灵敏度、特异度、诊断准确率以及AUC 均显著高于单一指标诊断效能(P<0.05),见表5和图1。

图1 hs-CRP、PCT、PTX3 3项指标单独及联合对AECOPD诊断的ROC曲线

表5 入选受试者肺功能指标比较
讨 论
支气管哮喘和COPD都是目前临床上常见的呼吸系统疾病,以气道慢性炎症反应和气道高反应性为主要特征,不同的是,支气管哮喘呈广泛多变的可逆性气流受限,而COPD主要以气流受限不完全可逆且肺部组织进行性破坏为特征[9]。但是在实际临床中,部分支气管哮喘患者可能也会存在不可逆的气流受限的情况,而部分COPD患者也可能对支气管舒张剂治疗反应很好,出现部分可逆的现象,对于这部分疾病重叠的患者,全球慢性阻塞性肺疾病防治创议(GOLD)和全球哮喘防治创议(GINA)将其定义为哮喘-慢性阻塞性肺疾病重叠综合征(ACO)[10]。目前临床上对于ACO的定义和诊断标准较为模糊,主要依据患者支气管舒张实验呈强阳性,嗜酸性粒细胞数量增多等指标进行判断。易与支气管哮喘或COPD混淆,造成漏诊、误诊,从而延误治疗。在本项研究中,我们也发现虽然三组患者外周血嗜酸性粒细胞数量明显高于健康对照组,但是三组患者之间未见统计学差异,说明支气管哮喘、COPD、ACO都属于气道慢性炎症反应,单纯依靠嗜酸性粒细胞数量作为诊断依据特异度较低。
IgE属于一类介导速发型变态反应的免疫球蛋白,正常情况下,血清中IgE水平<100 IU/ml,但是其表达易受到多种因素的影响[11]。国内外诸多研究证实,支气管哮喘急性发作期血浆中IgE水平明显高于缓解期[12]。若哮喘发作频率增加,导致气道重塑,则ACO的发生率也会大大升高。IgE抗体通过与嗜酸性粒细胞、肥大细胞等效应细胞表面IgE受体结合,启动气道慢性炎症反应的发生,最终逐渐导致气道重塑[13]。IgE参与的生物学效应极其复杂,不仅与气道炎症反应和气道高反应性有关,也是过敏性变态反应中一类关键的中间产物和生物标记物。因此,在本项研究中,我们也发现,虽然支气管哮喘、COPD和ACO急性加重期患者血浆中IgE水平均高于健康对照组,但是支气管哮喘组和ACO患者IgE水平则同时高于COPD患者,而且气管哮喘组和ACO患者IgE水无统计学差异,说明单纯依靠外周血IgE水平无法鉴别支气管哮喘和ACO加重期患者。
同样,FeNO水平与机体的特异性反应、气道高反应性、支气管舒张可逆性也密切相关,被普遍认为是支气管哮喘诊断和鉴别的主要工具[14]。本文也发现,虽然支气管哮喘、COPD和ACO患者FeNO检测结果明显高于健康对照组受试对象,但是ACO组患者FeNO检测值与支气管哮喘组患者基本一致,COPD患者相对较低,故FeNO不能作为ACO和支气管哮喘的鉴别指标。说明ACO和支气管哮喘急性加重期患者存在类似的气道炎症反应。
以往大多数研究和专家共识只是关注FeNO、IgE与ACO以及肺功能的关系,往往忽略血流动力学指标的变化。支气管哮喘、COPD和ACO患者在缺氧、二氧化碳潴留、反复感染等因素影响下,机体会出现不同程度凝血功能和纤溶系统失衡。Fbg作为一类含量较多的血浆纤维蛋白原,在炎症急性发作时明显升高,其可能是哮喘、COPD急性加重的重要机制之一[15]。本项研究发现,支气管哮喘、COPD和ACO患者血浆Fbg水平明显高于健康对照组,而且,ACO患者Fbg水平与支气管哮喘和COPD患者之间也存在较大差异,说明ACO加重期患者相较于其余两组患者具有更严重的高凝与血栓前状态。这可能是相较于单纯支气管哮喘或者COPD患者,ACO患者体内水分流失更严重,造成血流缓慢,凝血因子清除和抗凝蛋白合成减少,从而进一步加重血液高凝状态。本文证实,Fbg与ACO患者肺功能指标的相关性比FeNO和IgE更高,但Fbg联合FeNO和IgE对诊断ACO的灵敏度和特异度均显著高于单一指标诊断效能。
综上所述,Fbg联合FeNO和IgE有助于鉴别ACO、支气管哮喘以及COPD,从而为临床诊断和治疗方案的选择提供指导依据。

