斯钙素-1在慢性阻塞性肺疾病平滑肌增殖中的作用研究
许家艳 杨 捷 乔云飞 杨俊俊 徐兴祥
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是一种常见的以持续气流受限为特征的疾病[1],气道重塑是导致气流受限的重要病理学改变,这也是COPD患者病变无法逆转的重要原因之一[2]。气道重塑主要表现为气道平滑肌增殖、基质胶原沉积、上皮下纤维化、上皮间充质转化、杯状细胞增生、网状基底膜增厚等病理改变[3]。在这些病理变化中,气道平滑肌的改变被认为是导致COPD气道重塑形成的关键因素。气道平滑肌可表达和释放多种细胞因子及蛋白酶类,如转化生长因子-β(transforming growth factor-β, TGF-β)、基质金属蛋白酶9(matrix metalloproteinase-9, MMP-9)等,这些因子在COPD气道重塑中发挥了主要作用,研究表明,这些因子的表达调控涉及钙离子的参与[4]。与此同时,有研究指出尼古丁可通过诱导钙离子内流促进平滑肌细胞增殖[5]。上述研究表明,细胞内钙离子水平与COPD气道重塑形成密切相关。
斯钙素-1(stanniocalcin-1, STC1)是一种新近发现的能够抑制钙离子内流的分泌型糖蛋白[6-8],在肺内可表达于支气管上皮细胞。结合课题组前期研究发现STC1能够抑制支气管上皮细胞间充质转化,提示STC1可能通过抑制钙离子内流抑制平滑肌增殖,在COPD气道重塑的形成过程中发挥保护性作用[9-10]。本研究拟通过体内及体外研究,探索STC1在COPD中的表达情况及其对气道平滑肌增殖的影响。
材料与方法
一、实验材料
人原代平滑肌细胞(HASMCs)来源于美国Sciencell公司。胎牛血清(FBS)购自美国Sciencell公司。STC1抗体购自美国Genetex,α-平滑肌动蛋白(α-SMA)购自英国Abcam。人重组STC1蛋白购自捷克biovendor。
二、实验动物及分组
实验动物为选取6周体重约18~22 g的SPF级BALB/c雌性小鼠24只,将小鼠随机分为4组:1周空气对照组(简称1周空气组)、1周臭氧暴露组(简称1周臭氧组)、3周空气对照组(简称3周空气组)、3周臭氧暴露组(简称3周臭氧组)。每组6只,分笼饲养。
三、实验方法及检测指标
1. 动物模型的制备: 将BALB/c小鼠适应性饲养1周后,将臭氧暴露组小鼠暴露在臭氧发生器(南京沃环臭氧科技有限公司,V8016Z)中3 h,臭氧浓度控制在2.5~3.0 ppm,每周3次,1周臭氧组共1周,3周臭氧组共3周。将空气对照组小鼠暴露在正常的空气中。
2. 肺组织病理检测: 取各组小鼠左肺中叶肺组织迅速放4%多聚甲醛液中固定,脱水,石蜡包埋,切片,然后用苏木精-伊红(hematoxylin-eosin, HE)染色,光学显微镜观察。
3. 免疫组化检测α-ASM及STC1的表达及分布: 将肺组织用4%多聚甲醛固定24 h,经梯度酒精脱水后石蜡包埋,切片机制作厚度0.4 mm石蜡切片,并将其固定于载玻片上;烘片后依次以枸橼酸盐微波抗原修复及3%的过氧化氢溶液室温各10 min,PBS 溶液洗涤3次;10%山羊血清37 ℃孵育1 h,加一抗过夜; 以生物素标记的二抗37℃孵育1 h,PBS 缓冲液洗涤3次;DAB显色,控制时间; 以自来水终止显色;苏木精染色1 min;再以自来水冲洗,盐酸酒精分化,冲洗,PBS返蓝20 min镜检;脱水,透明,树脂封片。Image-pro plus 6. 0软件分析免疫组化图片: 每组切片随机挑选5个200或者400倍视野进行拍照。α-ASM、STC1抗原阳性染色为胞质棕黄色。应用Image-pro plus 6. 0 软件对每张照片进行分析得出每张照片阳性的累积光密度值( IOD值)。
4. EdU染色检测平滑肌细胞增殖: 按照说明书进行。
四、统计学方法

结 果
一、COPD小鼠支气管上皮基底膜增厚
HE染色显示1周及3周臭氧组小鼠肺泡间隔距(平均线性截距LM)较空气组均明显增大(图1,**P<0.01,***P<0.001),且3周臭氧组小鼠肺泡间距较1周臭氧组进一步增大,差别有统计学意义(图1,*P<0.05)。说明臭氧暴露小鼠成功诱导肺气肿。同时,臭氧暴露小鼠显示支气管周围炎症细胞浸润、杯状细胞增生、支气管壁明显增厚(图2)。较空气组及1周臭氧组相比,3周臭氧组小鼠基底膜均明显增厚,差别有统计学意义(图2,均*P<0.05)。
二、臭氧暴露小鼠肺组织α-SMA表达增加
免疫组化染色显示3周臭氧组小鼠肺组织平滑肌细胞标志物α-SMA表达较空气组及1周臭氧组均明显增加,差别有统计学意义(图3,**P<0.01)。
三、臭氧暴露小鼠支气管上皮STC1表达增加
免疫组化染色显示STC1主要表达于小鼠支气管上皮顶端膜,1周及3周臭氧组小鼠支气管上皮STC1表达较空气组均明显增大,差别有统计学意义(图4,*P<0.05)。但3周臭氧组较1周臭氧组支气管上皮STC1表达无明显差异。

图1 小鼠病理学检测结果;注:A: 1周空气组和1周臭氧组;B: 3周空气组和3周臭氧组(HE×200)。*P<0.05,**P<0.01,***P<0.001

图2 小鼠基底膜厚度;注:A:1周空气组和1周臭氧组;B:3周空气组和3周臭氧组(HE×200) ;箭头指示基底膜。*P<0.05

图3 小鼠肺组织中α-SMA的表达水平;注:A:1周空气组和1周臭氧组;B:3周空气组和3周臭氧组(HE×400) ;箭头指示α-SMA表达部位。 **P<0.01

图4 小鼠支气管上皮STC1的表达水平;注:A:1周空气组和1周臭氧组;B:3周空气组和3周臭氧组(HE×200) ;箭头指示STC1表达部位。 *P<0.05

图5 小鼠肺组织中STC1/α-SMA的水平。 *P<0.05
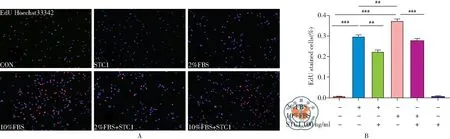
图6 STC1对平滑肌细胞增殖的影响;注:A:Edu染色检测STC1对平滑肌增殖的影响;B:SPSS20.0计算EdU染色。**P<0.01,***P<0.001
四、臭氧暴露小鼠肺组织中STC1/α-SMA的水平
计算上述免疫组化染色肺组织STC1相对于α-SMA表达,结果显示:与空气组相比,1周臭氧组小鼠肺组织STC1表达较α-SMA升高,随时臭氧暴露时间延长,3周臭氧组小鼠肺组织STC1表达较α-SMA下降,且与1周臭氧组相比,3周臭氧组小鼠肺组织STC1表达较α-SMA明显下降,差别有统计学意义(图5,*P<0.05)。
五、STC1对平滑肌细胞增殖的影响
EdU染色显示2%FBS及10%FBS均成功诱导平滑肌细胞增殖,且10%FBS效应更明显,差别有统计学意义(图6,**P<0.01,***P<0.001)。外源加入STC1重组蛋白均抑制了2%FBS及10%FBS诱导的平滑肌增殖,差别有统计学意义(图6,**P<0.01,***P<0.001),STC1本身对平滑肌增殖无效应。
讨 论
本文结果显示,与既往研究相同,臭氧暴露小鼠显示肺部炎症、肺气肿及气道重塑(肺组织基底膜增厚及平滑肌细胞标志物α-SMA表达增加)等COPD典型特征。在此模型基础上,我们首次发现STC1在COPD小鼠支气管上皮中表达升高,但随着臭氧暴露3周,肺组织STC1表达较α-SMA下降。进一步发现,外源加入rhSTC1能够抑制平滑肌细胞增殖。结合前期研究,显示STC1能够抑制上皮间充质转化(EMT)发生,提示STC1 在COPD气道重塑中发挥一定作用。
气道重塑是由于肺组织反复损伤修复导致气道壁结构改变,涉及多种细胞,包括上皮杯状细胞增生、上皮下胶原沉积及纤维化、网状基底膜增厚和气道平滑肌细胞增殖等,在COPD中造成不可逆的气流受限,患者肺功能下降。其中,气道平滑肌在气道重塑过程中发挥重要作用。平滑肌细胞发生增生、肥大、迁移,同时表达和释放多种细胞因子、生长因子和蛋白酶类导致上皮下基底膜增厚及细胞外基质沉积,引起气道重塑[3]。近年来相关研究表明,GOLD3和4级的COPD患者其平滑肌数量增加接近50%,且与肺功能呈明显负相关。本研究中,臭氧暴露小鼠显示杯状细胞增生、支气管壁增厚、基底膜增厚、平滑肌细胞增殖等气道重塑改变。
研究表明,气道平滑肌增殖与多种信号通路有关,主要包含 EGFR、PDGF、 TGF-β[11],近年来发现,钙离子信号也是其机制之一,且钙离子参与TGF-β的表达调控,同时在COPD中发现存在钙离子激活现象[12];上述现象高度提示钙离子信号与COPD平滑肌增殖密切相关。STC1最初是在硬骨鱼肾脏发现的一种钙离子调节蛋白,研究发现,去除硬骨鱼肾脏的斯坦尼氏小体后,腮腺摄取钙离子增多,出现高钙血症,说明斯坦尼氏小体中存在钙离子调节蛋白。Wagne等[6]在1986年提纯了该蛋白,经实验发现该蛋白能够抑制钙离子内流,后将该蛋白命名为斯钙素。STC1可作用于钙离子通道蛋白,如瞬时受体电位(transent receptor pathway,TPR)通道,抑制其表达[13]。近年来有关于TPR家族蛋白在COPD中研究是一大热点。实验发现,TPR通道蛋白在COPD中高表达,促进气道炎症及气道重塑发生。结合本研究结果,提示STC1可能通过作用于钙离子通道蛋白(如TRP)抑制钙离子内流,从而抑制平滑肌细胞增殖。
有研究表明,STC1是一种应激性蛋白[14],可表达于支气管上皮细胞,但其在COPD中表达水平尚不明确。本研究发现,在COPD小鼠中STC1表达升高,可能是一种应激反应,随着臭氧暴露3周,肺组织STC1表达较α-SMA下降,表明体内STC1蛋白表达不足以抵制气道重塑发生,外源给予足量的STC1可能改善气道重塑进程。
综上所述,STC1作为一种钙离子调控蛋白,在COPD支气管上皮反应性表达增高,可能作为一种保护机制,抑制气道平滑肌增殖,外源给予足量的重组STC1可能改善COPD患者气道重塑进程,有望成为COPD患者治疗的新靶点。

