二甲基乙二酰基甘氨酸对间充质干细胞外泌体生物学特性的影响*
王香云,张东伟
(浙江省湖州市第一人民医院神经内科 313000)
目前心肌梗死的发病率和病死率仍很高[1],用干细胞治疗心肌梗死是当下的一种新理念,其通过多重不确定的机制来修复心脏[2]。其中骨髓间充质干细胞(mesenchymal stem cells,MSC)易获得、免疫排斥低,已被广泛研究[3]。但由于干细胞移植后的低归巢率、高凋亡率等缺陷,使得干细胞治疗效果大打折扣。而干细胞通过缺氧、药物预处理及基因改造等方法可以增加疗效,其中药物预处理具有操作较容易、细胞耐受性较好等优势,被广泛研究。二甲基乙二酰基甘氨酸(DMOG)是一种缺氧诱导因子-1α(HIF-1α)的稳定剂,可以使细胞在常氧状态下高表达HIF-1α。外泌体(exosome)是一种由细胞分泌的纳米囊泡,研究发现其可以起到与MSCs本身几乎一致的生物学作用[4]。本研究采用不同浓度的DMOG对MSCs进行预处理,以探讨DMOG的最佳处理浓度,并分析DMOG预处理后exosome在体内外试验中的生物学作用及其可能的机制,现报道如下。
1 材料与方法
1.1材料
1.1.1实验动物与细胞 清洁级6~8周龄C57BL/6小鼠,由上海斯莱克实验动物公司提供;H9C2心肌细胞冻存细胞株购于南京科佰生物科技有限公司;人脐静脉内皮细胞(HUVECs)冻存细胞株购于赛业(广州)生物科技有限公司。
1.1.2主要仪器与试剂 倒置相差显微镜(德国 Leica公司);低温离心机(德国Eppendorf);低温高速离心机(美国Thermo公司);低温超速离心机(美国Becman公司);荧光定量PCR仪(美国ABI公司);DMEM/F12培养基(美国Corning公司);胎牛血清(FBS,上海普飞生物技术有限公司);Matrigel(美国BD公司);Trizol试剂(美国Invitrogen Life Technologies公司);DMOG试剂(美国Sigma-Aldrich公司);miR-210 mimic、antogomiR-210及对照(广州市锐博生物科技有限公司)。
1.2方法
1.2.1MSC的培养及鉴定 骨髓取自6周龄C57BL/6小鼠下肢长骨骨髓,并采用全骨髓培养,传代至第3~4代的小鼠MSCs采用流式细胞术鉴定细胞表型,具体检测包括CD31、CD29、CD34、CD44。
1.2.2MSC预处理 以第3~4代小鼠MSCs作为DMOG预处理对象,分为空白对照组和实验组,每组计数并接种细胞1×107个/培养皿,首先用含有10%FBS的完全培养基培养12 h,观察细胞状态良好后准备后续实验。DMOG用DMEM/F12培养基稀释为250、500、1 000、1 500 μmol/L的终浓度。之后细胞按照DMOG浓度0、250、500、1 000、1 500 μmol/L共5组预处理24 h。
1.2.3MSC来源的外泌体提取与鉴定 同时收集实验组和空白对照组细胞培养24 h后的条件培养基(细胞上清液),通过超速离心法获得exosomes。具体步骤:(1)细胞上清液在4 ℃下多步骤离心,300×g离心10 min、2 000×g离心10 min、12 000×g离心30 min,分别去除死细胞、细胞碎片及细胞微泡(microvesicles),获得的细胞上清液再使用100×103超滤管浓缩,4 000×g离心15 min,之后超速离心机下4 ℃ 100 000×g离心1 h,轻弃上清液,观察沉淀物,并用磷酸盐缓冲液(PBS)重悬,重悬后继续4 ℃ 100 000×g离心1 h。最终获得沉淀用50~100 μL PBS重悬,冻存于-80 ℃待用。通过蛋白质印迹法(Western blot)检测exosome表面标记如CD63、CD9等,通过电镜观察exosome的典型形态和粒径大小。
1.2.4miR-210 mimic转染试验 分别在H9C2心肌细胞和HUVECs中转染miR-210 mimic。具体步骤:HUVECs或H9C2细胞分别接种到24孔板,约1×105个/孔,细胞密度70%~90%,更换培养基。分别稀释lipofectamine 2000和miR-210 mimic在25 μL无血清培养基中,等比例混匀,待室温孵育后,每孔加入50 μL混合液,常温下培养3 d。
1.2.5体内试验后小鼠心肌梗死模型和小鼠心功能测定 采用8周龄的雄性C57BL/6小鼠,开胸后结扎冠脉左前降支,实验分为4组:对照组(Sham组),DMOG预处理来源exosome(ExoDMOG)组,对照exosome(Exo)组,PBS组,采用双盲法进行,分5点注射。小鼠心功能检测:按心肌梗死后术后当天(0 d)、术后3、7、14、28 d,通过二维M型心脏超声分别对各组小鼠进行心功能评价。
1.2.6组织学分析 实验按双盲进行,收集心肌梗死后28 d各实验组小鼠心脏,甲醛固定,石蜡包埋,用于后续病理切片。梗死面积的评估是以结扎线以下500 μm,对后续的组织切片用Masson′s trichrome染色评估心肌梗死面积,并用Image-pro Plus软件分析每个心脏切面的梗死区域及整个左心室面积,心肌梗死百分比=梗死区域面积/整个左心室面积×100%。
1.2.7免疫荧光染色 用于观察梗死周边区小动脉密度及心肌细胞凋亡情况。(1)小动脉密度观察:收集心肌梗死后28 d各实验组小鼠的心脏,完成组织冰冻切片后用甲醛固定,TritonX-100破膜10 min,10%牛血清蛋白(10%BSA)室温封闭1 h,羊抗鼠α平滑肌肌动蛋白(α-SMA)抗体、兔抗鼠肌钙蛋白I(Troponin I)抗体共同4 ℃孵育过夜,之后孵育二抗、细胞核DAPI染色,在荧光显微镜下观察、拍照,每个心脏随机选取5个切面,统计高倍镜下小动脉密度。(2)心脏组织TUNEL染色:标本制作方法同前,组织冰冻切片采用TUNEL染色,细胞核4′,6′-二脒基-2-苯基吲哚(DAPI)染色,每个心脏随机选取5个切面,在荧光显微镜下观察、计数TUNEL+细胞数及DAPI+细胞数。细胞凋亡率=(TUNEL+细胞总数)/(DAPI+细胞总数)×100%。
1.2.8HUVECs管腔形成实验 HUVECs管腔形成实验在铺有BD matrigel的96孔板上进行。在相差显微镜下观察HUVECs形成管腔的情况,并每隔1~2 h拍照,最后统计管腔长度。
1.2.9H9C2心肌细胞凋亡实验 H9C2凋亡实验(TUNEL试验)在6孔板上进行,将H9C2细胞以1×105个/孔接种,根据实验分组处理24 h,根据TUNEL试剂盒染色,在荧光显微镜下观察凋亡细胞数,最后计算凋亡率。
1.2.10miR-210抑制试验 采用特异性抑制miR-210表达的抑制剂antagomiR-210,在DMOG预处理的同时加入antagomiR-210,收集上述处理来源的exosome(ExoDMOG+ATM)。进一步比较体内实验的差异,小鼠心肌梗死模型方法同前,实验分为Sham组、PBS组、ExoDMOG组、ExoDMOG+ATM组,评估心肌梗死后3、7、14、28 d小鼠心功能,收集28 d小鼠心脏组织行免疫荧光染色。

2 结 果
2.1MSC来源的exosome鉴定 通过电镜观察exosome的形态及大小,符合典型杯状结构,直径约100 nm(图1A)。通过Western blot检测exosome表面相关标记物CD63、CD9均阳性(图1B)。对收集的exosome采用二喹啉甲酸(BCA)进行蛋白定量,随着DMOG的浓度增加,exosome的分泌水平有增加的趋势,其中DMOG浓度在1 000 μmol/L时增加最明显,但进一步提高DMOG浓度exosome的分泌减少,可能是DMOG过量带来的副作用(图1C),由此未进一步增加DMOG浓度进行实验。
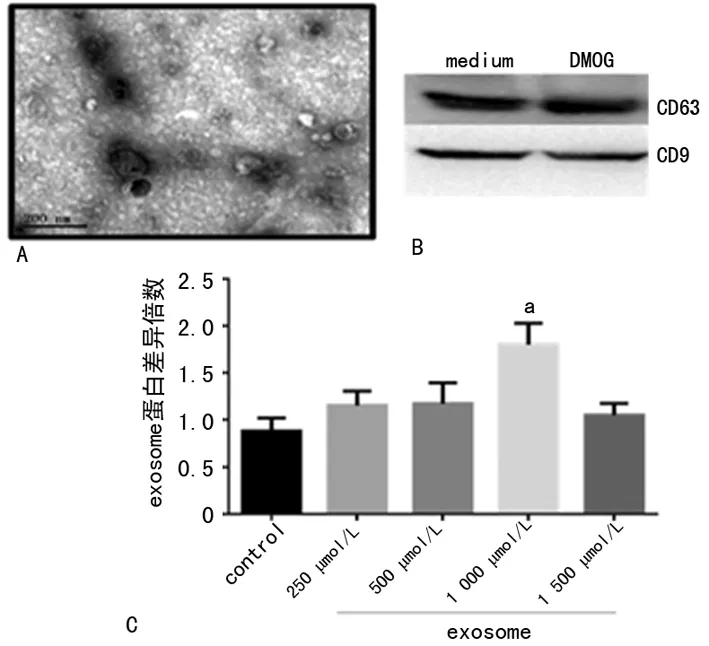
A:电镜下exosome鉴定;B:Western blot对exosome的鉴定;C:BCA蛋白定量分析比较不同浓度DMOG处理后exosome分泌水平;a:P<0.05,与control组比较
图1 MSCs-Exo的鉴定及不同浓度DMOG对exosome分泌的影响
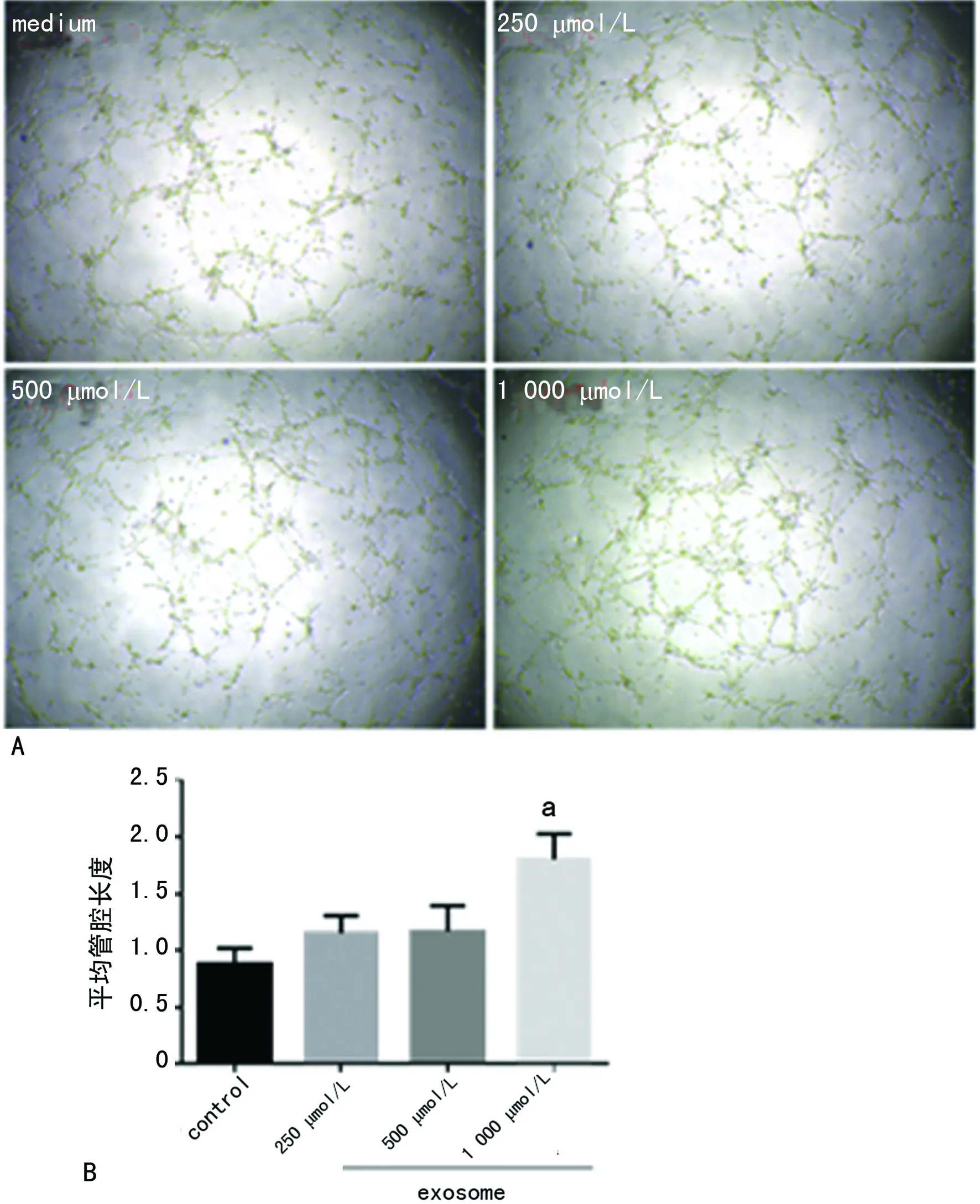
A:HUVECS管腔形成实验;B:HUVECS管腔形成实验分析图;a:P<0.05,与control组比较
图2不同浓度DMOG预处理MSCs来源的exosome对促血管新生的作用
2.2不同浓度DMOG预处理MSCs来源的exosome对促血管新生的作用 收集不同浓度DMOG预处理MSC分泌的exosome,进行HUVECS管腔形成实验,根据浓度不同,试验分为control、250 μmol/L、500 μmol/L、1 000 μmol/L组,结果发现随着DMOG浓度的增加,Exo促血管新生能力亦明显提高,其中在1 000 μmol/L浓度下最明显,表现为管腔形成长度增加(图2A、B)。
2.3不同浓度DMOG预处理MSCs来源的exosome对心肌细胞的保护作用 比较不同浓度DMOG预处理后MSCs来源的exosome对心肌细胞的保护作用的差异,在体外进行H9C2细胞过氧化氢(H2O2)诱导的凋亡实验。根据浓度不同,分为control、250 μmol/L、500 μmol/L、1 000 μmol/L组,结果发现1 000 μmol/L组exosome对心肌细胞的保护作用最明显,表现为TUNEL阳性的细胞比率最低(图3A、B)。

A:TUNNEL实验;B:TUNNEL实验分析图;a:P<0.05,与control组比较
图3不同浓度DMOG预处理MSCs来源的exosome对心肌细胞抗凋亡的作用
2.4DMOG处理MSC来源的exosome可以改善小鼠心肌梗死后心功能 为了明确DMOG预处理来源exosome(ExoDMOG)在体内实验中是否拥有优异的心肌保护作用,本研究通过左冠状动脉前降支永久结扎,建立小鼠急性心肌梗死模型,实验分为Sham组、Exo组、ExoDMOG组、PBS组,由于1 000 μmol/L浓度DMOG预处理来源的exosome在体外实验中生物学特性明显,故ExoDMOG组的exosome来源于1 000μmol/L浓度DMOG预处理的MSCs来源的exosome。体内实验采用双盲法进行,在左前降支顺利结扎后,在结扎线周围心肌组织中立即注射exosome(约收集自2×107个MSCs)或同等剂量的PBS液,分5点注射,每点约10 μL。术后当天(0 d),心肌梗死后3、7、14、28 d,利用小动物心脏超声仪系统检测各组小鼠的心功能改变并记录结果,收集28 d的小鼠心脏标本进行组织学分析。心肌梗死后28 d,ExoDMOG组小鼠心功能均较对照Exo组有明显改善,具体表现在减少心肌梗死后瘢痕形成(图4A、B),射血分数(EF)增加[(48.54±7.6)%vs.(20.53±8.1)%,P<0.05](图4C、D),并且存活率明显增加(图4E)。
A:小鼠心肌Masson′s trichrome染色;B:Masson′s trichrome染色分析图;C:小鼠心脏超声;D:小鼠心脏超声EF结果分析图;E:生存分析图;a:P<0.05
图4 DMOG处理MSC来源的exosome可以改善小鼠心肌梗死后心功能
2.5DMOG预处理对miR-210在MSC内和其分泌的exosome表达的影响 1 000 μmol/L浓度DMOG预处理后干细胞中及exosome中miR-210均大量增加,尤以exosome中升高为主(图5A、B)。本研究选取miR-210作为DMOG预处理后对MSC分泌的exosome生物学效益的重要研究对象。
2.6miR-210与ExoDMOG拥有类似的生物学作用 miR-210在DMOG预处理MSC分泌的exosome中的表达明显增加,促使猜测miR-210可能是其中最主要的生物学作用表现者。为此,在体外实验中进一步证实,分别在HUVECs和H9C2 中转染miR-210 mimic,结果表明,实验组相比对照组促血管新生能力明显增加,表现为管腔形成长度增加(图6A、B),另外实验组H9C2在H2O2诱导下的凋亡率明显降低(图6C、D)。这与ExoDMOG的生物学作用相一致。
2.7antagomiR-210削弱ExoDMOG的生物学作用 为进一步明确miR-210在ExoDMOG的作用,采用特异性抑制miR-210表达的抑制剂antagomiR-210。结果显示,ExoDMOG+ATM组的小鼠心功能(EF值)较ExoDMOG组明显降低,与PBS组相仿(图7A、B);同时,免疫荧光染色证实ExoDMOG+ATM组在心肌细胞保护和血管新生方面的作用也明显降低,具体表现在TUNEL阳性细胞较ExoDMOG组增加(图7C、D),α-SMA染色的小动脉密度较ExoDMOG组减少(图7E、F)。
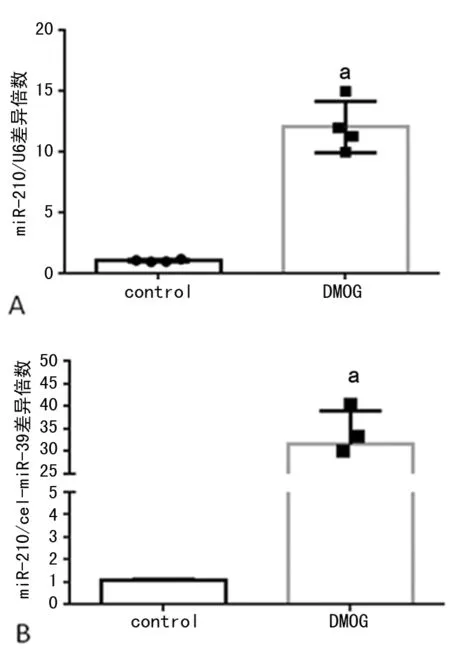
A:MSCs细胞水平miR-210 PCR分析图;B:exosome水平miR-210 PCR分析图;a:P<0.05,与control组比较
图5 DMOG预处理对miR-210在MSC细胞水平和exosome水平的影响
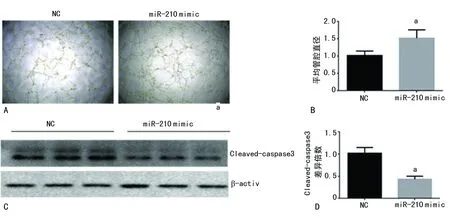
A:HUVECS管腔形成实验;B:HUVECS管腔形成实验分析图;C:Western blot检测Cleavd-caspase3表达差异;D:Cleavd-caspase3结果分析;a:P<0.05,与NC组比较
图6 miR-210的生物学作用分析
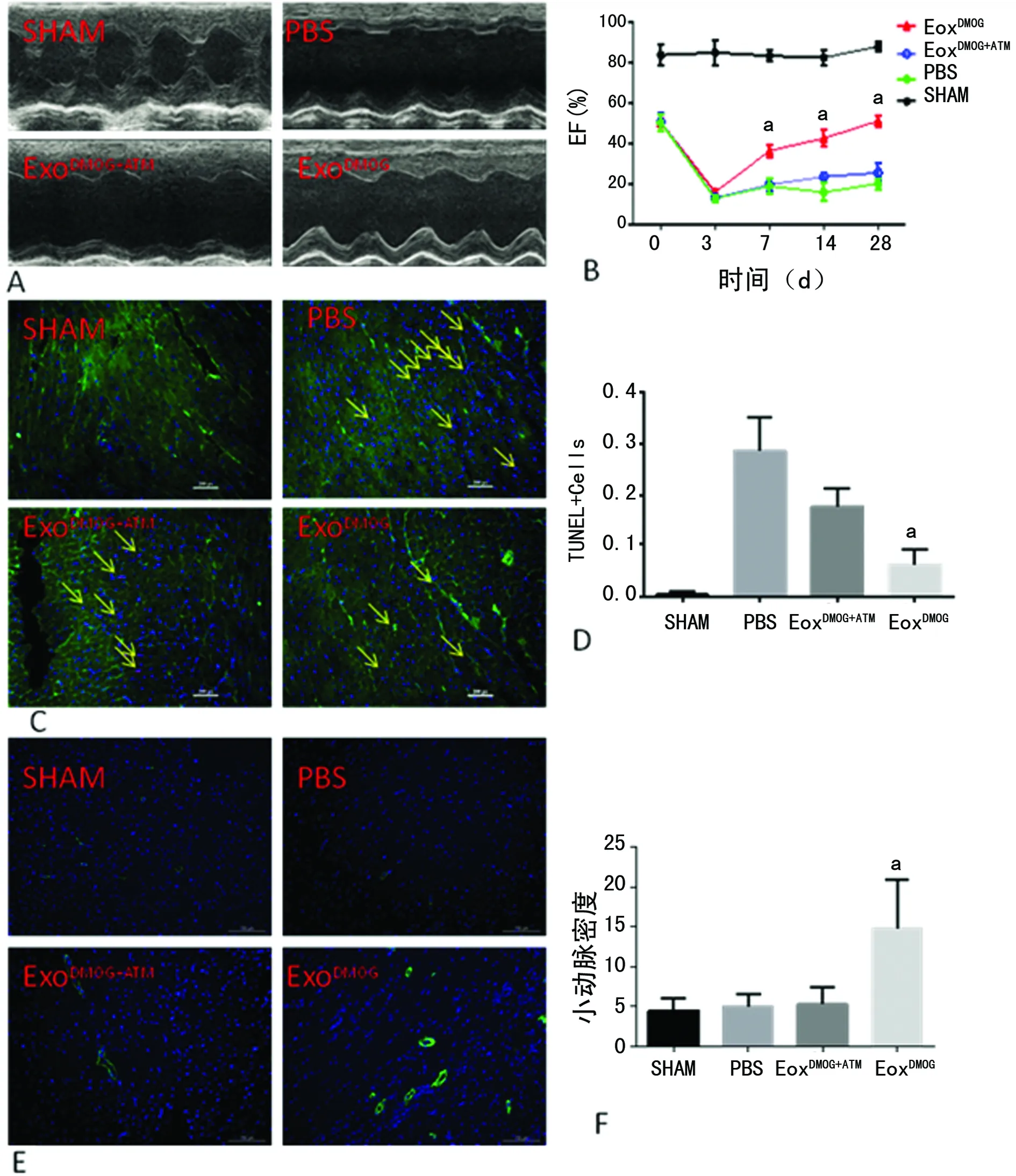
A:小鼠心脏超声;B:小鼠心脏超声EF结果分析图;C:小鼠心肌组织梗死周边细胞TUNEL染色,箭头所示为TUNEL+细胞(红色),细胞核为DAPI染色(蓝色),心肌组织Troponin I染色(绿色);D:TUNEL实验结果分析;E:免疫荧光染色心鼠心肌组织心肌梗死后梗死周边区小动脉密度,细胞核DAPI染色(蓝色),小动脉α-SMA染色(绿色);F:小动脉密度(α-SMA+细胞)结果分析;a:P<0.05
图7 antagomiR-210削弱ExoDMOG的生物学作用
3 讨 论
干细胞移植疗法可改善心肌梗死后心功能,其可能通过旁分泌等多种机制发挥作用[2]。但由于移植后干细胞归巢率低、凋亡率高等缺陷,使其治疗效果并不明确。研究发现,预处理干细胞可以增强干细胞移植后的功效,预处理的方法有很多,包括药物、条件、基因修饰等,如缺氧条件预处理能提高干细胞修复心肌的能力[5-6]。由于药物预处理操作简单,使其被广泛研究。DMOG是一种HIF-1α的稳定剂,在常氧条件下加入适当浓度的DMOG可以使细胞中的HIF-1α处于稳定状态,类似于缺氧状态。既往研究发现,DMOG预处理可以增强MSCs的促血管新生[7],提高存活率[8],促进分化[9]等。
最新的研究发现,干细胞可以分泌大量被称为exosome的纳米颗粒。而exosome可能在MSC的旁分泌作用中扮演相当重要的角色。研究发现,exosome发挥多种生物学作用,包括促血管新生[10]、神经再生[11]和修复心脏[12]等。如果exosome能被研发成为生物制剂用于治疗疾病,可以成为干细胞治疗的替代方法,可能成为未来医学的研究方向。本研究通过不同浓度的DMOG预处理MSCs并收集exosome,发现在1 000 μmol/L浓度下exosome的分泌水平最高,但增加浓度未见进一步升高,可能与药物副作用相关。同时还发现,1 000 μmol/L浓度预处理来源的exosome在体内外心肌保护、血管新生作用上优势明显。
进一步研究发现,相较于对照组,干细胞DMOG预处理分泌的exosome表达谱差异明显,可以肯定的是DMOG处理后干细胞分泌的exosome中包含HIF-1α诱导的miRNA[13],如miR-210,其由HIF-1α特异性调控[14]。miR-210被认为可以改善血管新生[15-17]、保护细胞存活、抗凋亡[18-19]。与其他文献报道一致,本研究发现DMOG预处理MSCs分泌的exosome中miR-210显著表达。同时作者也发现通过体外转染miR-210 mimic到受体细胞中,其结果与ExoDMOG的生物学作用相类似。然而加入miR-210的抑制剂antogomiR-210后,DMOG预处理收集的exosome(ExoDMOG+ATM),在心肌梗死模型中改善梗死后心功能、心肌细胞保护、血管新生方面较ExoDMOG明显减弱。由此认为,DMOG预处理MSCs分泌的exosome在血管新生、心肌保护作用方面表现更加优异,其可能是通过miR-210来发挥生物学作用。
综上所述,DMOG预处理MSCs来源的exosome拥有更佳的心脏保护能力,表现在体外实验中更好地促管腔形成、心肌细胞凋亡,以及体内实验中改善心肌梗死后小鼠心功能、小鼠存活率等。其可能的原因是在DMOG预处理条件下,HIF-1α得以稳定,其下游的靶基因得以激活,DMOG预处理来源的exosome中miR-210的表达水平明显上升。通过miR-210 mimic转染受体细胞后发现,其在血管新生、心肌细胞抗凋亡等方面与DMOG预处理来源的exosome具有相同的生物学作用。由此推测ExoDMOG的生物学作用可能主要通过miR-210实现。本研究也证实DMOG预处理是一种有效、安全的方式来提升干细胞来源的exosome对心肌梗死动物模型的生物疗效,可作为今后用于优化exosome替代治疗疗效的一种方法。

