子宫内膜异位症患者子宫内膜组织中ID2、PRELP、SMOC2基因表达和临床意义*
马 莉,刘春喜,姚 丽
郑州人民医院 妇科(郑州 450000)
子宫内膜异位症是妇科常见的一种具有功能的子宫内膜组织出现并生长于正常位置以外部位的良性妇科疾病,但异位宫内膜常发生病变,并累及盆腔、子宫肌层及卵巢等部位,进而导致盆腔黏连、痛经、慢性盆腔痛及不孕等症状[1]。子宫内膜异位症的发病机制尚未完全清楚。研究[2]表明,子宫内膜异位症的子宫内膜组织发生增殖并形成植入性病灶,且发病过程涉及黏附、侵袭及血管生成,病理过程与肿瘤组织的增殖及迁移等相似。目前,认为细胞生物学相关因子与子宫内膜异位症的发生发展有关。研究[3]表明,DNA结合抑制因子2(inhibitor of differentiation/DNA binding 2,ID2)与肿瘤细胞的增殖及迁移有关。富含脯氨酸/精氨酸的末端富含亮氨酸的重复蛋白(proline/arginine-rich end leucine-rich repeat protein,PRELP)可促进胰腺癌细胞的增殖及迁移并参与其病变过程[4]。SPARC相关模块化钙结合蛋白2(SMOC2)主要在胚胎发育过程中高表达且可影响生长因子、信号转导、血管生成及细胞增殖等多种细胞功能[5]。目前,关于ID2、PRELP及SMOC2在子宫内膜异位症患者子宫内膜组织中的表达研究相对较少,因此,本研究探讨ID2、PRELP及SMOC2在患者子宫内膜组织中的异常表达及其临床应用价值。
1 资料与方法
1.1 临床资料
选取2016年3月至2018年1月于郑州人民医院妇科诊治的子宫内膜异位症患者102例为试验组,所有患者均经病理证实诊断为子宫内膜异位症患者。另以同期本院收治的98例子宫肌瘤患者为对照组,所有患者均接受子宫肌瘤切除术。试验组患者年龄32~67(45.64±5.23)岁,对照组年龄33~66(46.34±5.27)岁。本研究经我院伦理委员会批准,参与试验人员均知情同意。纳入标准:1)符合子宫内膜异位症的诊断标准[6];2)未接受过激素治疗者;3)无其他严重性激素类疾病。排除标准:1)患有子宫内膜肿瘤、子宫肌瘤等疾病者;2)严重肝肾功能障碍者;3)排除严重的内分泌、呼吸、消化等系统疾病;4)临床资料不全者。两组患者年龄比较,差异无统计学意义(t=0.943,P=0.347),具有可比性。
1.2 研究方法
1.2.1 qRT-PCR法检测两组子宫内膜组织中ID2、PRELP、SMOC2 mRNA表达量 术中分别切取子宫内膜组织并留取两份,第1份标本用PBS缓冲液清洗后,储存于液氮罐中,并采用实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)法检测ID2、PRELP、SMOC2 mRNA相对表达量。按照Trizol试剂盒[天根生化科技(北京)有限公司]提取总RNA。参照反转录试剂盒(美国ThermoFisher公司)合成cDNA。采用qRT-PCR试剂盒(北京全式金生物技术有限公司)进行反应,反应体系为20 μL:2×SYBR Mix 10 μL,cDNA 1 μL;ddH2O 8 μL;上下游引物各0.5 μL,均以β-actin为内参引物,引物均由生工生物工程(上海)股份有限公司合成,引物设计如下(表1)。反应设置程序为:95 ℃ 预变性1 min;95 ℃ 15 s、95 ℃ 15 s、60 ℃ 15 s、72 ℃ 2 min,共40个循环。采用2-△△CT法对子宫内膜组织中ID2、PRELP、SMOC2 mRNA表达水平进行定量分析。
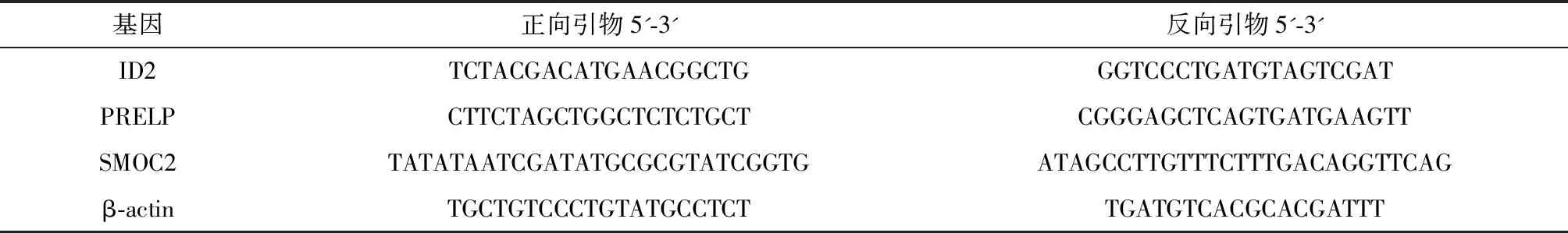
表1 qRT-PCR引物序列
1.2.2 Western blot法检测子宫内膜组织中ID2、PRELP、SMOC2蛋白表达情况 将1.2.1中留取的第2份子宫内膜组织样本进行研磨,加入含蛋白酶抑制剂的蛋白裂解缓冲液中,提取各组子宫内膜组织总蛋白并测定蛋白总量。采用Western blot法,以β-actin蛋白作为内参,检测子宫内膜组织中ID2、PRELP、SMOC2蛋白水平,严格按照操作说明进行检测,采用Tanon软件拍摄图像,并对蛋白表达水平进行半定量分析。
1.3 检测及观察指标
分别取两组受试人员清晨空腹静脉血5 mL并立即分为两份,其中1份简单离心后,吸取上清,并采用酶联免疫吸附法,按照检测试剂盒(北京中杉金桥生物有限公司)说明书,测定血清中血管内皮生长因子(VEGF)及肿瘤坏死因子-α(TNF-α)。另1份样品置于抗凝管内,并加入白介素-1β(IL-1β)及癌抗原125(CA125)检测试剂(上海普奥生物医药有限公司),利用胶体金法检测其表达水平。观察两组VEGF、TNF-α、IL-1β及CA125水平,并分析子宫内膜异位症患者子宫内膜组织中ID2、PRELP、SMOC2表达与VEGF、TNF-α、IL-1β及CA125水平的相关性。
1.4 统计学方法
2 结果
2.1 两组临床指标比较
试验组VEGF、TNF-α、IL-1β及CA125含量均高于对照组,差异有统计学意义(P<0.05)(表2)。
表2 两组临床指标比较
2.2 两组子宫内膜组织中ID2、PRELP、SMOC2 mRNA及蛋白表达检测比较
与对照组相比,试验组子宫内膜组织中ID2、PRELP、SMOC2 mRNA表达量均明显升高(P<0.05);Western blot检测结果显示,试验组ID2、PRELP、SMOC2蛋白表达水平均高于对照组(P<0.05)(表3~4、图1)。
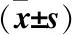
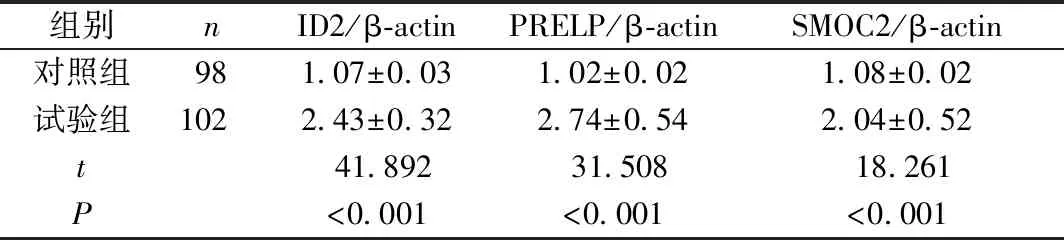
组别nID2/β-actinPRELP/β-actinSMOC2/β-actin对照组981.07±0.031.02±0.021.08±0.02试验组1022.43±0.322.74±0.542.04±0.52t41.89231.50818.261P<0.001<0.001<0.001
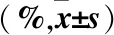
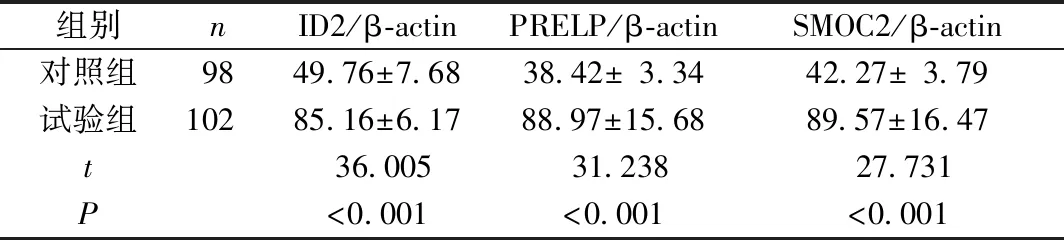
组别nID2/β-actinPRELP/β-actinSMOC2/β-actin对照组9849.76±7.6838.42±3.3442.27±3.79试验组10285.16±6.1788.97±15.6889.57±16.47t36.00531.23827.731P<0.001<0.001<0.001
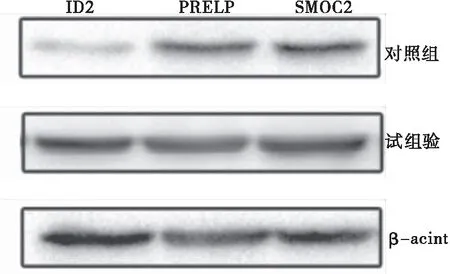
图1 Western blot法检测两组子宫内膜组织中各蛋白表达水平
2.3 试验组子宫内膜组织中ID2、PRELP、SMOC2与患者临床指标的关系
试验组患者子宫内膜组织中ID2与VEGF、IL-1β及CA125呈正相关,PRELP与VEGF、TNF-α及CA125呈正相关,SMOC2与IL-1β及CA125呈正相关,差异有统计学意义(P<0.05)(表5)。
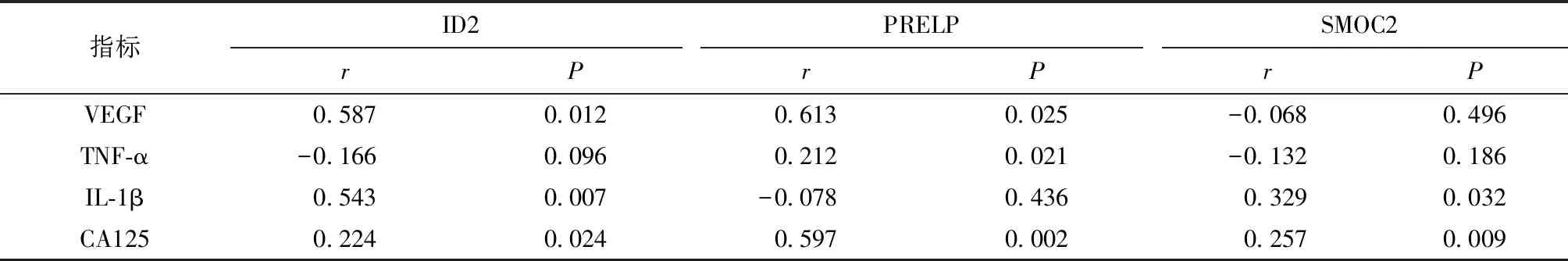
表5 试验组子宫内膜组织中ID2、PRELP、SMOC2与患者临床指标的关系
2.4 ROC曲线分析ID2、PRELP、SMOC2对子宫内膜异位症的预判价值
ROC曲线分析显示,子宫内膜组织中ID2、PRELP、SMOC2对临床诊断子宫内膜异位症具有较高的预判价值,结果显示,ID2的AUC面积为0.796,敏感性为86.34,特异性为64.10,截断值为1.66;PRELP的AUC面积为0.919,敏感性为92.41,特异性为82.05,截断值为2.10;SMOC2的AUC面积为0.818,敏感性为92.06,特异性为58.97,截断值为1.83(图2、表6)。
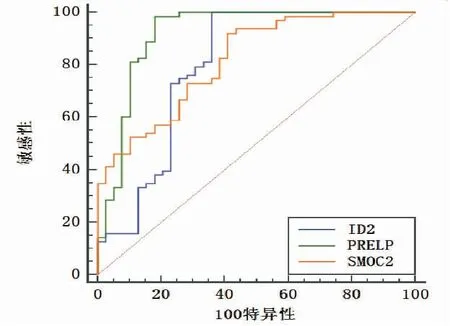

图2 ID2、PRELP、SMOC2的ROC分析图
2.5 相关因素影响子宫内膜异位的Logistic回归分析
Logistic多元回归分析结果显示,子宫内膜组织中ID2、PRELP及SMOC2均为子宫内膜异位症患者的危险因素(表7)。

表7 相关因素影响子宫内膜异位的Logistic回归分析
3 讨论
子宫内膜异位症可使盆腔炎内环境发生慢性炎症改变,从而影响卵子存活,并导致患者不孕,其发生发展可以导致患者多种不良临床结局的发生[7]。目前,临床采用腹腔镜手术去除肉眼可见的病变,但仍有部分患者不能怀孕。治疗后疾病的病情进展率较高,可能是其存在分子水平异常从而影响受孕及胚胎发育。研究[8]表明,细胞生物学相关因子改变与子宫内膜异位症发病机制相关,可通过影响异位症子宫内膜组织中的腺体细胞发生增殖及侵袭等生理过程,进而加快腺体细胞的浸润过程,最终导致病情持续性恶化。因而,寻求特异性分子标志物对子宫内膜异位症的诊断及治疗均具有重要意义。研究[9]表明,ID2、PRELP及SMOC2与卵巢子宫内膜瘤病变发生有关,且均可直接或间接参与细胞迁移、侵袭及血管生成等过程。关于子宫内膜异位症患者中ID2、PRELP及SMOC2表达研究相对较少,因此本研究主要探讨ID2、PRELP及SMOC2在子宫内膜异位症患者的子宫内膜组织中表达水平,可为子宫内膜异位症患者的发病机制提供理论依据。
ID2是分化/DNA结合抑制因子家族的成员,其主要通过与碱性螺旋-环-螺旋类转录因子结合,形成异源二聚体而导致ID2缺失,影响其与靶基因的结合,进而抑制相关基因表达[10]。研究[11]表明,ID2异常表达可促进癌症细胞增殖及迁移,其与细胞黏附、蛋白质糖基化、细胞侵袭及血管生成紧密相关。由于子宫内膜异位症与癌症之间的相似性,本研究通过qRT-PCR法检测试验组及正常组子宫内膜组织中ID2 mRNA表达量,并采用Western blot法检测其蛋白表达水平,结果显示,试验组患者ID2 mRNA表达量及蛋白表达水平均高于对照组,说明子宫内膜异位症子宫内膜组织中ID2呈上调表达。观察试验组子宫内膜组织中ID2与患者临床指标的关系,结果显示,试验组患者子宫内膜组织中ID2与VEGF、IL-1β及CA125呈正相关,其中VEGF高表达可增加异位症腺体细胞的浸润能力[12],IL-1β与CA125在子宫内膜异位症患者中高表达,并可通过损伤异位症病灶组织中的线粒体而提高腺体细胞的黏附能力,最终严重损伤基底膜层上皮组织[13-14]。说明ID2高表达与子宫内膜异位症患者病情进展紧密相关,推测子宫内膜组织中ID2表达可作为预测子宫内膜异位症患者严重程度的指标。
PRELP在胰腺癌组织中高表达,其可与基底膜蛋白聚糖及胶原蛋白结合,进而抑制相关基因表达,并促进肿瘤细胞的迁移及侵袭[15]。相关研究[16]表明,PRELP与新血管形成有关,并可在软骨及胚胎发育过程中高度表达。本研究通过qRT-PCR与Western blot法检测PRELP表达,结果显示,试验组子宫内膜组织中PRELP mRNA及蛋白表达均高于对照组,说明子宫内膜异位症患者子宫内膜组织中PRELP呈上调表达。同时,本研究发现,PRELP与VEGF、TNF-α及CA125呈正相关,其中TNF-α在脑组织及胎盘发育过程中发挥重要作用,并与腺体细胞的浸润能力紧密相关,可在发生病变时高度表达并促进细胞的增殖及迁移。说明PRELP可能参与子宫内膜异位症发生发展过程,推测PRELP可能通过影响TNF-α等的表达进而促进患者病情发展。
SMOC2主要存在于非基底膜中,并与心脏、肾等组织器官发育有关。研究[17]表明,SMOC2还在胸腺、卵巢中表达,并参与许多相关生理过程。近来研究[18]发现,SMOC2的生物学功能可通过刺激人类内皮细胞发生有丝分裂,增强亚基成纤维细胞生长因子及血管内皮生长因子的血管生成。基于此,本研究通过qRT-PCR与Western blot法检测子宫内膜异位症患者及正常子宫内膜组织中SMOC2表达,结果显示,试验组患者子宫内膜组织中SMOC2表达高于对照组,说明SMOC2在子宫内膜异位症患者子宫内膜组织中呈高度表达。进一步研究发现,SMOC2与IL-1β及CA125呈正相关,说明SMOC2可能通过与血清相关因子相互作用进而参与子宫内膜异位症的发生发展并加快病情恶化。本研究ROC曲线分析结果显示,子宫内膜组织中ID2、PRELP、SMOC2对临床诊断子宫内膜异位症具有较高的预判价值,说明子宫内膜组织中ID2、PRELP、SMOC2可作为临床诊断子宫内膜异位症的预测因子。同时,本研究对影响子宫内膜异位的相关因素进行Logistic回归分析,结果显示,子宫内膜组织中ID2、PRELP及SMOC2均为子宫内膜异位症患者的危险因素,说明三者均可相互作用并对疾病的发展起到促进作用。本研究结果揭示,子宫内膜组织中ID2、PRELP、SMOC2高表达并可促进新生血管的生成,进而增加病变细胞的增殖速率,导致子宫内膜异位症病情持续性发展,且三者均可作为临床诊断子宫内膜异位症的分子标记物。
综上所述,子宫内膜组织中ID2、PRELP、SMOC2高表达与子宫内膜异位症的发生发展紧密相关,三者均可能成为子宫内膜异位症的候选特异性靶基因,且均可作为临床诊断子宫内膜异位症的标志物。本研究存在不足之处,关于ID2、PRELP、SMOC2在子宫内膜异位症发病及进展中的确切机制还有待进一步研究。