几丁质脱乙酰酶的特点及应用
朱先玉,丛海花,尹 恒
(1.大连海洋大学食品科学与工程学院,辽宁 大连 116023;2.中国科学院大连化学物理研究所,天然产物与糖工程课题组,辽宁省碳水化合物重点实验室,辽宁 大连 116023)
几丁质是渔业生产过程中虾蟹壳的主要组成部分,每年全球产生约(600~800)×104t废弃的蟹和虾壳,这些废弃的虾蟹壳通常是被倾倒在垃圾填埋场或海洋中,造成了严重的环境污染[1]。虾蟹壳中所含的如蛋白质、碳酸钙和几丁质等物质被忽略,也造成了资源浪费。因此寻找可持续的方法来合理利用甲壳类动物的外壳已经引起人们的广泛关注。
壳聚糖是几丁质的脱乙酰化产物,是由β-1,4-N-氨基葡萄糖组成的线性直链聚合物,是自然界唯一存在的碱性多糖[2]。部分乙酰化的壳寡糖(COS)由N-乙酰葡糖胺(GlcNAc,A)和葡糖胺(GlcN,D)组成,是具有多种生物活性和潜在应用价值的结构复杂的生物聚合物[3]。壳聚糖具有广谱的抑菌性、保水性、可再生性、良好的生物相容性、可降解性、细胞膜通透性、较高的载药性、无毒副作用等特性,通过戊二醛交联法、接枝、乙酰化等多种化学物理改性之后,可被广泛应用于医药、环保、食品、农业、造纸、化妆品等领域。部分乙酰化的壳寡糖是有效的生物制剂,具有抗炎、抗肿瘤、免疫调节、神经保护和其他重要的药物活性。它们的生物活性被认为是取决于它们的结构,即它们的聚合度、乙酰化程度,以及乙酰化模式[3]。
传统化学法生产壳聚糖和壳寡糖需要强酸强碱和高温等复杂的处理方法[4],不仅反应条件要求苛刻,而且会产生大量的副产物,导致环境污染严重、分离困难等诸多难题的出现[5]。几丁质脱乙酰酶(CDA)可以直接从几丁寡糖上脱去乙酰基生成壳寡糖,该酶广泛存在于真核生物和原核生物中[6]。生物酶法生产壳聚糖的反应条件温和、无污染,且产物壳寡糖的聚合度、脱乙酰度、脱乙酰化模式单一,因此几丁质脱乙酰酶引起了人们的广泛关注[7]。目前已经有报道把几丁质脱乙酰酶成功构建至毕赤酵母或大肠杆菌中进行异源表达,以获得表达量高、稳定性好、活性高的几丁质脱乙酰酶[8]。本文主要从几丁质脱乙酰酶的来源、脱乙酰化模式、催化机制及几丁脱乙酰化酶的潜在应用等方面进行了综述。
1 CDA的来源
CDA广泛存在于细菌、真菌和昆虫基因组中,能催化水解几丁质或几丁寡糖中N-乙酰氨基葡萄糖胺的乙酰基,形成壳聚糖和壳寡糖,与传统生产壳聚糖相比,酶法生产壳聚糖反应条件温和、环保无污染、耗能低,是近年来研究生产壳聚糖方法的主要研究对象。目前已经确定了来自细菌、真菌和昆虫的CDA,如根瘤菌(Rhizobiummeliloti)[9]、新生隐球菌(Cryptococcusneoformans)[10]、粉纹夜蛾(Mamestraconfigurata)[11]等。
在以上报道的几丁质脱乙酰酶中,其中已经有4个脱乙酰酶被研究得比较彻底,他们的晶体结构也已经被解析。来源于真菌病原体炭疽病菌(Colletotrichumlindemuthianum)分泌内切几丁质脱-N-乙酰化酶(ClCDA,PDB ID:2IW0)能够在感染期间修饰暴露的菌丝几丁质[12]。来源于兔脑原虫(Encephalitozooncuniculi)的推定的几丁质脱乙酰酶[13](ECU11_0510,2vyo)定位于质膜和内生孢子之间的界面,可以修饰孢子中的几丁质,以逃避宿主中几丁质酶的水解,可能对于兔脑原虫在宿主中的存活是重要的。来源于口腔病原体变形链球菌(Streptococcusmutans)的推定的多糖脱乙酰酶(PgdA,PDB ID:2W3Z)与人黏膜溶菌酶的细菌防御机制有关[14]。来源于霍乱弧菌(Vibriocholerae)的几丁质脱乙酰酶(VcCDA)的酶与底物共结晶表明不同来源的CDA表现出的特定发脱乙酰化模式是由关键环(Loop)控制[4]。不同来源的几丁质脱乙酰酶都具有6个保守的Loop,Loop所在的位置、长短及其动力学效应对几丁质脱乙酰酶的特定的脱乙酰模式具有重要影响(图1)。

2 CDA的结构特点
几丁质脱乙酰酶(EC 3.5.1.41)与乙酰木聚糖酯酶(EC 3.1.1.72)、壳寡糖脱乙酰酶(EC 3.5.1-)、肽聚糖GlcNAc脱乙酰酶(EC 3.5.1-)、肽聚糖N-乙酰胞壁酸脱乙酰酶(EC 3.5.1-)同属于糖苷水解酶第四家族(CE4)[15]。Blair等通过对来源于糖苷水解酶第四家族氨基酸进行多重序列比对,显示CDA家族的序列中含有五个保守基序(图2),这些基序中含有保守的天冬氨酸和组氨酸残基,这些保守序列构成了CDA的活性位点[16]。这五个基序被分别命名为基序1(TFDD)、基序2(HSWSHP)、基序3(RPPY)、基序4(DSLDW)、基序5(GSIVLMH)。基序1(TFDD)包括两个天冬氨酸残基:一个天冬氨酸残基与锌或钴相互作用,第二个天冬氨酸残基与底物结合,使反应生成乙酸。基序2(HSWSHP)中含有两个组氨酸,一个丝氨酸或一个苏氨酸,其中组氨酸可以与金属离子结合稳定酶的结构,丝氨酸或苏氨酸可以与组氨酸结合形成氢键。基序3(RPPY)形成了活性位点凹槽的一侧,它可以结合醋酸、锌,并协调天冬氨酸的催化活性,酪氨酸可以与乙酸形成氢键,当来源于肺炎链球菌的肽聚糖脱乙酰酶中酪氨酸突变为丙氨酸时,该酶就会发生失活。基序4(DSLDW)构成了活性位点沟槽的另一侧,色氨酸是该基序的关键氨基酸。基序5(GSIVLMH)包含来自于疏水口袋的亮氨酸和来自于和产物乙酸结合的组氨酸[16]。

3 CDA的催化机制
CDA是一种金属酶,因此该酶与大多数的金属酶的催化机制相同,均为金属辅助的酸/碱催化作用[17]。CDA的催化机制涉及保守的催化氨基酸(Asp和His)和保守的基序(MT1-5),金属离子与保守基序中的酸碱氨基酸残基结合形成催化三联体[17]。到目前为止,只有四种不同来源(ColletotrichumAspergillus、Vibrio和Arthrobacter)的几丁质脱乙酰酶的晶体结构被解析,其催化机制均为金属辅助的酸碱催化机制。其中VcCDA是第一个被用于解析酶和底物复合体的几丁质脱乙酰酶。通过研究该酶的无活性突变体与几丁二糖、几丁三糖的共结晶复合物结构,发现底物的几丁寡糖的羟基也参与了金属的配位。VcCDA中的Zn2 +与His97和His101的咪唑氮、Asp40的羧酸酯基、N-乙酰基的氧原子和GlcNAc环的羟基氧配位。扭曲的八面体配合由水分子完成。在活化后,该水分子被认为是负责去除N-乙酰基的亲核试剂[4]。因此几丁寡糖脱乙酰化形成壳寡糖。
4 CDA的特定脱乙酰模式
已经被报道的来源于细菌、真菌、昆虫等生物的脱乙酰酶,由于其在这些生物中CDA表达量低、生长周期长、难以分离纯化等难题难以解决,所以通常将CDA在大肠杆菌或者酵母中进行异源表达,因其操作简单并能在廉价的培养基中高密度培养等特征,使其在大多数科研应用中成为高效表达异源蛋白的方法。
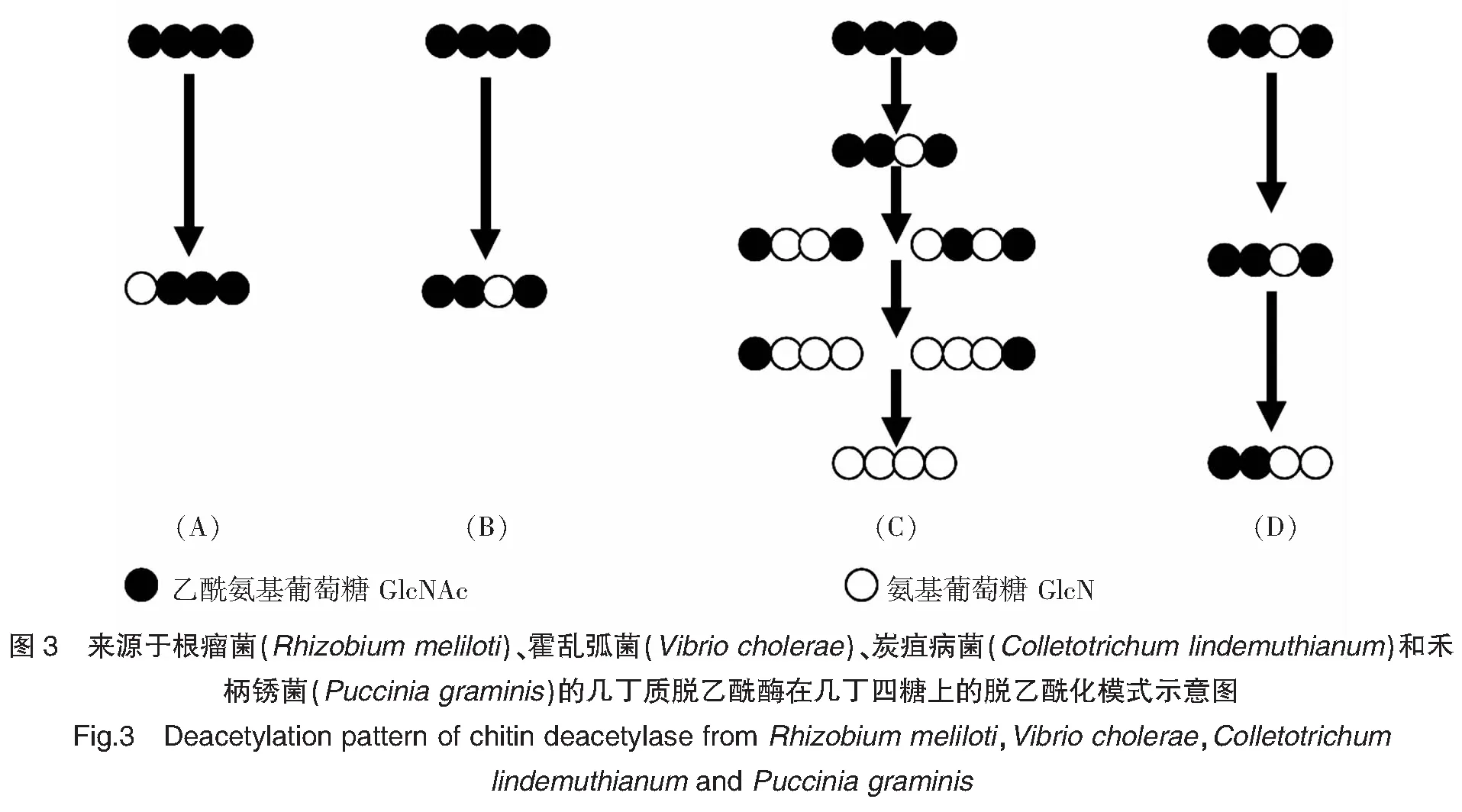
目前已经有一些几丁质脱乙酰酶在原核宿主和真核宿主中得以表达。并且不同来源的几丁质脱乙酰酶的脱乙酰模式不同,主要被分为单点攻击[9]和多重攻击两种方式[18]。在单点攻击中几丁质脱乙酰酶结合几丁寡糖只发生单个位点的脱乙酰化[9,19]。例如来源于根瘤菌(Rhizobiummeliloti)的脱乙酰化酶仅在几丁寡糖的非还原端发生脱乙酰化产生脱乙酰模式为DAn-1的部分乙酰化的壳寡糖[9](图3A)。而来源于霍乱弧菌(Vibriocholerae)的几丁质脱乙酰酶(VcCDA)只能水解距离还原端倒数第二位的乙酰基,即产生An-2DA的乙酰化模式的部分乙酰化模式的壳寡糖[19](图3B)。而多重攻击则是几丁质脱乙酰酶结合几丁质寡糖链之后发生连续的或不连续的脱乙酰化[20]。例如来源于炭疽病菌(Colletotrichumlindemuthianum)分泌内切几丁质脱-N-乙酰化酶(ClCDA)能够使几丁寡糖发生完全的脱乙酰化产生不含乙酰基的壳寡糖即为Dn(D=GlcN)的脱乙酰模式[12](图3C)。来源于禾柄锈菌(Pucciniagraminis)的几丁质脱乙酰化酶则不能使位于非还原端的两个GlcNAc单元去乙酰化,即产生A2Dn-2(D=GlcN,A=GlcNAc)乙酰化模式的部分乙酰化的壳寡糖[3](图3D)。
5 几丁质脱乙酰酶的生物学功能及应用
5.1 几丁质脱乙酰酶被作为药物靶向受体
细菌感染严重地威胁着人类的健康[21]。随着抗生素的广泛使用,耐药细菌的种类也在不断地增加。这些耐药菌所引起的感染率、死亡率也在逐年升高,细菌耐药问题愈演愈烈,严重威胁医疗安全。细菌细胞膜上的肽聚糖通常被认为是宿主先天免疫系统的主要靶标,肽聚糖的解离将导致细菌裂解。而细菌体内的脱乙酰酶参与了肽聚糖的脱乙酰化和宿主溶菌酶的抗性,因此病原体能够侵入宿主并引起宿主的感染[4]。例如霍乱弧菌(Vibriocholerae)一种潜在的破坏性肠道感染的人类病原体位于海洋、河口和淡水水生环境中,常常附着在甲壳类动物上,人们通过饮用被污染的水或摄入错误方式烹饪的甲壳类动物如虾蟹等,将导致霍乱弧菌进入人体引起细菌感染。一些蜡状芽孢杆菌对人类有害并能够引起食源性疾病的革兰氏阳性菌,与高毒力炭疽芽孢杆菌的亲缘关系较近,它的基因组中含有10种多糖脱乙酰酶。其中,肽聚糖N-乙酰葡糖胺脱乙酰酶是引起细胞毒力所必需的酶并参与对宿主溶菌酶的抗性[22]。因此鉴定并分析细菌来源的几丁质脱乙酰酶结构和底物的特异性相互作用是开发新的抗感染剂的有吸引力的靶标。
5.2 调控昆虫的生长发育
研究发现几丁质脱乙酰酶(CDAs)严格调节昆虫的生长和发育,晚期幼虫阶段高度表达转录物水平与其他生长时期相比显著提高。通过RNA抑制的方法可以显著降低几丁质脱乙酰酶的转录水平,导致幼虫蛹蜕皮困难并产生高的幼虫死亡率[23]。例如Yan Xiaoping等通过PCR扩增克隆了来自美国白蛾的几丁质脱乙酰酶的全长序列,从美国白蛾的转录组中搜索了两个几丁质脱乙酰酶序列,推导的蛋白质序列显示这两个几丁质脱乙酰酶分别含有由18个氨基酸组成的信号肽和含有524和518个氨基酸残基组成的前蛋白;这两个几丁质脱乙酰酶含有几丁质结合结构域、低密度脂蛋白受体A类结构域和多糖脱乙酰酶催化结构域;基因表达分析显示这两个几丁质脱乙酰酶均在头、体、前肠、中肠、后肠和脂肪体以及第5龄幼虫的第1~5天中进行表达,蛋白质印迹分析显示,头部和体表中的几丁质脱乙酰酶蛋白表达量高,并且在第5龄期的发育表达结果显示几丁质脱乙酰酶在第1~2天高度存在,然而几丁质脱乙酰酶的沉默导致了美国白蛾蜕皮失败和死亡[24]。因此几丁质脱乙酰酶对于昆虫的生长发育是必需的,昆虫来源的几丁质脱乙酰酶可能是害虫控制的潜在目标。
5.3 生产特定结构的壳寡糖
壳聚糖和部分乙酰化的壳寡糖已经被证明具有优异的物理化学性质和许多有益的生物活性[25]。例如用壳寡糖处理之后的植物能够提高抗逆性[26];壳聚糖被作为医用材料,用于胚胎干细胞的定向分化、烧伤皮肤的恢复与重生、止血抑菌的生物膜等[27]。然而这些生物学功能并不稳定:有时这些生物学功能会被看到,但并非总是如此。这种稳定性的缺乏严重阻碍了壳聚糖和部分乙酰化壳寡糖的商业应用和发展。壳寡糖及其衍生物的生物活性和理化性质被认为是取决于它们的乙酰化模式。然而,通过化学法生产的壳聚糖和部分乙酰化的壳聚糖通常显示随机的乙酰化模式,使得它们的生物活性难以被控制和预测。相反,由几丁质脱乙酰酶(CDA)产生的部分乙酰化壳寡糖可具有特定的乙酰化模式。例如来源于Pucciniagraminisf.sp.tritici的几丁质脱乙酰酶能够产生具有AADD、AADDD和AADDDD(A,GlcNAc;D,GlcN)的特异性乙酰化模式的部分乙酰化的壳寡糖[3];来源于Vibriocholerae的脱乙酰酶能够产生具有DD、DDA、DDAA、DDAAA、DDAAAA的特异性乙酰化模式的部分乙酰化的壳寡糖[19];来源于Colletotrichumlindemuthianum的几丁质脱乙酰酶能够产生具有DD、DDD、DDDD、DDDDD、DDDDDD的特异性乙酰化模式的部分乙酰化的壳寡糖[20]。因此通过几丁质脱乙酰酶产生的特定乙酰化模式的壳寡糖,未来能够被用于阐明部分乙酰化壳寡糖的聚合度、乙酰化程度和乙酰化模式在微生物、植物、人体细胞等方面的具体生物学活性。

