草鱼脑细胞原代培养
周 怡,郭本月,魏万权,袁小琛,梁旭方
(1.中国海洋大学食品科学与工程学院,山东 青岛 266000;2.青岛蔚蓝生物集团有限公司,山东 青岛 266000;3.青岛玛斯特生物技术有限公司,山东 青岛 266000;4.华中农业大学水产学院,湖北 武汉 430070)
构建细胞体外培养体系是鱼类生理代谢机制研究的重要手段。与活体实验相比,采用鱼类培养细胞作为实验对象不仅实验成本低,可以精确控制实验条件,重复性、均一性也较好,还可以同时提供大量生物学性状相似的实验对象[1-2]。这些优点使得鱼类细胞在生物学研究领域中得到广泛应用,已被应用于细胞生物学、病毒学、环境毒理学、肿瘤学以及资源保护等方面[3-5]。因此,深入研究鱼类细胞培养,不仅能推动鱼类生理相关理论研究,在实际应用方面也具有一定意义。
神经细胞系是开展神经发育生物学及生理机制研究的重要工具。近期国内外学者进行了多种鱼类脑细胞的培养工作,包括卡特拉鱼、罗非鱼、海鲈鱼、玳瑁石斑鱼、青石斑鱼以及斜带石斑鱼等[6-12]。研究者多采用离体脑细胞进行病毒感染及污染物毒理学研究,其应用远不及哺乳动物广泛。本研究参考其他鱼类相关研究成果,初步探讨了草鱼脑细胞的原代培养技术,以期为研究鱼类脑部生理规律及其调控机制提供新的技术和思路。
1 材料与方法
1.1 实验动物
草鱼购于湖北仙桃排湖渔场,暂养于实验室循环水系统,选取健康且体表无损伤的个体,平均体重(187.50±8.42)g。
1.2 实验试剂
L-15液体培养基、胰蛋白酶均为Gibco公司产品;胎牛血清(FBS)为Hyclone公司产品;CellTiter 96®AQueous One Solution Cell Proliferation Assay为Promega公司产品。青霉素、链霉素、两性霉素分别配制成母液,经0.22 μm滤过除菌,分装,-20℃保存。PBS缓冲液:0.01M Na2HPO4、0.01M NaH2PO4、0.15M NaCl,pH 7.2,高压灭菌,4℃保存。4.0%台盼蓝母液,用滤纸过滤,4℃保存,使用时用PBS将其浓度稀释至0.4%。
1.3 细胞原代培养
实验草鱼冰上麻醉,剪断鳃部脉弓,放血约10 min,70%乙醇体表消毒。在无菌条件下,解剖取脑,以含有抗生素500 IU/mL青霉素和500 μg/mL链霉素及2.5 μg/mL两性霉素的PBS缓冲液冲洗3次。分别采用不同方法尝试进行原代培养:1)组织块培养法,用眼科剪将组织剪碎成约1~2 mm3的小块。用完全培养基(10 % FBS,青霉素100 U/mL、链霉素100 μg/mL、两性霉素2.5 μg/mL)浸润培养瓶,将组织块转移到培养瓶中,均匀排列,加入1 mL完全培养基,于28℃ CO2培养箱(SANYO,MCO-18AIC)中培养。在培养的1~2 d内避免移动培养瓶,以便组织块贴壁,在2~3 d吸出培养基,添加3 mL新鲜培养基继续培养。2)消化法,用眼科剪将组织切成2~3 mm3小块,以便于消化。0.25%胰蛋白酶酶解处理,期间轻轻摇动数次。消化液混浊则吸出少许消化液于显微镜镜检,若组织已分散成单个细胞或细胞团即终止消化。通过30 μm不锈钢筛,滤掉尚未充分消化开的组织块。600 rpm低速离心10 min收集细胞,完全培养基再悬浮,于28℃培养箱中培养。3)机械破碎法,在完全培养基浸润的细胞培养皿中,将脑组织置于200目灭菌尼龙网上,采用无菌注射器的橡胶推头轻轻挤压使脑组织通过网孔,得到细胞悬液,收集细胞悬液后通过 100目的尼龙网过滤,600 rpm低速离心 10 min 洗涤细胞一次,弃掉上清液后加入完全培养基重悬浮后,于28℃培养箱中培养。
1.4 细胞活力测定
细胞活力测定采用CellTiter 96®AQueous One Solution Cell Proliferation Assay试剂盒测定。采用如1.3中机械破碎法制备细胞悬液,取出20 μL细胞悬液,加入等体积的0.4%台盼蓝染液,利用血球计数板快速估算细胞密度以及检验细胞成活率[细胞成活率(%)=活细胞总数/(活细胞总数+死细胞总数)×100],当细胞活力大于90%时可用。用完全培养基将细胞稀释至2×106个/mL,细胞悬液分别接种到24孔及96孔细胞培养板,培养24 h后细胞贴壁稳定,在培养24、48、72、96、120 h后,分别计数其细胞数及测定其细胞活力。实验开始时,向培养板每孔中加入20 μL CellTiter 96®AQueous One Solution Reagent溶液,黑暗中孵育 4 h后终止培养,490 nm波长读取吸光度值。
2 结果与分析
2.1 草鱼脑细胞形态学观察
本实验采用台盼蓝检验,死细胞被台盼蓝染色,显微镜下可见为浅蓝色细胞,而活细胞膜结构完整使染料未进入细胞内,显微镜下呈无色透明状。显微镜观察并计数,采用机械法分离制备的草鱼脑细胞的细胞成活率达到92.2%,表明细胞存活率较好。
培养24 h后观察到机械法培养脑细胞贴壁,呈不规则的多角形,贴壁的细胞多为上皮样细胞形态,并汇合形成单层细胞(图1A)。组织块法获得的细胞培养24 h后观察也多呈多角形,细胞形态与机械法类似,但是细胞贴壁数量较机械法少(图1B)。而消化法获得的近乎圆形的细胞较多,少量不规则的多角形细胞(图1C)。
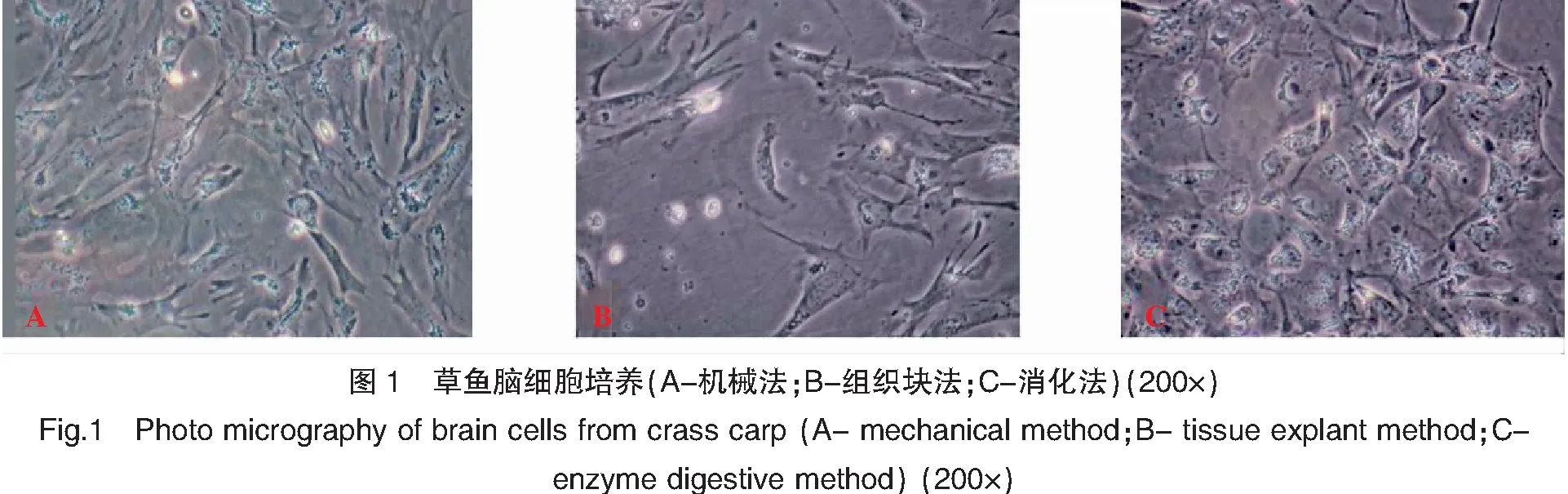
2.2 原代培养及细胞活力
在5 d培养期内,细胞数量如表1所示,培养24 h细胞数目为2.53×106个/mL,而培养48~72 h细胞数目明显增多,约为原来数量的2.6倍,但是随着培养时间的增长,细胞进入衰退期,细胞数目减少至5.2×105个/mL。

表1 不同培养时间草鱼脑细胞的细胞数目(106个/mL)
细胞活力随培养时间的变化如图2所示,草鱼原代脑细胞的活力在前3 d培养期内基本保持稳定,第4天开始下降,第4、5天的细胞活力分别比第1天下降了11.7%和34.8%,说明3 d培养期是进行原代草鱼脑细胞体外实验比较合适的时间段。

3 讨论
目前,鱼类细胞作为研究工具颇受关注,已经被应用到鱼类肿瘤学、环境毒理学、遗传学、内分泌学、生理学和资源保护等方面。与体内实验相比较,鱼类细胞培养具有一定优势:细胞培养产品标准化程度高、均一性好;鱼类离体培养细胞尤其是原代培养细胞,其生理生化功能接近在体状态,能够快速获得实验结果;而且可根据鱼类生长阶段,进行不同时期影响研究;可重复性高,离体条件下可以更为精确控制实验条件,有针对性地开展研究[1,3-4]。因此,本研究成功进行了草鱼脑细胞的原代培养,为进一步开展体外生理调控机制研究提供基础。
鱼类种类、年龄以及不同组织器官的生理结构不同,不同细胞内环境也存在很大差异,因此,不同组织器官材料的取材方法、培养方式以及培养条件也因细胞而异[5]。本实验尝试了不同的培养方法以获得草鱼原代脑细胞。组织块固定法操作相对简单,但是获得单层细胞时间较长,细胞得率较低。消化法细胞获得量大,均一性较好,贴壁后可迅速形成单层细胞,但是要根据不同组织调整消化酶浓度以及消化时间,否则消化过度会损伤细胞。机械法操作同样相对简便、快速,但对组织机械损伤较大,且细胞分散效果差于消化法,仅对纤维成分少的软组织,如脑组织、胚胎组织较为适用[4]。本研究比较了以上三种培养方法,其中采用机械法获得草鱼原代脑细胞,细胞分散较为均匀、形态良好。
影响细胞体外培养效果的因素包括血清浓度、培养基、培养温度等。不同研究在进行不同物种的脑细胞培养时所采用的体系不尽相同。血清浓度与培养基大多采用含有10%~20%胎牛血清的L-15培养基[6-10];哺乳动物多采用37℃作为培养温度,而在鱼类培养细胞实验中采用的温度因种类不同而有所差异,如培养青石斑鱼28℃[6],斜带石斑鱼30℃/35℃[7],罗非鱼脑细胞25℃[7],卡特拉鱼脑细胞28℃[8],海鲈鱼22℃[9],玳瑁石斑鱼30℃[10]本研究用含有10%胎牛血清的L-15培养基在28℃进行培养,获得了生长相对稳定的脑细胞,可能是由于物种不同,细胞培养条件也存在一定的差异。鱼类是变温动物,在一定的温度范围内可以保持细胞功能和生理的完整性,对于鱼类细胞培养温度的选择方面尚无定论。草鱼最适生长温度为25~32℃,而在27~30℃时代谢最为活跃,细胞培养最佳温度与其基本一致。
细胞能够在体外培养体系中保持活力,是进行体外生理机制研究的基础。本研究分离了草鱼的原代脑细胞,而且可以获得较高的细胞产率,从而可以满足后续鱼类脑部生理规律及其调控机制研究实验的需要。并且本实验采用比色法检测细胞活力,代谢活跃的细胞将新型四唑化合物MTS生物还原成一种有色甲臢产物。结果显示,原代脑细胞的活力可以稳定地保持3 d,超过3 d后,细胞明显退化。因此在当前培养条件下所制备的原代鱼脑细胞可用于部分生理机制的离体分析。近年来,国内外学者对鱼类脑细胞培养进行了大量研究[6-11]。利用鱼类原代脑细胞进行离体测试已得到应用,主要包括鱼类病毒感染与细胞毒性实验[2,6,10-11],以及持久性有机污染物的毒理学相关研究[12];但是持久细胞系随着代数的增加,其细胞的基因型和表型都有可能发生改变,导致某些重要的生理功能和分化特征丧失,实验稳定性较差;而鱼类细胞的原代培养是从活体动物获取组织细胞后在体外进行的首次培养,细胞刚刚离体,生物性状尚未发生很大变化,大多数细胞表现出原有组织的特性,在一定程度上更能反映体内状态,测试的结果比较准确,重复性好[13-14]。
目前,鱼类细胞培养已被应用于鱼类生理、毒理等分子机制研究,但是其应用广度远远不及其在哺乳动物上的应用。本研究进行了草鱼脑细胞原代培养的初步探索,后续需要开展进一步的工作:完善细胞培养条件以建立持久细胞系;采用特定因子进行细胞鉴定;利用培养细胞进行神经生理机制研究;开展离体实验与在体实验结果对比,探讨两者区别与联系,建立有效的评价指标,使离体实验结果与在体实验结果对应,建立体外实验的细胞模型。

