等电点沉淀法提取牡蛎蛋白及其蛋白组成分析
姜燕蓉,张亚飞,齐筱莹,王丹妮,田茂鸿,赵 慧
(大连海洋大学食品科学与工程学院,辽宁 大连 116623)
牡蛎(又称海蛎子)是软体动物门、瓣鳃纲、异柱目、牡蛎科的双壳贝类,是世界第一大养殖贝类,也是中国养殖产量最大的经济贝类[1]。牡蛎含有糖原、维生素、牛磺酸和铜、铁、锌等微量元素,其营养成分丰富。而且牡蛎中蛋白质含量较高,可以作为良好蛋白质来源[2-3]。但是,目前我国对牡蛎各部分的加工利用研究较少,对其蛋白质的相关性质也尚不清楚,使得牡蛎的合理加工和高值化应用受到一定的限制。
等电点沉淀法是通过在较低pH值或较高pH值条件下使蛋白质溶解,通过离心或过滤将其与不溶性物质(骨骼、皮肤或脂质)分离,然后使其在等电点下沉淀获得高含量蛋白质的过程[4]。蛋白质中的氨基酸在pH值变化时会发生一定程度的电离,导致其在溶液中的溶解度发生变化[5]。相比较盐析法、有机溶剂萃取法和酶水解法等其他蛋白质提取分离方法,等电点沉淀法具有蛋白质回收率高、蛋白质变性程度小、安全性较好等优点[6]。不同来源的分离蛋白因含有的氨基酸不同导致其溶解和沉淀pH值不相同。鱿鱼和鳙鱼蛋白在pH值为3和11的条件下溶解,当pH值为5.5时沉淀获得的分离蛋白提取率分别高达75%和79%[7-8]。在料液比1∶9、溶解pH值2.0~3.0和12.0~13.0、沉淀pH值5.5条件下,斑节对虾蛋白提取率为75.67%~82.72%[9]。
本研究以牡蛎为原料,将等电点沉淀法应用于牡蛎蛋白的制备,通过优化提取温度、溶解pH、提取时间和沉淀pH四个主要影响因素,确定牡蛎蛋白制备的最佳碱溶工艺条件,并对牡蛎中各蛋白组分进行了分析,通过聚丙烯酰胺凝胶电泳(SDS-PAGE)测定了其分子质量分布,以期为进一步加工利用牡蛎蛋白提供理论依据。
1 材料与方法
1.1 原料处理与试剂
牡蛎(大连湾牡蛎,Ostreamtailienwhanensis),购于大连黑石礁海鲜市场,新鲜贝肉去壳去内脏,清洗干净,匀浆后冷冻干燥得到牡蛎冻干粉;混合蛋白质标准品:Takara宝生物工程有限公司;NaOH、乙醇、三氯乙酸等试剂:均为分析纯。
1.2 仪器设备
BS-224S分析天平:赛多利斯科学仪器有限公司;BL25B36匀浆机:广东美的生活电器制造有限公司;SYG-2恒温水浴锅:常州朗越仪器制造有限公司;H-1850R离心机:湘仪离心机仪器有限公司;SCIENTZ-10ND冷冻干燥机:宁波新芝生物科技股份有限公司;SP-721E 721分光光度计:上海光谱仪器公司;KDN-08消化炉:金坛市指前镇旭日实验仪器厂;马弗炉;JJ-1磁力搅拌:常州国华电器有限公司;PHS-25 pH计:上海雷磁仪器有限公司;MD 77透析袋(MW:12~14 kDa):美国联合碳化物公司。
1.3 实验方法
1.3.1 基本成分的测定
水分含量的测定:GB 5009.3—2016《食品中水分的测定》,直接干燥法;
灰分含量的测定:GB 5009.4—2010《食品中灰分的测定》,灼烧称重法;
粗蛋白质含量的测定:GB 5009.5—2016《食品中蛋白质的测定》,微量凯氏定氮法;
粗脂肪含量的测定:GB 5009.6—2016《食品中脂肪的测定》,索氏抽提法;
总糖含量的测定:GB 5009.7—2016《食品中总糖的测定》,苯酚硫酸法;
1.3.2 最佳碱溶工艺优化
对Palafox H等[7]的方法稍作修改,进行牡蛎分离蛋白的制备。
称取一定质量牡蛎冻干粉,加入蒸馏水溶解后(料液比1∶3)均质化,加入0.1 mol/L NaOH溶液提取分离蛋白,4℃、9 000 r/min离心20 min,收集上清液,测定蛋白质含量。固定碱溶提取条件为提取温度25℃、溶解pH值11.0、提取时间1.5 h。本文考察了提取温度(10、20、30、40、50、60、70、80℃)、溶解pH值(9.0、10.0、11.0、12.0、13.0)和提取时间(0.5、1.0、1.5、2.0、2.5 h)三种因素对碱溶过程中牡蛎分离蛋白溶解性的影响。
1.3.3 最佳沉淀pH值工艺优化
通过1.3.2条件制备蛋白提取液后,用0.1 mol/L HCl调节溶液将pH值调节为3.2、3.6、4.0、4.4、4.8、5.2、5.6、6.0,在4℃下放置1 h后,4℃、8 000 r/min离心15 min,分别收集沉淀和上清液,上清液采用100 mL容量瓶定容,进行蛋白质含量的测定,从而确定最佳酸沉pH值。
1.3.4 牡蛎蛋白组分分离
参照Osborne分级法[10]对牡蛎匀浆中四种蛋白质进行分级分离。
1)采用500 mL蒸馏水溶解100 g牡蛎冻干粉→室温搅拌2 h→4℃、8 000 r/min离心20 min→沉淀重复水提2次,合并2次上清液→冷冻干燥→水溶性蛋白。
2)在1)所得的沉淀中加入1 000 mL 50 mmol/L pH 8.0的Tris-HCl缓冲液(含500 mL 0.5 mol/ L NaCl)进行溶解→室温搅拌2 h→4℃、8 000 r/min离心20 min→沉淀中加500 mL 0.5 mol/L NaCl提取→合并2次上清液→4℃、去离子水中透析(MWCO:8 000 Da)72 h→蛋白质离心→沉淀进行冷冻干燥→盐溶性蛋白。
3)在2)所得的沉淀中加入1 000 mL 45%的乙醇进行溶解→室温搅拌2 h→ 4℃、8 000 r/min离心20 min→沉淀加入500 mL 45%的乙醇后离心→合并2次上清液→浓缩→冷冻干燥→醇溶性蛋白。
4)在3)所得的沉淀中加入1 000 mL 0.05 mol/L NaOH进行溶解→室温搅拌2 h→4℃、8 000 r/min离心20 min→沉淀中加入500 mL 45% NaOH后离心→合并上清液,边搅拌边向其中滴加20%(W/V)三氯乙酸,至三氯乙酸的最终浓度为5%(W/V)→4℃、10 000 r/min离心20 min→沉淀用预冷的丙酮洗涤三次→热风干燥→碱溶性蛋白。
1.3.5 牡蛎各蛋白组分分析
蛋白质含量的测定根据GB 5009.5—2016,蛋白质转换系数为6.25,其中:



1.3.6 牡蛎各蛋白组分SDS-PAGE电泳测定
用5% SDS将1.3.3和1.3.4得到的蛋白质溶解,然后用上样缓冲液(β-巯基乙醇)处理样品,采用R250考马斯亮蓝进行染色。SDS-聚丙烯酰胺凝胶电泳条件为5%浓缩胶、12%分离胶。通过Gel-Pro Analyzer分析软件对电泳图谱进行分析。
1.3.7 统计与分析
所有实验均重复三次,实验结果采用平均值±标准偏差的方式进行表述。数据采用SPSS 22.0和Excel进行处理分析。
2 结果与分析
2.1 牡蛎基本成分组成
牡蛎的基本成分组成结果如表1所示。新鲜牡蛎中水分含量为81.42%,牡蛎冻干粉中粗蛋白含量达到57.21%,总糖含量为33.09%,粗脂肪含量为3.08%,灰分含量为6.48%。结果显示牡蛎中含有丰富的蛋白质,这与邱娟等[11]研究的结果一致。在去内脏牡蛎中,还含有较高含量的灰分,是因为牡蛎中含有相当含量的矿物质元素,如Mg、Ca、Fe、Zn和Al等。

表1 牡蛎基本成分分析(干基)
2.2 等电点沉淀法提取牡蛎蛋白工艺优化
2.2.1 提取温度对牡蛎蛋白含量的影响
提取温度对牡蛎蛋白含量的影响如图1所示。由图所知,在10~80℃的温度范围内,牡蛎蛋白含量随提取温度的增加变化并不显著。并且在高温条件下提取蛋白质的含量并无显著变化,与董淑华等[12]在4~50℃提取鸢乌贼蛋白结果一致。这可能是由于牡蛎蛋白并未发生变性,高温可能只是使其部分蛋白质失活,所以对分离蛋白含量影响不大。因此,在室温条件下进行提取操作即可。

2.2.2 溶解pH值对牡蛎蛋白含量的影响
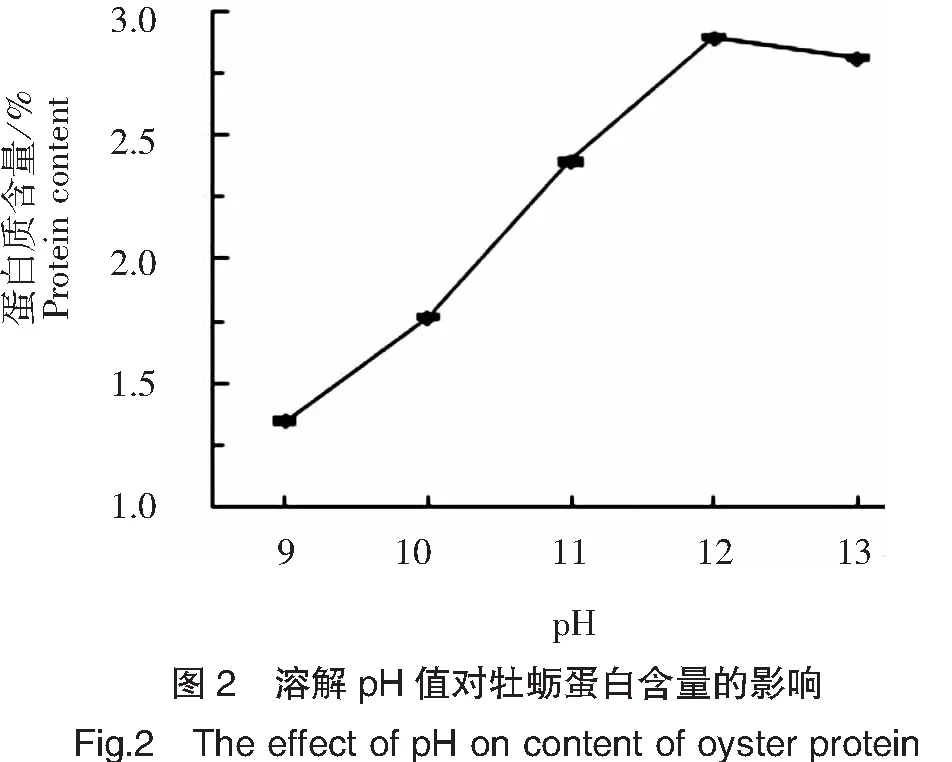
溶解pH值对牡蛎蛋白含量的影响如图2所示。由图2可知,牡蛎蛋白的含量随pH值的增加呈现先上升后下降的趋势,当pH值为12.0时,牡蛎蛋白含量达到2.8%,之后蛋白质含量下降,可能是过高的pH值造成蛋白质变性,使其沉淀析出,从而使最后上清液中蛋白质含量降低。由此可知,pH值为12.0时,牡蛎蛋白溶解性较好,pH值过高、过低都会造成蛋白含量下降。因此根据实验结果,选取pH值为12.0为最佳提取pH值。
2.2.3 提取时间对牡蛎蛋白含量的影响
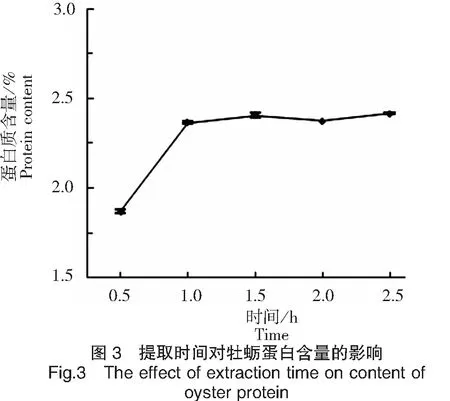
提取时间对牡蛎蛋白含量的影响如图3所示。根据图3可知,当提取时间为0.5~1.0 h时,延长提取时间,溶液中牡蛎蛋白含量增加。当提取时间延长至1.0 h以后,其对牡蛎蛋白含量并无明显影响。说明碱提1.0 h,碱溶体系达到平衡。因此选择溶解时间为1.0 h。
2.2.4 沉淀pH值对牡蛎蛋白含量的影响
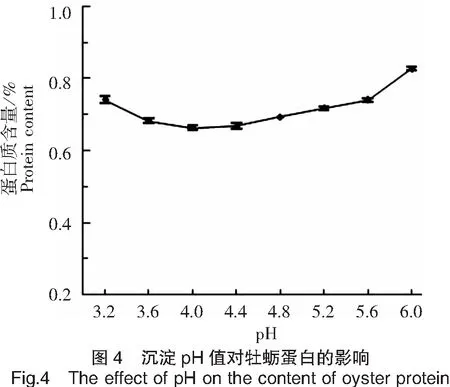
沉淀pH值对牡蛎蛋白含量的影响如图4所示。当pH值为3.2~4.0时,溶液中蛋白质含量随着pH值的增加呈现下降的趋势,并在pH 值达到4.0时分离蛋白含量最低(0.66%),pH值在4.0~6.5范围内时,蛋白含量随pH值增加而增加。以上结果说明蛋白最佳酸沉范围在4.0~4.4之间。综合考虑,选择最佳酸沉pH值为4.0。
2.2.5 提取验证试验
综合上述结果确定碱溶提取工艺:在室温条件下,调整溶解pH值为12.0,碱提时间为1.0 h,离心后将上清液pH值调整至4.0,再次离心取沉淀。将沉淀通过8~12 kDa透析袋透析除盐,冷冻干燥后得到牡蛎蛋白。在此条件下制备得到的牡蛎蛋白提取率为65.6%,蛋白纯度为84.3%。陈丽等[13]采用有机溶剂萃取法提取12 h,得到褶牡蛎蛋白提取率仅为21.15%,远低于等电点沉淀法提取牡蛎蛋白的提取率。等电点沉淀法可以有效提高牡蛎蛋白的提取率,为牡蛎产品高附加值加工和利用提供理论依据。
2.3 牡蛎蛋白的分离
去内脏牡蛎肉中富含蛋白质,为明确牡蛎蛋白各组分的含量特点及功能特性,利用传统的Osborne蛋白分级方法,根据每种蛋白组分溶解特性的区别,提取得到四种蛋白组分结果如表2所示。
盐溶性蛋白在肌肉中种类丰富,含量较多。主要由肌原纤维蛋白组成,包括肌球蛋白重链(MHC)、轻链(MYL)、肌动蛋白(Actin)和软体动物特有的副肌球蛋白(PM)和相对分子质量较小的原肌球蛋白等[14]。在牡蛎蛋白中,盐溶性蛋白提取率为49.82%,纯蛋白组分占原料的18.51%,是牡蛎蛋白中优势蛋白组分。水溶性蛋白主要指存在于肌肉细胞肌浆中的肌浆蛋白,主要成分是代谢相关的酶蛋白,如乳酸脱氢酶、醛缩酶、TG酶等,其成分较为复杂[15]。牡蛎肌肉中水溶性蛋白纯蛋白组分占原料的8.82%,提取率为12.03%,相比较鱼台鱼蛋白中水溶性蛋白的含量(76.12%),牡蛎蛋白中水溶性蛋白含量较少[16]。碱溶性蛋白和醇溶性蛋白提取率分别为14.64%和7.42%,其纯蛋白组分分别占原料的10.49%和1.44%。因此,牡蛎蛋白各级组分中含量依次为盐溶性蛋白>碱溶性蛋白>水溶性蛋白>醇溶性蛋白。将该结果与张晶晶等对近江全牡蛎蛋白各组分含量分析结果[17]进行比较发现,全牡蛎蛋白中水溶性蛋白含量较高(37.79%),而盐溶性蛋白含量(31.10%)低于去内脏牡蛎(49.82%),这可能是由于在去除内脏的过程中造成了内源性蛋白酶的大量损失,从而造成水溶性蛋白含量较低。
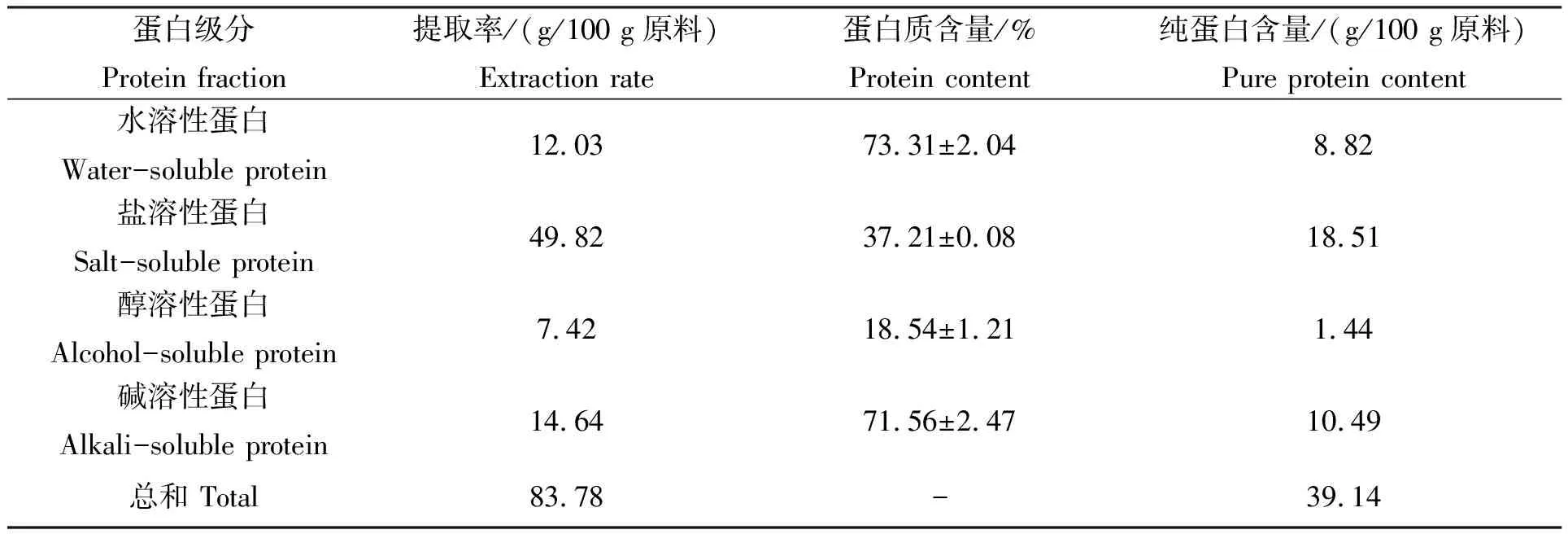
表2 牡蛎各蛋白组分的提取结果
注:提取率为3次提取得率平均值±SD。
Note:Values were shown as mean±standard deviation of three determinations.
2.4 牡蛎各级蛋白分子量分布
目前,SDS-PAGE技术已被广泛应用于水产蛋白质分子量分布的研究[17-18]。本研究以β-巯基乙醇为上样液,比较了经上样液处理和未经上样液处理的样品差异性,并对等电点沉淀法提取的分离蛋白、盐溶性蛋白、水溶性蛋白、碱溶性蛋白和醇溶性蛋白的分子量分布进行了分析,结果如图5所示。
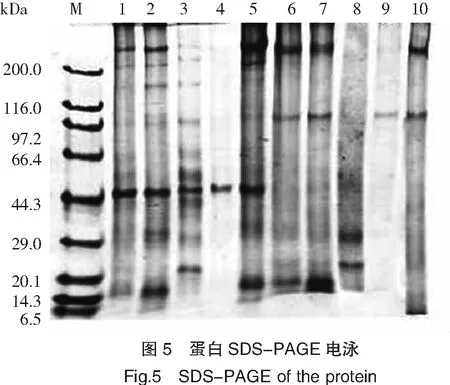
注:泳道M:Marker标准蛋白;泳道 1~5(经β-巯基乙醇处理的样品),依次为pH调节法制备的分离蛋白、水溶性蛋白、盐溶性蛋白、醇溶性蛋白和碱溶性蛋白;泳道 6~10(未经 β-巯基乙醇还原处理的蛋白样品),依次为pH调节法制备蛋白、水溶性蛋白、盐溶性蛋白、醇溶性蛋白和碱溶性蛋白。
Notes:Lane M:Marker standard protein;Lane 1 to 5(Samples were treated with β-mercaptoethanol):isoelectric precipitation of protein,water-soluble protein,salt-soluble protein,alcohol-soluble protein and alkali-soluble protein,respectively;Lane 6 to 10(Samples were not treated with β-mercaptoethanol):isoelectric precipitation of protein,water-soluble protein,salt-soluble protein,alcohol-soluble protein and alkali-soluble protein,respectively.
β-巯基乙醇能够打开蛋白质的二硫键,使蛋白质中的亚基游离出来,所以通常经过β-巯基乙醇处理后的样品电泳条带比未经处理的样品电泳条带多[19]。通过等电点沉淀法制备的蛋白质样品分子量分布比较分散,经上样液处理后的蛋白在44.3 kDa处有明显的条带,而未经上样液处理后的蛋白在97.2 kDa处有明显的条带。这可能是由于β-巯基乙醇使97.2 kDa处蛋白质二硫键打开释放出亚基。
β-巯基乙醇处理后牡蛎盐溶性蛋白分布范围为200.0~250.0 、97.2~200.0、44.3 kDa三部分,所对应的蛋白种类为MHC、PM和Actin。这一结果与贻贝蛋白的电泳条带分布情况[20]相似。但MHC和PM的电泳条带颜色比较浅,说明蛋白含量不高。而未经上样液处理的样品中蛋白主要分布在20.1~40.3 kDa,且经上样液处理的样品中含有分子质量为14.3 kDa的泳道,在同类研究中发现类似特征的蛋白条带,此条带可能是贝类所具备的独特蛋白结构[17]。
水溶性蛋白的分子量分布比较分散,此结果与曹文红等[21]脊尾白虾水溶性蛋白电泳分布结果类似,未经上样液处理的水溶性蛋白在200.0~250.0、97.2与14.3 kDa处有明显条带,与之相比,上样液处理后水溶性蛋白在200.0~250.0、44.3和14.3 kDa处有明显的蛋白条带;上样液处理后醇溶性蛋白在44.3 kDa处有明显的蛋白条带,而未经上样液处理的样品在97.2 kDa存在蛋白条带,推测可能由于β-巯基乙醇处理后蛋白质二硫键被打开,生成了新的结构。但醇溶性蛋白在泳道中颜色浅,说明其含量所占比例较小;碱溶性蛋白的分子量分布比较分散,此结果与郑惠娜等[22]研究结果类似。经β-巯基乙醇处理后碱溶性蛋白在200.0、44.3与20.1 kDa处有明显的蛋白条带,而不经β-巯基乙醇处理后碱溶性蛋白在97.2和200.0 kDa处有明显的蛋白条带。
3 结论
本研究采用等电点沉淀法对牡蛎蛋白提取条件进行了优化,并系统地探索了牡蛎各蛋白组分及其分布特性。在室温、溶解pH 12.0、提取时间1 h、酸沉pH 4.0条件下提取牡蛎蛋白,得到牡蛎蛋白纯度高达84.3%,且该牡蛎蛋白中盐溶性蛋白含量最高,为18.5%,水溶性蛋白、醇溶性蛋白和碱溶性蛋白含量分别为8.8%、1.4%和10.5%。对牡蛎蛋白各组分分子量分布进行分析后发现,牡蛎蛋白中盐溶性蛋白和水溶性蛋白种类丰富,且各组分经β-巯基乙醇处理后出现新的条带,这可能是由于蛋白质二硫键被打开,使亚基游离出来。值得注意的是在同类研究中发现与分子量分布在14.3 kDa蛋白条带特征类似的条带,推测可能是贝类特有的蛋白质,但该蛋白结构和功能尚不清楚,下一步将对其进行更深入地研究与讨论。

