敲减CDKL5对人胶质母细胞瘤细胞生长和细胞周期的影响
张惊宇, 丁 婧, 郑永慧, 初婷婷, 赵琳琳, 杨滨瑞, 高 腾
X染色体连锁基因CDKL5(cyclin-dependent kinase-like 5,周期蛋白依赖型激酶样5)基因编码一个丝氨酸/苏氨酸激酶,故又名STK9(serine-threonine kinase 9)。CDKL5的基因突变可导致Rett综合征等神经类疾病,因此目前的研究重点聚焦于CDKL5在神经元中的功能以及与雷特综合征等神经系统疾病的关联上[1],但CDKL5基因在胶质瘤[2]、胃癌[3]、卵巢癌[4]、黑素瘤[5]和结肠癌[6]中有错义突变和同义突变。CDKL5是白血病抗原之一,经常在成人T淋巴细胞白血病中高表达,可作为肿瘤免疫治疗的靶标[7]。目前,对于CDKL5的功能性研究较少,CDKL5的表达随神经瘤细胞的分化而不断上调,本研究主要敲除人胶质母细胞瘤细胞U87中的CDKL5,发现敲减后显著抑制U87的细胞增殖,使细胞周期发生停滞,这可以为之后CDKL5作为肿瘤治疗的靶点提供理论依据。
1 材料和方法
1.1 实验材料 载体pLKD-UBC-GFP-U6-shRNA(纽恩生物科技公司)、细胞培养板(美国corning)、所有培养基及添加剂(美国Gibco)、BCA蛋白定量试剂盒(碧云天)、MTT即3-(4,5-dimethylthiazole-2-yl)-2,5-diphenyl tetrazolium bromide,中文名3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(上海生工公司)、细胞周期检测试剂盒(美国,sigma)。
1.2 实验方法
1.2.1 细胞培养 人胶质母细胞瘤细胞系U87使用MEM培养基,添加10%胎牛血清、1% Glutamax和1%青霉素+链霉素、1%非必需氨基酸和1%(1 mmol)丙酮酸钠。细胞均置于37 ℃恒温培养箱中培养,湿度100%,CO2浓度5%。
1.2.2 质粒构建 利用慢病毒感染人胶质母细胞瘤细胞U87同时导入CDKL5 shRNA,构建CDKL5 shRNA所用的载体为pLKD-UBC-GFP-U6-shRNA。实验涉及的shRNA序列为shCDKL5 R:5’-3’CCGGGGAGCCTATGGAGTTGTAC TTCAAG;F:5’-3’ AGAGTACAACTCCATAGGCTCCTTTTTTG。质粒委托纽恩生物技术公司包装制成慢病毒颗粒浓缩液。
1.2.3 蛋白免疫印迹 分别提取细胞蛋白和组织蛋白,BCA定量后(碧云天)进行蛋白免疫印迹检测,上样量为45 μg/孔。蛋白质经SDS-聚丙烯酰胺凝胶电泳分离后转移到硝酸纤维素膜(NC膜)上(200 mA电流,室温转膜2 h),用含5%脱脂奶粉的TBS-T室温封闭2 h,将稀释后的一抗稀释液敷于膜上,4 ℃过夜。清洗一抗3遍后,1000∶1加入辣根过氧化物酶标记的抗鼠二抗,室温孵育1 h,清洗二抗后,用ECL化学发光反应进行显色。在暗室中将X光片放入膜上曝光,再进行显影、定影反应。将胶片进行扫描,用Image J软件测定蛋白条带灰度,复制数据到Excel表中分析蛋白表达量差异。
1.2.4 MTT分析 MTT粉末用D’Hanks配成5 mg/ml的溶液,滤膜过滤,4 ℃避光保存。 慢病毒感染4 d后,消化细胞,通过细胞计数,制备1×104/ml的细胞悬液。在96孔培养板的每孔中加入150 μl悬液,即1500个细胞/孔。自4 h细胞贴壁始,每隔24 h在一个培养板的每个孔中加入15 μl的MTT溶液,共5 d。37 ℃孵育4 h。吸去培养基,加入150 μl DMSO,在酶标仪测定490 nm波长下的吸光值。此绝对吸光值减去对应DMSO的吸光值,为相对吸光值。
1.2.5 细胞周期分析 收集细胞加入2 ml -20 ℃预冷的70%乙醇,重悬,-20 ℃固定过夜。离心后弃上清,用50 μg/ml(Thermo Scientific公司)重悬细胞沉淀,37 ℃孵育30 min。1 mg/ml的碘化丙啶储存液(Sigma-Aldrich公司)按1∶20加入到细胞悬液中,37 ℃避光孵育30 min。用BD FACSCalibur流式细胞仪(BD Bioscience公司)检测,每个样品检测10000个细胞。FlowJo软件分析DNA倍体(FLH2通道荧光强度)和细胞数,即细胞周期分布。
1.3 统计学分析 SPSS 18.0软件进行统计学处理,t检测分析组间的显著性差异。P<0.05表示有显著性差异。
2 结 果
2.1 CDKL5在人胶质母细胞瘤细胞系U87中的表达情况 由结果所示,在U87细胞系中CDKL5分为2个亚型,在细胞核和胞质中均有表达(见图1A);通过shRNA 敲减CDKL5的可以有效降低细胞质内的CDKL5的表达(见图1B);敲减CDKL5后细胞形态发生显著变化,由原来长梭形变得不规则(见图1C)。
2.2 敲减CDKL5抑制胶质母细胞瘤细胞的体外生长 通过血细胞计数,我们发现,敲减CDKL5会显著抑制细胞增殖,MTT分析显示,敲减CDKL5抑制U87细胞的活性降低(见图2A);流式细胞术实验显示,敲减CDKL5后U87细胞的进程被阻止在G2/M期(见图2B)。
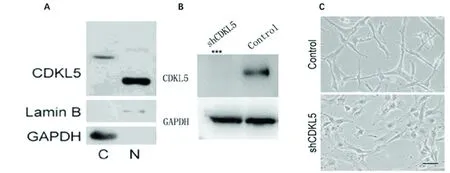
A.胶质母细胞瘤细胞中不同CDKL5蛋白亚型在细胞浆和细胞核中的分布;B.蛋白免疫印迹检测人胶质母细胞瘤细胞系U87中CDKL5蛋白的表达。细胞表达有对照shRNA(Control)或敲减CDKL5的shRNA(shCDKL5);C.敲减 CDKL5 引起胶质母细胞瘤细胞形态的改变。 放大倍数,×200;标尺, 50 μm
图1 CDKL5在人胶质母细胞瘤细胞系U87中的表达

A.血细胞技术法分析细胞增殖和MTT法检测细胞活性;B.流式细胞仪检测细胞周期分布
3 讨 论
此前研究发现,神经母细胞瘤中的CDKL5是抑癌蛋白。神经母细胞瘤SH-SY5Y中,过表达CDKL5将细胞周期阻滞在G0/G1期而抑制细胞增殖,同时促进细胞向神经元方向分化,而敲减CDKL5则产生相反的表型[8~10]。然而,此研究的初衷并非为了考察肿瘤中CDKL5的表达和功能,而是仍然关注CDKL5与神经疾病的关系。我们认为这些结果表明CDKL5能促进神经前体细胞的分化和神经元的成熟,并结合文献推测CDKL5可能通过阻滞细胞周期、抑制细胞周期蛋白来促进分化的[11~13]。或许是胶质细胞中CDKL5低表达的缘故,至今未有研究关注CDKL5对胶质细胞成熟的影响和在胶质瘤发展中的作用。本研究发现,CDKL5蛋白具有多个亚型,前期也有相关报道,CDKL5的亚型分类与定位[14,15]。我们发现亚型之一的CDKL585在胶质母细胞瘤细胞U87的细胞质中高表达,敲减CDKL5后抑制胶质母细胞瘤细胞的增殖。后期我们可以检测在神经胶质母细胞瘤组织中CDKL5的表达情况与肿瘤特性的相关性,我们的研究可以为以后胶质母细胞瘤的治疗提供新的理论基础。

