锰中毒对SH-SY5Y细胞线粒体自噬作用的影响
李慧颖,陆潭丽,王 进
(广西医科大学,广西 南宁 530021)
帕金森病(PD)是第二大神经退行性疾病,多发于65岁以上人群[1]。大多数PD患者为散发的特发性PD,其发生考虑与环境、遗传因素之间的相互作用有关。PD的神经病理特征包括中脑黑质致密部多巴胺能神经元的丢失和含有α-突触核蛋白的路易小体的蓄积[2]。广西具有丰富的锰矿资源,然而过量的锰暴露是一种公认的环境健康危险因素,可诱导类似帕金森病的锥体外系功能异常[3]。环境锰污染及其引起的中毒性帕金森综合征是一个重要的公共卫生问题,但其发病机制尚未完全清楚。线粒体通过不断分裂和融合,可控制细胞的大小、形态和数量,以维持细胞的正常活动[4]。线粒体的稳态被破坏和线粒体功能紊乱在神经退行性疾病的病理生理过程中起着重要作用,进一步凸显了这些细胞器的重要性,特别是在神经元中的重要性[5]。而在神经组织中,锰对线粒体具有特殊亲和力,会特异性蓄积在富含线粒体的神经细胞和神经突触中,最终导致神经元功能障碍和病理损伤。本研究旨在探讨锰中毒对SH-SY5Y细胞多巴胺分泌以及线粒体动力学的影响,为锰中毒性帕金森综合征的病理机制提供理论依据。
1 材料与方法
1.1 主要试剂及仪器 氯化锰 (MnCl2)购于美国Sigma公司(批号:WXBC7094V);胎牛血清(FBS)购于美国Gibco公司(批号:1982158C);DMEM基础细胞培养基购于美国Corning公司(批号:08018008);胰酶(批号:20180506)、1%青-链霉素(批号:20180602)、磷酸盐缓冲液(PBS,批号:20180807)均购于北京索莱宝科技有限公司;人多巴胺酶联免疫试剂盒购于CUSABIO技术有限公司(批号:C123060148);β-actin(14)、LC3(11)、Mfn1(1)、Mfn2(3)、Drp1(3)抗体及荧光二抗(9)均购于美国CST公司;BCA蛋白质测定试剂盒购于上海碧云天生物技术有限公司(批号:P0012S);CCK-8试剂盒购于日本同仁化学研究所(批号:LQ732)。ELX800型酶标仪产于美国Bio-Tek公司;PowerPac Basic型电泳仪产于美国Bio-Rad公司;9120型Odyssey双色红外激光成像系统产于美国LI-COR Biosciences公司。
1.2 细胞株及细胞培养 人神经母细胞瘤细胞SH-SY5Y获赠于中山大学肖友生博士。细胞置于含有10%FBS及1%青-链霉素的DMEM基础培养基中,放入37℃、5%CO2饱和湿度的细胞培养箱中培养。
1.3 实验分组及给药 根据预实验结果,取对数生长期SH-SY5Y细胞(500μmol/L为预实验中细胞自噬的最佳浓度),加入含500μmol/LMnCl2的培养基培养24 h作为MnCl2组,而用不含MnCl2的普通培养基培养24 h的细胞作为正常对照组[6]。
1.4 细胞毒性测定 采用CCK-8法检测不同浓度MnCl2作用于SH-SY5Y细胞的细胞活力。将SHSY5Y细胞接种于96孔板中,待细胞贴壁后,用含不同浓度MnCl2(0μmol/L、125μmol/L、250μmol/L、500 μmol/L、1000μmol/L和2000μmol/L)的培养基处理细胞24h。干预结束后,每孔加入含10μl CCK-8溶液的DMEM基础培养基,置于37℃细胞培养箱中孵育2h。最后使用酶标仪在450 nm波长处测定吸光度值。细胞存活率计算公式为 IC(%)=[(As-Ab)/(Ac-Ab)]×100%。As:实验孔(含有细胞的培养基、CCK-8、MnCl2);Ac:对照孔(含有细胞的培养基、CCK-8,不含 MnCl2);Ab:空白孔(不含细胞和 MnCl2的培养基、CCK-8)。
1.5 ELISA检测多巴胺(DA)含量 将SH-SY5Y细胞在冰上清洗后移入离心管中,用1×PBS(pH7.2~7.4)稀释至浓度 100 million/ml,将 SH-SY5Y 细胞悬液放入-20℃冰冻24 h后经室温解冻,经2轮反复冻融破坏细胞膜后,于2~8℃5 000 g离心5 min,取上清液即刻进行ELISA检测,严格按照试剂盒说明书进行操作。
1.6 Western Blot法检测 LC3、Mfn1、Mfn2 及 Drp1蛋白表达 SH-SY5Y细胞用冰PBS清洗2次,冰上裂解并收集细胞,离心后收集上清液即为组织蛋白,BCA法进行蛋白定量,煮沸使蛋白变性;用SDSPAGE 分离蛋白(美国 Bio-Rad,恒压 140 V,1 h),将蛋白转移至PVDF膜,5%脱脂奶粉封闭0.5 h;TBST洗膜3次,分别加入相应一抗,4℃孵育过夜;TBST洗膜3次,加入二抗于室温下孵育1 h,免疫印迹显色。
1.7 统计学方法 采用 SPSS17.0统计软件对数据进行分析处理,计量资料以均数±标准差(x±s)表示,组间比较采用组间差异经单因素方差分析及两独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 MnCl2对SH-SY5Y细胞存活率的影响 见表1。检测结果显示,125~2 000μmol/L的 MnCl2对SH-SY5Y的增殖抑制作用呈浓度依赖性,不同浓度MnCl2对SH-SY5Y细胞的增殖均起到明显抑制作用。MnCl2作用24 h抑制SH-SY5Y增殖的IC50浓度为 587.21±15.02 μmol/L。
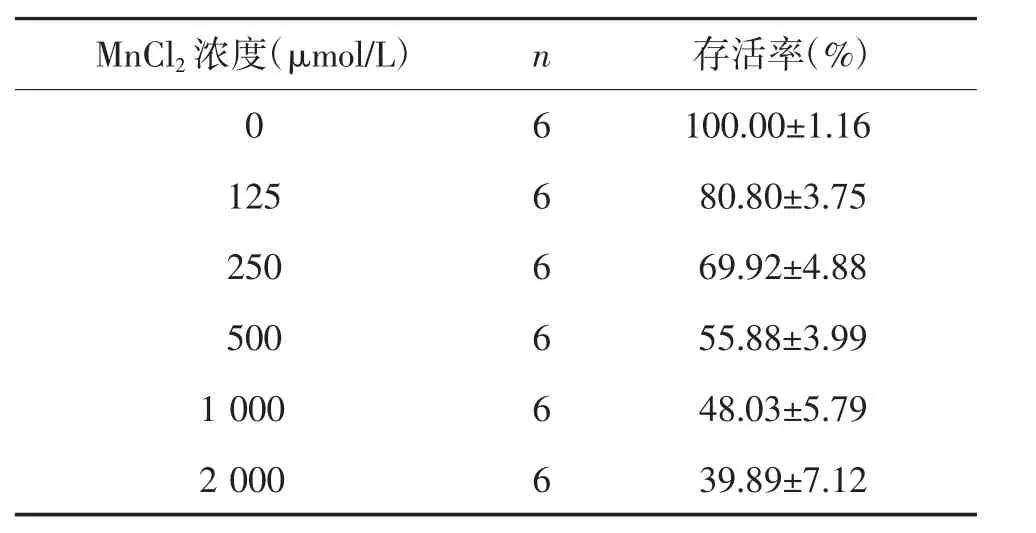
表1 MnCl2对SH-SY5Y细胞存活率的影响 (x±s)
2.2 MnCl2对SH-SY5Y细胞多巴胺的影响 与正常对照组相比较,MnCl2组的多巴胺分泌量显著减少(P<0.05),见表 2。
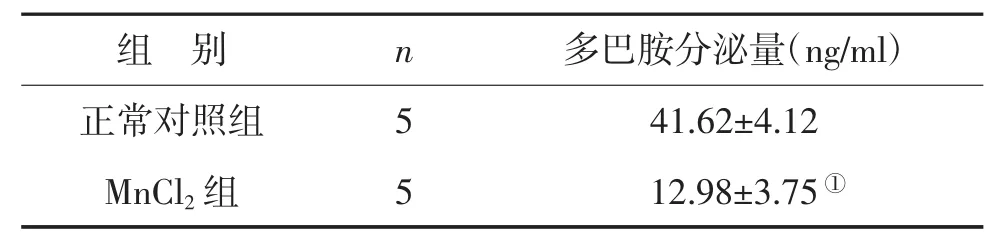
表2 MnCl2对SH-SY5Y细胞多巴胺的影响 (x±s)
2.3 MnCl2对 SH -SY5Y 细胞 Mfn1、Mfn2、Drp1及 LC3蛋白表达的影响 与正常对照组相比较,Mn-Cl2组的LC3-Ⅱ表达明显增加 (P<0.05),Drp1表达明显降低(P<0.05),Mfn1 及Mfn2表达明显增加(P<0.05),见图 1、表3。
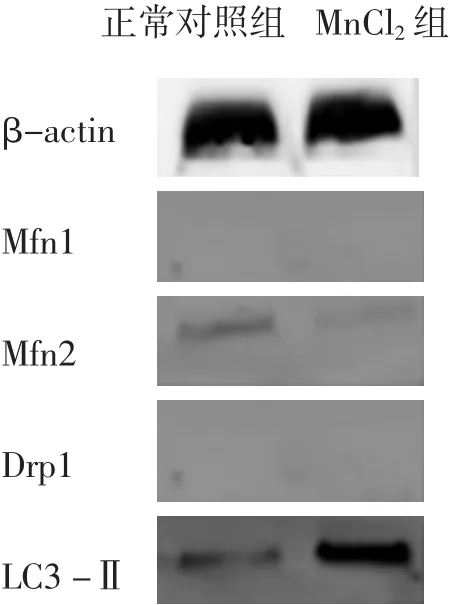
图1 WB检测各蛋白含量结果

表 3 MnCl2对 SH-SY5Y 细胞 Mfn1、Mfn2、Drp1及 LC3蛋白表达的影响 (%,x±s)
3 讨论
慢性过量的锰暴露可促进中脑黑质多巴胺能神经元的丢失,因此锰中毒被认为与帕金森病有关。与其他类型的细胞相比,神经元的高能量需求不成比例,尽管大脑神经元只占身体总量约2%,但其可以消耗多达20%的人体总能量[7]。这些不寻常的能量需求是由神经传递及其相关细胞过程(维持静息膜电位、恢复突触后受体的离子平衡、通过Na+和Ca2+泵在动作电位后恢复)以及一系列其他间接相关的内务过程(如脂质和蛋白质合成和周转、小泡运输或微管和肌动蛋白动力学)造成的[8]。这些广泛的能量需求主要是通过TCA循环和线粒体中的OXPHOS产生ATP来满足的,因此,这些通路的紊乱可能对神经元产生特别的影响。生物化学证据表明,脑ATP的大部分用于神经元的神经电活动[9]。因此,线粒体提供足够的能量对神经元的兴奋性和存活至关重要。与其它细胞器相比,线粒体在生理和病理条件下经常发生形态变化[10]。具体而言,线粒体动力学(融合和分裂)调节线粒体网络连接,这取决于细胞的具体代谢需要。
帕金森病的神经生化改变为中脑黑质致密部、蓝斑神经元脱失致上述部位及其神经末梢处多巴胺减少,多巴胺减少≥70%时会产生帕金森综合征临床表现[11]。本实验对SH-SY5Y细胞的多巴胺分泌量进行了研究,发现经锰处理过的SH-SY5Y细胞多巴胺分泌量显著减少,提示锰中毒会导致多巴胺神经元受损,导致锰中毒后的类似帕金森病的锥体外系功能异常。
线粒体融合/分裂平衡的改变尚未在PD中直接显示。尽管对锰中毒的分子机制已有许久,但目前调控机制中仍有大片空白。正常情况下,损伤的线粒体由自噬体识别,分离后与溶酶体融合形成自体溶酶体,最终降解。本实验对SH-SY5Y细胞的线粒体自噬标记蛋白LC3、线粒体分裂蛋白Drp1、线粒体融合蛋白Mfn1、Mfn2的表达水平进行了研究。微管相关蛋白1轻链3(LC3/Atg8)是自噬体膜上的标记蛋白。细胞内存在两种形式的LC3蛋白,LC3-Ⅰ和LC3-Ⅱ。细胞内新合成的LC3其C端被Atg4蛋白酶剪切,成为胞质可溶形式的LC3-Ⅰ。当自噬体形成后,LC3-Ⅰ经剪切和泛素化加工修饰,与自噬体膜表面的磷脂酰乙醇胺(PE)偶联,成为膜结合形式的LC3-Ⅱ并定位于自噬体内膜和外膜。与其他一些定位于自噬体膜上的Atg蛋白不同(仅在自噬过程的某一阶段发挥作用),LC3-Ⅱ始终稳定地保留在自噬体膜上直到与溶酶体融合,因此被用来作为自噬体的标记分子[12]。LC3-Ⅱ的含量或 LC3-Ⅱ/LC3-Ⅰ的比例与自噬体的数量成正相关,在某种程度上反映了细胞的自噬活性。而Mfn1和Mfn2共同介导线粒体的外膜融合[11]。线粒体分裂的关键蛋白Drp1,它控制着线粒体的外膜的分裂[13]。本研究的结果显示,在细胞经锰处理后,Drp1的表达降低,提示线粒体的分裂减少;Mfn1及Mfn2表达增加,提示线粒体的融合增多;LC3-Ⅱ的表达增加,提示细胞自噬增多,自噬活性上升。
综上所述,在神经细胞中,锰对线粒体具有特殊亲和力,容易聚集在富含线粒体的神经元中,锰中毒抑制了线粒体的分裂并促进线粒体的融合,从而导致线粒体自噬的增多,这意味着锰积累的受损线粒体过度自噬导致线粒体功能紊乱也许是锰中毒性帕金森综合征的病因之一,这可为锰中毒性帕金森综合征提供新的治疗靶点并对帕金森病的治疗提供一定的帮助。

