一种肠肌间神经丛胶质细胞无血清原代培养法的建立
权竹声 张晓丽 朱进霞
(首都医科大学基础医学院生理学与病理生理学系,北京 100069)
肠胶质细胞(enteric glial cell,EGC)是肠神经系统的重要组成部分,在维持肠道稳态中发挥重要作用。EGC主要分布于肠壁黏膜下神经丛和肌间神经丛,其中黏膜下神经丛EGC可以调节肠上皮细胞的增生、凋亡及迁移,维护肠黏膜屏障[1-2],而肌间神经丛EGC则在胃肠道动力的调节中发挥重要作用[3-4]。近年来研究显示糖尿病、帕金森病和慢性传输型便秘患者结肠肌间神经丛中的EGC数量、形态和分布明显异常[5-7],而 EGC的异常激活可能是诱导肠易激综合征(irritable bowel syndrome, IBS)结肠动力紊乱的重要因素[8],表明结肠肌间神经丛EGC可能参与了多种疾病的发生、发展,但其具体作用机制目前仍不清楚。原代EGC培养可排除在体环境下的神经体液因素,是深入探讨EGC功能特性的重要方法。目前已有肠道肌间神经丛EGC原代培养方法的报道[9-11],但关于培养过程中成纤维细胞污染的去除,现有方法尚需改进。有研究者尝试应用无血清法去除雪旺细胞培养中成纤维细胞的污染,效果良好[12-13],但此方法尚未运用于EGC的原代培养。本实验方法结合无血清培养改进现有的肌间神经丛EGC原代培养法,有效去除了成纤维细胞污染,获得了纯度较高,活性良好的结肠肌间神经丛EGC,现将具体方法阐述如下,供同行参考。
1 材料与方法
1.1 实验动物
选取成年雄性C57/BL6 品系小鼠(由首都医科大学实验动物部提供),体质量20~22 g,许可证号:SCXK(京)2012-0001,严格按照实验动物福利委员会许可操作,动物在22 ℃±1 ℃温度条件下饲养,给予正常昼夜更替12 h/12 h光照及24 h食物与水分供应。
1.2 小鼠结肠肌间神经丛EGC的原代培养
器械经仔细清洗,75%(体积分数)乙醇浸泡30 min后烘干置于室温备用。小鼠经颈椎脱臼处死,75%(体积分数)乙醇棉球消毒腹部皮肤,沿腹正中线剪开腹腔,迅速取出结肠组织置于通有混合气[95%(体积分数)O2, 5%(体积分数) CO2]的4 ℃ Krebs液中。冲洗肠腔去除内容物,将结肠组织剪成约1 cm长的肠段,置于另一盛有无菌Krebs液的烧杯中重复冲洗2~3次。取一段肠管套在玻璃棒上,去除肠系膜,以精细镊沿肠系膜附着处的肠管纵轴自上而下轻轻划出一纵行肌缺口,用Krebs液湿润的棉签小心剥离纵行肌(肌间神经丛一般附着于纵行肌),置于无菌、通气的4 ℃ Krebs液中,重复以上操作处理其余肠段。收集纵行肌组织于Krebs液中,4 ℃,356g离心30 s,弃上清,将组织移至另一无菌离心管重复以上操作3次以清洗组织。称取Ⅱ型胶原酶13 mg,牛血清白蛋白3 mg溶于10 mL无菌 Krebs液配成消化液备用。组织置于消化液中,剪碎,37 ℃消化60 min,期间通气并震荡。4 ℃,356g离心8 min,入无菌操作间,弃上清,加入5 mL 0.05%(质量分数)胰蛋白酶,37 ℃消化7 min,等体积培养基(DMEM/F12)终止消化。离心,弃上清,1 mL培养基重悬,尼龙网过滤,离心,弃上清,完全培养基[含10%(体积分数)胎牛血清,1%(质量分数)双抗的DMEM/F12]重悬,接种于24孔板中,置于37 ℃,5%(体积分数) CO2培养箱内培养。2 d后镜下观察可见EGC已贴壁,此外还可见呈杆状、悬浮的肌细胞及未消化完全的组织碎屑等,以PBS清洗3次去除悬浮细胞后加入完全培养基继续培养。若有少量肌细胞贴壁,可用0.05%(质量分数)胰蛋白酶消化3 min,即可去除肌细胞而对EGC无影响。之后每2天换液,一周后更换无血清培养基,培养5~7 d,待成纤维细胞脱落殆尽时更换完全培养基,可根据成纤维细胞污染情况重复以上操作,至细胞80%融合后传代。待传至第四代时神经元细胞已死亡,可得到纯度较高的肠胶质细胞。每次实验取4只小鼠结肠纵行肌-肌间神经丛组织,至传代前细胞量可达约6.8×105。
1.3 细胞免疫荧光染色
将细胞悬液接种至预先放有盖玻片的24孔板中,约24 h细胞贴壁良好后进行染色。细胞爬片经PBS洗涤3次×3 min,4%(质量分数)多聚甲醛室温固定30 min,PBS 洗涤3次×3 min,滴加5%(体积分数)驴血清,室温封闭30 min,完成后弃去封闭血清,加入一抗GFAP(04-1031,美国Millipore公司)、S100β(sc-393919,美国Santa Cruz Biotechnology公司)进行双标记,4 ℃过夜孵育。次日取出,弃去一抗(A11055,美国Invitrogen公司),PBS 洗涤3次×10 min,滴加二抗(A21203, 美国Invitrogen公司),避光室温孵育2 h后滴加DAPI,5 min后PBS 洗涤3次,甘油封片,在荧光显微镜下观察并拍摄。共取来自3批细胞的6个随机镜下视野,分别统计GFAP和S100β单阳性或双阳性细胞数在细胞总数中的比例。
1.4 探针负载细胞观察胞内[Ca2+]i变化
细胞传代24 h后,弃去培养基,PBS清洗3次,以5 μmol/L荧光探针fluo-4 AM(S1060,碧云天生物技术公司)负载细胞,避光37 ℃孵育40 min后弃去荧光探针,PBS清洗3次,加入HBSS液,在激光共聚焦显微镜(UltraVIEW Vox,美国PerkinElmer公司)下观察。选择贴壁良好、形态伸展、荧光强度较亮的细胞,设置扫描条件为488 nm波长激发、 39%激光强度、 PMT(790)、 Pinhole(310 μm)、每2 s采集一幅。首先扫描2 min待荧光强度稳定后加药(ATP 10 μmol/L),待荧光强度稳定后终止实验。共取3批细胞进行6次实验,每次实验对视野中细胞进行实时荧光强度数据采集,统计ATP给药后发生胞内钙瞬变的细胞比例及每个反应细胞最大荧光强度与基础荧光强度的比值(Fm/F0)。
1.5 统计学方法

2 结果
2.1 EGC在结肠肌间神经丛的分布
胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)是目前较常用的成熟EGC标志物,小鼠结肠组织水平免疫荧光双标记结果显示,GFAP阳性的EGC在肌间神经丛大量分布,并与神经元标志物神经原纤维(neurofilament,NF)不共存,表明GFAP可作为结肠EGC的标志物,详见图1。
2.2 原代EGC纯度
运用EGC标志物GFAP免疫荧光标记EGC,观察其在原代细胞中的比例,结果显示运用含血清培养基培养的原代细胞中,只有部分细胞表现出GFAP阳性,以平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)与GFAP双标记染色可见,GFAP阴性的细胞多表现为α-SMA阳性,且胞核呈卵圆形,符合成纤维细胞的特征(图2A),表明含血清培养基培养的原代细胞中存在大量的成纤维细胞污染。运用无血清培养后,可见原代细胞中绝大多数细胞均呈现GFAP阳性(图2B),以另一种常用的EGC标志物S100β与GFAP双标记并统计免疫阳性细胞在原代细胞中的百分比可得,GFAP阳性EGC占细胞总数的98.44%±1.07 %,95%CI为(95.70,101.2);S100β阳性EGC占93.61%±3.16%,95%CI为(85.48,101.7);GFAP与S100β双阳性EGC占比93.09%±2.99%,95%CI为(85.4,100.8),结果来自6个镜下视野共100个细胞,表明无血清培养成功去除了成纤维细胞污染且得到的EGC纯度较高。
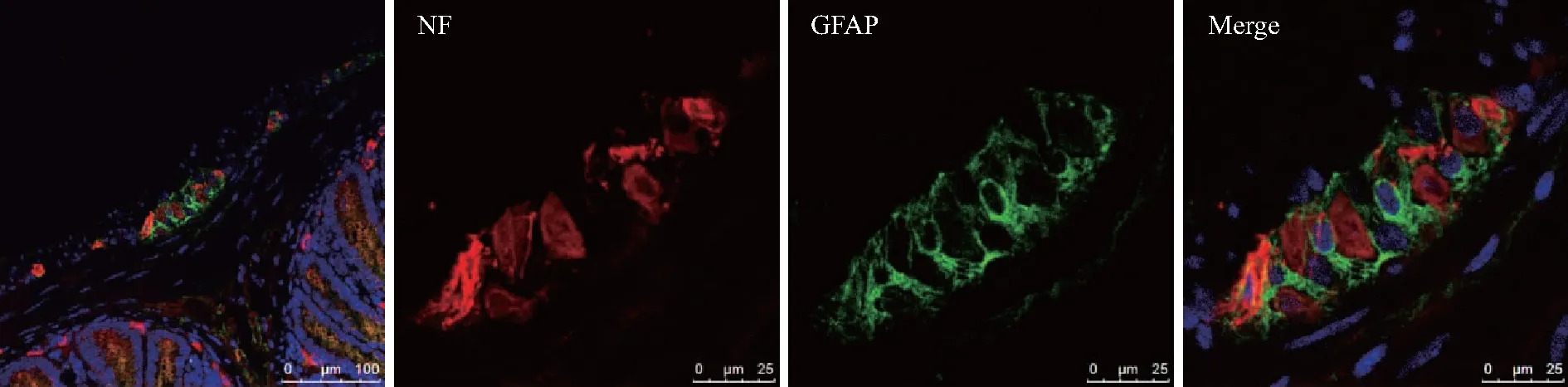
图1 EGC在结肠肌间神经丛的分布Fig.1 Distribution of EGC in colonic myenteric plexus
A: double-label immunofluorescence of GFAP and NF in myenteric plexus of colon;NF:neurofilament;GFAP:glial fibrillary acidic protein;EGC:enteric glial cell.

图2 原代EGC 细胞纯度Fig.2 Purity of primary EGC
A:double-label immunofluorescence of GFAP and α-SMA in serum-containing cultured EGC;B:double-label immunofluorescence of GFAP and S100-β in serum-free cultured EGC;EGC:enteric glial cell;GFAP:glial fibrillary acidic protein;α-SMA:α-smooth muscle actin.
2.3 原代EGC活性检测
EGC在接受ATP刺激后可表现出显著的胞内钙瞬变,而成纤维细胞则不具备这种特性。以Ca2+荧光探针fluo-4 AM孵育细胞,给予10 μmol/L ATP,利用荧光显微数码成像系统检测探针荧光强度,动态观察细胞内[Ca2+]i的变化。如图3所示,静息状态下胞内[Ca2+]i维持在较平稳的水平,ATP给药后,96.00%±4.00 %,95%CI为(84.89,107.1)的细胞发生胞内钙瞬变,结果来自3批细胞共6次实验,主要表现为胞内[Ca2+]i在短时间内快速升高(Fm/F0=1.93±0.08)随后又迅速恢复至基线水平的周期性变化,提示原代EGC反应性良好。
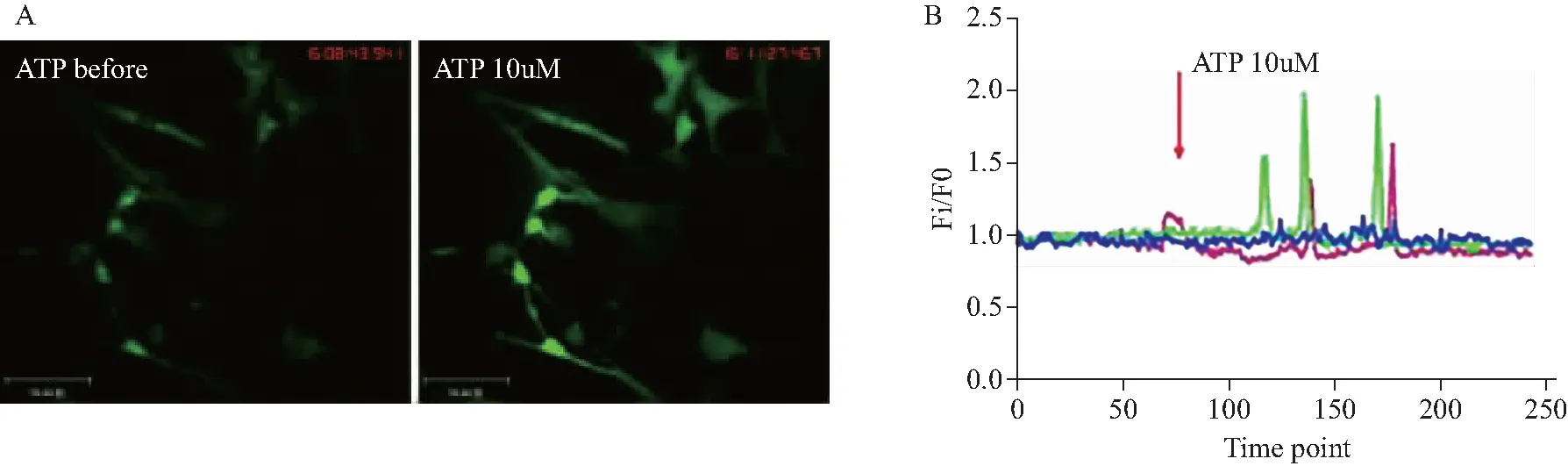
图3 ATP引起原代EGC胞内钙瞬变Fig.3 ATP induced Ca2+ transients in primary EGC
A: representative images of primary EGC loaded with Fluo-4 at rest (left) and upon activation (right) with ATP (10 μmol/L);scalebar:70 μm;B: representative traces of ATP-induced Ca2+transients for three individual cells;EGC:enteric glial cell.
3 讨论
肌间神经丛EGC原代培养过程中,成纤维细胞在操作中难以去除,在细胞培养过程中分裂增生十分迅速,因此成为制约EGC原代培养的关键因素。本实验室利用成纤维细胞对血清依赖生长的特性,在现有肌间神经丛EGC原代培养方法[9]中结合无血清法,较特异地去除了成纤维细胞污染。
本实验前期,本课题组参考了Smith等[9]建立的小鼠原代EGC分离方法,成功分离了小鼠结肠EGC,但在细胞鉴定中观察到大量GFAP阴性而α-SMA阳性的细胞,提示原代细胞中存在成纤维细胞污染。在运用无血清法培养后,可见GFAP阴性细胞显著减少,表明无血清培养法可有效去除成纤维细胞污染。Smith等[9]的文章中并未统计原代细胞纯度,本实验中,统计GFAP阳性细胞占比超过98%,95%CI为(95.70,101.2),表明纯度较高,符合实验要求。
多项研究表明ATP可以激发EGC胞内Ca2+浓度的显著变化,如Gulbransen等[14]运用了组织原位Ca2+显像技术,观察到ATP可引起豚鼠结肠肌间神经丛中95.5% 的EGC发生钙瞬变,而Boesmans等[15]的研究显示,ATP可激发人十二指肠黏膜下神经丛原代EGC胞内钙瞬变,反应细胞比例约为53%。本实验中可以检测到约96%,95%CI为(84.89,107.1)的无血清培养原代EGC在ATP作用下发生胞内钙瞬变,这与Gulbransen等[14]的组织原位检测结果相近,提示原代EGC反应性良好。而Boesmans等[15]的研究中反应细胞比例较低,原因可能在于人与啮齿类动物的种属差异,也可能在于原代细胞反应性差异。
针对原代EGC去除成纤维细胞的方法已有多方面尝试,如抗有丝分裂法、差速贴壁法、流式细胞法、磁珠分选法等。其中抗有丝分裂法的原理是成纤维细胞分裂增生速率高于EGC,加入抗有丝分裂剂可显著抑制成纤维细胞增生,但此法也存在弊端。由于EGC有一定的增生速率,会受到抗有丝分裂剂的影响,培养中若不能找到适宜的用药剂量,将会严重影响EGC的增生。而成纤维细胞对血清的依赖远高于EGC,无血清法对EGC生长的影响则相对较小。差速贴壁法利用成纤维细胞贴壁更快的特性,在反复贴壁操作中去除成纤维细胞,但由于EGC亦属易贴壁细胞,操作中若不能把握合适的时间点,极易丢失目的细胞,相比之下无血清法能更大限度的减少EGC的丢失。流式细胞法和磁珠分选法利用免疫筛选原理分选细胞,精确度更高,但成本亦相对较高,且目前国内的流式细胞仪难以提供严格的无菌条件,细胞污染的概率亦较高,相比之下无血清法操作简便、成本低廉且不会造成细胞污染。本实验为原代EGC分离纯化提供了新的参考,为EGC功能的探究提供了良好的技术基础。

