myocardin通过激活miR-93-5p促进人主动脉血管平滑肌细胞分化
史丹阳,刘美玲,刘 翔,张 建,张同存,王 楠
(工业发酵微生物教育部重点实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院,天津 300457)
动脉粥样硬化等许多心血管系统疾病作为危害人类健康的危重疾病一直受到广泛关注.成熟血管壁的血管平滑肌细胞(vascular smooth muscle cells,VSMCs)在血管损伤后由收缩表型向去分化表型的转化在动脉粥样硬化和血管再狭窄等血管疾病发生过程中有重要作用[1].研究表明血清反应因子(serum response factor,SRF)与其顺式作用元件 CarG[CC(A/T)6GG]-box的相互作用是启动血管平滑肌细胞标志性基因表达的核心机制[2].myocardin是 2001年发现的核蛋白(stress associated protein,SAP)结构域家族的一个成员,可在多种非肌细胞中与 SRF结合形成三聚体,并进一步显著激活CArG box依赖的平滑肌和心肌特异表达基因的启动子,包括α 平滑肌肌动蛋白(α smooth muscle-actin,α-SMA)、平滑肌肌球蛋白重链(SM-myosin heavy chain,SM-MHC)、肌动蛋白α 2(actin alpha 2,ACTA2)基因等[3].从而在分子水平上影响着血管平滑肌细胞的表型转化.
微小 RNA(microRNAs,miRNA)是新近发现的非编码RNA,具有调节基因表达的功能,在细胞的生长、分化和迁徙等过程中具有重要作用,是调控诸多病理生理现象的关键小分子[4].Gareri等[5]研究表明,miRNA在血管平滑肌表型转化中起到重要作用,miR-125a-5p通过靶向ETS-1(erythroblast transformation specific-1,ETS-1)调控血管平滑肌的表型转化.但在 VSMCs表型转化过程中myocardin与哪些miRNA相关目前尚未完全阐明.通过对 miRNA的启动子分析发现 miR-93-5p的启动子上有myocardin/SRF的结合位点 CArG box,因此推测myocardin可能是调控 miR-93-5p的关键转录因子.本研究旨在通过功能获得或缺失实验证实在人主动脉血管平滑肌细胞分化过程中 myocardin对miR-93-5p的转录激活作用.
1 材料与方法
1.1 细胞、菌种与质粒
人主动脉血管平滑肌细胞(human aortic vascular smooth muscle cells,HA-VSMCs)由本实验室保藏,ATCC®编号为 CRL-1999.大肠杆菌(E.coli)DH5α、pGL3-Basic、pcDNA3.1-myocardin表达质粒、pRIGFP/Neo-Myocd(RNAi-myocardin)干扰质粒、pRIGFP/Neo-Control(RNAi-control)质粒均为本实验室保存.
1.2 主要试剂
myocardin一抗(rabbit),天津赛尔生物技术有限公司;ACTA2一抗(rabbit)、SM22一抗(rabbit),Abcam公司;小鼠抗人甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗,Santa Cruz公司;山羊抗兔荧光二抗、山羊抗鼠荧光二抗,Li-cor公司;M-MLV 逆转录酶、Trizol 试剂,北京索莱宝科技有限公司;Taq DNA聚合酶,北京全式金生物技术有限公司;NheⅠ限制性内切酶、XhoⅠ限制性内切酶、T4 DNA 连接酶,Promega公司;SYBR Green q PCR Mastermix,DBI Bioscience公司;dNTPs、D2000 DNA ladder、DM 2000plus DNA marker、通用型柱式基因组提取试剂盒(Universal Genomic DNA Kit),北京康为世纪生物科技有限公司;荧光素酶检测试剂盒,Promega公司;X-tremeGENE HP DNA Transfection Reagent 转染试剂,Roche公司.
1.3 细胞培养与转染
HA-VSMCs用含有10%胎牛血清(无噬菌体,低内毒素)和 1% 100×青链霉素双抗溶液的 DMEMHG培养基于 37℃、5% CO2培养箱培养.用 0.25%胰蛋白酶消化传代,当细胞生长至 70%时,用脂质体介导法分别转染空载对照质粒(pcDNA3.1)、myocardin过表达质粒(pcDNA3.1-myocardin)、pRIGFP/Neo-Control(RNAi-control)质粒和 pRI-GFP/Neo-Myocd(RNAi-myocardin)干扰质粒.所用质粒浓度为 4µg/mL,操作按 X-treme GENE HP DNA Transfection Reagent 转染试剂说明书进行.在转染后 48h收集不同条件处理的 HA-VSMCs,分别收集细胞总蛋白或总RNA,进行后续实验.
1.4 免疫印迹(Western blot)分析
收集各组细胞,SDS蛋白裂解液冰上裂解细胞,提取细胞总蛋白,考马斯亮蓝法测定蛋白含量.100℃变性 10min后,进行 12% SDS-PAGE电泳,通过电转移将蛋白胶转移至NC膜上.用5% 脱脂奶粉室温封闭 1h后,分别用 ACTA2抗体(1∶500)、SM22α 抗体(1∶1000)、myocardin 抗体(1∶1000)在孵育袋中孵育,4℃过夜,磷酸盐缓冲液(phosphate buffer saline,PBS)洗膜 3次,每次10min.随后加入相对应的二抗(山羊抗兔荧光二抗、山羊抗鼠荧光二抗)室温避光孵育 2h,PBS洗膜 3次,每次 10min.Oddysey远红外成像系统扫膜,用Image J软件对 Western blot结果进行定量分析.
1.5 总 RNA提取及实时荧光定量 PCR(Real-time PCR)
先用 Trizol法提取总 RNA,参照 M-MLV逆转录方法进行逆转录.每组取 2µg总 RNA分别用miR-93-5p的反转录引物作为特异性逆转录引物进行逆转录反应,得到相应的逆转录产物cDNA.miR-93-5p 的反转录引物:5′-GTCGTATCCAGTGCAGGGT CCGAGGTATTCGACTGGATACGACCTACCTG-3′.取 2µL产物进行 Real-time PCR扩增,扩增体系为20µL:master mix 10µL,无菌蒸馏水 7.6µL,上、下游引物各 0.5µL,cDNA 模板 1µL,50× ROX 0.4µL.PCR 条件:95℃预变性 2min;95℃变性10s,60℃退火 30s,72℃延伸 30s;40 个循环;95℃10s终止反应.检测miR-93-5p的表达水平(U6为内参),U6 上游引物为 5′-CTCGCTTCGGCAGCACA-3′,下 游 引 物 为 5′-AACGCTTCACGAATTTGCGT-3′;miR-93-5p上游引物为5′-GAGTGTCAAAGTGCTGT TCGTG-3′,下游引物为 5′-GCAGGGTCCGAGGTAT TC-3′.
1.6 人基因组的提取
按通用型柱式基因组提取试剂盒(Universal Genomic DNA Kit)提取基因组,先将人主动脉血管平滑肌细胞用胰酶消化处理为细胞悬液离心后弃上清液,加 200µL GTL,震荡样品至悬浮;加入 20µL Proteinase K、200µL Buffer GL,震荡混匀,56℃水浴10min,离心后加入 200µL无水乙醇并混匀.按照基因组试剂盒说明书将上述步骤中所得溶液加入收集管的吸附柱中,离心弃废液,向吸附柱中依次加入500µL Buffer GW1、500µL Buffer GW2,离心后弃废液并将吸附柱彻底晾干.最后向吸附柱的中间部位悬空加入50~200µL Buffer GE或灭菌水,室温放置2~5min,离心1min,收集DNA溶液,-20℃保存.
1.7 miR-93-5p的启动子质粒构建和荧光素酶报告实验
在NCBI上查找miR-93-5p的启动子序列,根据文献查出与myocardin结合的CArG(CCTTAAAGG)结合位点.根据其序列以及pGL3载体确定酶切位点为 NheⅠ和 XhoⅠ,运用 Primer 5.0设计引物,上游引物为 5′-GTAGCTAGCCAGGTGAATTTCATGTTT AGACTGGAGT-3′(NheⅠ),下游引物为 5′-ATTCTC GAGCCAAGACGGGAGGACAGAAAGGAA-3′(XhoⅠ),片段为 1028bp.PCR 反应条件:94℃热启动5min;94℃变性 30s,56℃退火 30s,72℃延伸1min,30个循环;72℃总延伸 10min,4℃保存.以人基因组为模板,按上述 PCR条件扩增后,纯化PCR产物.用相应的限制性内切酶进行酶切,将酶切产物与用同样限制性内切酶酶切的pGL3-Basic质粒用 T4 DNA 连接酶于 16℃孵育器连接 24h.转化DH5α,在氨苄霉素抗性平板上挑选单克隆后,在氨苄霉素抗性液体 LB培养基中,37℃扩大培养 14h后,提取质粒进行双酶切验证并测序.
随后在 24孔板中进行质粒转染实验.过表达myocardin实验组为启动子(pGL3-Basic-p-miR-93-5p)0.5µg、pcDNA3.1-myocardin 表达质粒 0.5µg,对照组为启动子(pGL3-Basic-p-miR-93-5p)0.5µg、pcDNA3.1对照质粒 0.5µg;干扰 myocardin实验组为 启 动 子 (pGL3-Basic-p-miR-93-5p)0.5µg、pRIGFP/Neo-Myocd(RNAi-myocardin)干扰质粒 0.5µg,对照组为启动子(pGL3-Basic-p-miR-93-5p)0.5µg、pRI-GFP/Neo-Control(RNAi-control)对照质粒0.5µg;2µL脂质体.实验步骤参考荧光素酶检测试剂盒说明书进行,转染 24h后加入 Luc裂解物冰上裂解细胞 30min,吸取 50µL裂解物,加入至预冷的白色 96孔板中;在酶标仪上设置程序.随后采用考马斯亮蓝染色法进行蛋白质含量的测定.
1.8 统计学分析
所有数据均用“平均值±标准差”表示,采用SASV8软件进行统计学处理分析,组间比较用单因素方差分析检验.
2 结果与分析
2.1 myocardin过表达促进HA-VSMCs分化
为证实 myocardin在平滑肌细胞分化过程中的重要作用,将对照质粒(pcDNA3.1)和 myocardin表达质粒(pcDNA3.1-myocardin)分别转染入 HAVSMCs中 48h,利用 Western blot方法检测myocardin的表达情况.已有研究证实 ACTA2和SM22α 是收缩型 VSMCs的最具特点的标志基因,通常以二者的表达活性作为判定 VSMCs分化表型的依据,因此检测了分化标志性基因 ACTA2和SM22α 的蛋白水平,结果如图1所示.
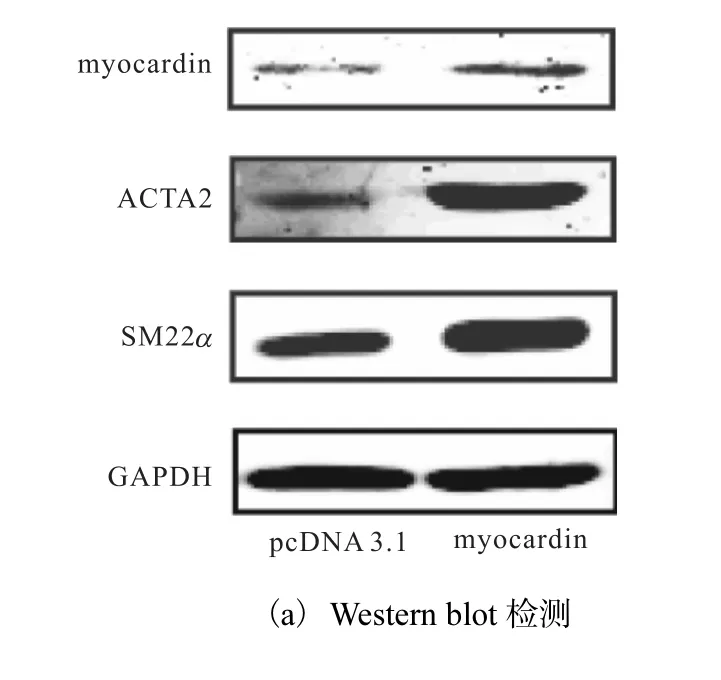
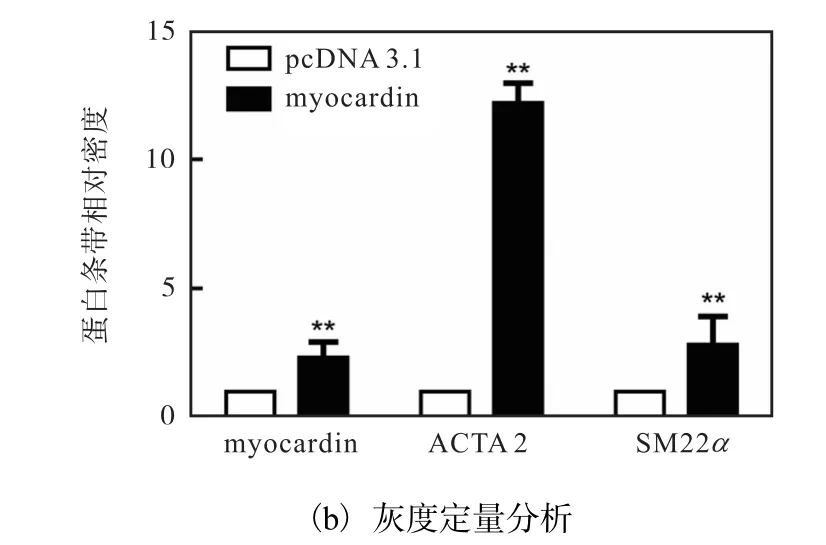
图1 myocardin促进HA-VSMCs特异性基因的表达Fig. 1 Expression of HA-VSMC specific genes upregulated by myocardin
与对照组相比,转染 pcDNA3.1-myocardin质粒组 myocardin蛋白水平显著上调,同时分化标志基因ACTA2和 SM22α 的蛋白水平也显著升高.这说明myocardin能显著上调人主动脉平滑肌标志基因的表达,促进血管平滑肌细胞分化.
2.2 干扰myocardin抑制HA-VSMCs分化
为进一步证实 myocardin对平滑肌细胞分化的影响,将对照质粒(RNAi-control)和 myocardin干扰质粒(RNAi-myocardin)分别转染入 HA-VSMCs中48h,利用 Western blot方法检测 myocardin和分化标志性基因 ACTA2和 SM22α 的蛋白水平,结果如图2所示.

图2 myocardin抑制HA-VSMCs特异性基因的表达Fig. 2 Expression of HA-VSMC specific genes downregulated by myocardin
与对照组相比,转染 RNAi-myocardin质粒组myocardin蛋白水平显著下调,同时分化标志基因ACTA2和 SM22α 的蛋白水平也分别下调 40%和35%左右.这说明干扰 myocardin能显著下调人主动脉平滑肌标志基因的表达,抑制血管平滑肌细胞分化.
2.3 myocardin与miR-93-5p的表达水平成正相关
对 miRNA的启动子分析中发现,miR-93-5p启动子上含有 myocardin的结合位点 CArG box,因此myocardin可能是上调 miR-93-5p的关键转录因子.为证实这一结论,在 HA-VSMCs中过表达myocardin.提取 RNA,逆转后 Real-time PCR 检测miR-93-5p的表达量,以U6为内参基因,结果如图3所示,过表达myocardin后,miR-93-5p的表达显著上调.这说明在平滑肌分化过程中 myocardin上调了miR-93-5p的水平.
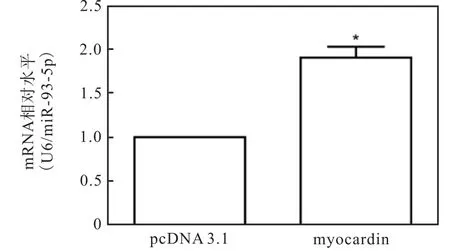
图3 过表达myocardin上调miR-93-5p水平Fig. 3 Myocardin upregulating the expression of miR-93-5p
2.4 干扰myocardin影响miR-93-5p的表达
进一步在HA-VSMCs中转染myocardin的干扰质粒 pRI-GFP/Neo-Myocd(RNAi-myocardin)降低内源性myocardin的表达水平后,检测miR-93-5p的表达水平.提取 RNA,逆转录后进行 RT-PCR检测miR-93-5p的表达量,以 U6为内参基因,miR-93-5p的水平也显著下降(图 4).这些结果进一步说明miR-93-5p与 myocardin的表达成正相关,并且有可能介导myocardin对VSMCs特异性分化过程的调控.
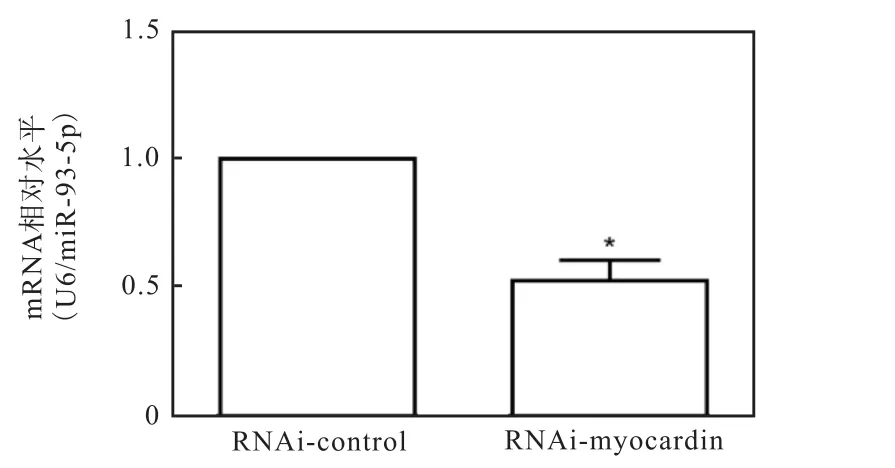
图4 干扰myocardin表达下调miR-93-5p水平Fig. 4 Myocardin downregulating the expression of miR-93-5p
2.5 miR-93-5p的启动子质粒构建
为证实myocardin能否激活miR-93-5p的转录,构建 miR-93-5p启动子荧光素酶报告基因质粒.在NCBI上查找 miR-93-5p的启动子序列,设计引物,从人主动脉平滑肌细胞中获得人的基因组序列作为模板,通过PCR法获得所需要的启动子序列1028bp(从-1037bp到0bp),结果如图5(a)所示.将pGL3-Basic载体和纯化后的PCR片段分别用NheⅠ和XhoⅠ两种限制性内切酶双酶切,获得目的片段和空载的线性片段.随后将两条线性片段进行连接转化.当平皿上长出菌落后,挑取菌落,小提质粒后进行双酶切鉴定,结果如图 5(b)所示.pGL3-p-miR-93-5p-luc质粒经双酶切后产生两个片段,大小分别为4818bp和1028bp,4818bp片段与载体大小一致,1028bp片段与 PCR产物大小一致.这初步证明质粒构建正确,进一步通过测序鉴定,质粒构建成功.

图5 构建miR-93-5p启动子荧光素酶报告质粒Fig. 5 Luciferase reporting the construction of plasmid containing promoter miR-93-5p
2.6 myocardin增强miR-93-5p的启动子活性
利用成功构建的 miR-93-5p启动子荧光素酶报告基因质粒,进行荧光素酶报告分析.在HA-VSMCs中共同转染 myocardin质粒和 miR-93-5p启动子质粒,以 myocardin的空载质粒 pcDNA3.1和 miR-93-5p启动子质粒的共转为对照,进行荧光素酶活性检测分析,结果如图 6所示.myocardin能够显著增强miR-93-5p启动子活性(图 6(a)),而敲低 myocardin的表达后,miR-93-5p的活性也显著降低(图6(b)).这表明 myocardin能增强 miR-93-5p的启动子活性,促进其转录.
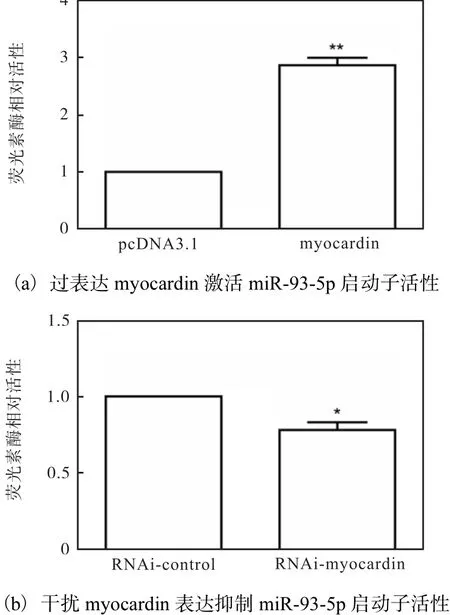
图6 myocardin增强miR-93-5p的启动子活性Fig. 6 Myocardin enhancing the promoter activity of miR-93-5p
3 讨 论
miRNA是近年来发现的能够在转录后水平调节基因表达的一组非蛋白编码小分子,广泛存在于从病毒、线虫、植物到动物体内.成熟后能够通过核酸序列互补识别特定的目标,使之降解或抑制其翻译,从而抑制蛋白质的合成,达到调控基因表达的目的.研究表明:其参与了细胞分裂增殖、分化与发育以及代谢等许多重要的生物学过程,因此有可能成为疾病诊断、预后判断的指标及治疗靶点.此外,在不同效应细胞亚群的分化中起重要作用.已有报道在 VSMCs中 miRNA在细胞多种功能中都起到了十分重要的作用[6].目前已经有多篇文献报道了 miR-125a-5p、miR-145[7]、miR-23b[8]、miR-18a-5p[9]等都能够直接或者间接影响 VSMCs的表型转化.Li等[10]证实myocardin可以通过上调miR-206促进平滑肌向分化表型转化.但对于平滑肌分化过程中受到 myocardin调控的miRNA的了解仍然有限.
本研究发现 myocardin可以通过上调平滑肌分化标志基因 SM22α 和 ACTA2的表达,促进人主动脉平滑肌细胞向分化表型转化,在此过程中 miR-93-5p的水平上调.而 myocardin的功能缺失实验证实在人主动脉平滑肌细胞中敲低 myocardin的表达可以显著降低miR-93-5p的水平.这些结果证实在平滑肌分化过程中myocardin与miR-93-5p的相关性.目前对于miR-93-5p的功能知之甚少,已有报道大多集中于肿瘤细胞中.miR-93-5p在肿瘤细胞中的作用也不尽相同,已经证实 miR-93-5p促进胃癌转移[11]、子宫内膜癌上皮间质转化过程[12],但却抑制乳腺癌细胞的上皮间质转化过程[13].目前尚未发现有关 miR-93-5p在血管平滑肌细胞中功能的相关报道,而本研究则证实了 miR-93-5p可能参与 myocardin调控的血管平滑肌细胞分化过程,myocardin可以激活miR-93-5p的启动子活性,进而促进miR-93-5p的转录.
综上所述,myocardin很可能通过上调 miR-93-5p参与对 VSMCs分化的调节.本研究所得结果为发现 myocardin功能的新机制提供初步实验证据,并且发现 miR-93-5p可能参与血管平滑肌分化表型的调控作用.这对于心血管疾病病理机制的研究及新临床治疗靶标的研发提供参考.

