海洋放线菌Streptomyces koyangensis SCSIO 5802中多烯大环内酯类抗生素candicidin生物合成基因簇的分析鉴定
涂佳佳,鞠建华,付少彬,李青连
(1.遵义医科大学 药学院药物化学教研室, 贵州 遵义 563099;2.中国科学院南海海洋所 中国科学院热带海洋资源与生态重点实验室,广东 广州 510301)
微生物产生的次级代谢产物结构复杂且种类繁多,因其具有显著的抗感染、抗肿瘤、抗氧化和抗蛋白酶等活性,是当前创新药物开发和新功能酶挖掘的重要资源[1-5]。聚酮类次级代谢产物中多烯大环内酯类抗生素(polyene marcrolides),是临床上用于治疗由真菌引起的全身性或者浅表性局部感染的重要药物,其作用机理是通过与真核细胞膜中的甾醇相互作用而形成跨膜通道,使膜分解或增加膜通透性引起小分子和离子的泄漏并随之导致细胞死亡。Candicidin(又名FR-008)是从灰色链霉菌(Streptomycesgriseus)中获得的七烯大环内酯类抗生素,研究表明它对包括白色念珠菌、灰葡萄孢,白色念珠菌,新型隐球菌,小孢霉菌,Sporotrichumschenckii和红色毛癣菌等在内的病原真菌具有显著的抑制活性[6],是抗感染药物开发的重要先导化合物。
多烯大环内酯类化合物通常是由I型聚酮合成酶(polyketide synthase,PKS)及其相关的修饰酶负责合成[7-8],典型的I型PKS,每个模块至少含有由缩合酶(ketosynthase,KS)、酰基转移酶(acyl transferase,AT)和酰基载体蛋白(acyl carrier protein,ACP)3个结构域。除了以上3个基本结构域外,许多延伸模块中往往还包含有酮基还原酶(ketoreductase,KR),脱水酶(dehydrase,DH)和烯酰基还原酶(enoysynthase,ER)等结构域。这些结构域的存在决定了延伸酰基链上β-酮基的还原加工程度,其中,KR催化β-酮基还原为羟基;DH能够以还原生成的羟基为基点,催化在延伸骨架中生成α-β位间的不饱和双键,这正是多烯结构上共轭双键生成的最主要途径;而ER则能够进一步还原α-β位间的不饱和双键而生成饱和脂肪链,相关结构域在多烯大环结构中比较少见。
笔者所在的课题组一直致力于海洋放线菌活性次级代谢产物的发现及其生物合成机制的研究,已获得多种具有良好生物活性的化合物,例如Song等[9]和Huang等[10]从海洋放线菌StreptomyceskoyangensisSCSIO 5802中分离得到9个多环聚酮类化合物abyssomicins,发现该类化合物具有抑制耐甲氧西林金黄色葡萄球菌生长以及HIV-1病毒调节活性。利用高效液相色谱-质谱联用(LC-MS)对S.koyangensisSCSIO 5802菌株的发酵液进行深入分析,发现该菌株的代谢物非常丰富,除了生产abyssomicins外,还生产一系列分子量较大的(>500)的待分离鉴定次级代谢产物。但是由于主产物abyssomicins类化合物生产旺盛、产量很高,影响了其他结构新颖但产量较低的代谢产物的分离和结构鉴定。因此,本文在前期实验[11]的基础上,利用定向遗传改造的方法,构建了不生产abyssomicin类化合物的聚酮合成酶基因abmB1的同框缺失突变株,阻断了主要次级代谢产物abyssomicins的生产,改变菌株的代谢流以增加微量次级代谢产物的生物合成前体供应,从该突变株发酵液中鉴定了真菌多烯大环内酯类化合物candicidin,并对其生物合成基因簇进行了鉴定,推导了其生物合成聚酮骨架的组装过程,最后通过对该化合物的生物合成PKS基因的缺失,对该生物合成基因簇进行了确认。本研究结果将为利用组合生物合成的方法获得candicidin新结构衍生物以及基于基因组信息的新型天然产物挖掘奠定了基础。
1 材料与方法
1.1 材料
1.1.1 菌种、质粒及引物 本研究所用的菌株、质粒及引物见表1。
表1本研究所用的菌株,质粒及引物

菌株及引物相关特性来源大肠杆菌E.coliE. coli DH5a普通克隆载体宿主菌TransGeneE.coliET12567/pUZ8002接合转移供体菌,KanR,CmlRMacNeilet al., 1992E.coliBW25113/pIJ790PCR-targeting宿主菌, CmlRDatsenkoWanner 2000链霉菌StreptomycesStreptomyces koyangensisSCSIO 5802野生型生产菌株本研究ΔabmB1abmB1基因被同框缺失突变后构建的突变株本研究ΔcanDcanD基因抗性替换后构建的突变株本研究质粒9-7C含abmB1基因的粘粒本研究9-7C-19-7C中abmB1基因被Apr-oriT替换后获得的粘粒本研究9-7C-29-7C-1中Apr-oriT被SpeI酶切后获得的粘粒本研究9-7C-39-7C-2中neo基因被替换后获得的粘粒本研究7-8F7-8F是canD基因的粘粒本研究引物abmB1-IFdel-F:5'-tacaagaccgctgcccctaccgctccgaccggggacagcactagtattccggggatccgtcgacc-3'本研究abmB1-IFdel-R:5'- cgccgtgtcgctgccgccctcgggtcgctggggcagcggactagttgtaggctggagctgcttc-3'abmB1-TF:5'- agccagtacggcgcattcc-3'本研究abmB1-TR:5'-tcagcgagtcgaagcccagtt-3'canD-Del-F: 5'-gcgcgcgtcgaggtgggcgagcagccgggcggcctgggcattccgggatccgtcgacc-3'本研究canD-Del-R:5'-gaggtgcccccgctcctgcgcggcctggtccgcacccgctgtaggctggagctgcttc-3'canD-Test-F:5'-cgcgatcgtcagcatgagct-3'本研究canD-Test-R:5'-ttgatcgccgcgataccgac-3'Primer A-F:5'- agggcgggttgcgtgta -3'本研究Primer A-R:5'- cgtctccttcggcctct -3'Primer B-F:5'- cttgaccgaccgaggagc -3'Primer B-R:5'- ggcaacaccagcatc -3'Primer C-F:5'- ggccaacaagctggtgct -3'Primer C-R:5'-cgggaggaagaggatgacga-3'
1.1.2 培养基 ①LB培养基:胰蛋白胨1%,酵母提取物0.5%,NaCl 1%,琼脂粉2%(固体培养),用于大肠杆菌的培养。②A1培养基:可溶性淀粉10 g/L,酵母提取物4 g/L,细菌学蛋白胨2 g/L,海盐10 g/L,pH值7.2~7.4,琼脂粉2%(固体培养),用于链霉菌的产孢培养。③MS培养基:黄豆粉(即大豆粉)20 g/L,甘露醇20 g/L,pH值7.2~7.4,琼脂粉2%,用于大肠杆菌与链霉菌菌间的结合转移实验。④RA培养基:麦芽提取物1%,玉米粉0.5%,可溶性淀粉2%,麦芽糖1%,葡萄糖1%,微量元素100 μL/L,海盐3%,pH值7.2~7.4,CaCO30.2%(调完pH值后加),用于链霉菌的液体发酵培养。
1.1.3 主要试剂与仪器 限制性核酸内切酶、高保真DNA聚合酶PrimeStar、DNA连接酶和DNA标准品等购自TaKaRa公司;DNA回收试剂盒和质粒提取试剂盒购自Omega公司。其他常规试剂均为国产分析纯级产品。氨苄青霉素(Ampicillin,Amp)的工作终浓度为100 μg/mL,卡那霉素(Kanamycin,Kan)的工作终浓度为50 μg/mL。PCR引物由上海生工生物工程有限公司合成,DNA测序由广州擎科公司完成。PCR仪(nexus GSX1)、台式大容量多功能冷冻离心机(MASTERCYCLER)、小型台式高速离心机(centrifuge 5424)、Concentrator plus旋转浓缩仪购自Eppendorf公司;旋转蒸发仪购自Heidolph公司(BOROTA 4000);凝胶成像系统购自Bio-Rad公司;高效液相色谱仪(High Performance Liquid Chromatography,HPLC)购自Agilent公司(高压液相色谱仪 Infinity 1260)。
1.2 方法
1.2.1S.koyangensisSCSIO 5802菌株基因组的生物信息学分析和基因注释S.koyangensisSCSIO 5802菌株的基因组DNA提取、全基因组测序已经报道[11]。本文在已获得的S.koyangensisSCSIO 5802菌株全基因组序列基础上,利用在线软件antiSMASH 3.0(http://antismash.secondarymetabolites.org/)对基因组中可能的次级代谢产物生物合成基因簇进行预测;利用FramePlot 4.0 beta (http://nocardia.nih.go.jp/fp4/)对开放阅读进行分析;并利用在线软件BLASTP(http://blast.ncbi.nlm.nih.gov)对开放阅读框的功能进行注释。
1.2.2 不生产abyssomicin类化合物的聚酮合成酶基因abmB1的同框缺失突变株5802A的构建 在前期研究中,我们已经利用λ-RED介导的PCR-targeting技术建立了S.koyangensisSCSIO 5802菌株的遗传操作系统[12]。在本研究中,利用前期研究已经筛选到的含有abyssomicin类化合物生物合成聚酮合成酶基因abmB1的粘粒9-7C[11],对abmB1基因进行同框缺失突变。
根据建立的遗传操作系统,首先将粘粒9-7C导入到E.coliBW25113/PIJ790中,获得重组菌株E.coliBW25113/PIJ790/9-7C,接种于LB培养基中于28oC培养,同时添加 L-阿拉伯糖诱导λ-red重组系统表达,并制备成感受态细胞。此外,同时利用表1中的引物abmB1-IFdel-F/R扩增阿普拉霉素的抗性替换DNA片段acc(3)IV-oriT。通过电转将纯化的acc(3)IV-oriTDNA片段导入E.coliBW25113/PIJ790/9-7C感受态细胞中,使其发生重组,替换粘粒9-7C中相应位置的abmB1基因,获得重组质粒9-7C1。利用SpeI对重组质粒9-7C1进行酶切,酶切产物经酚:氯仿进行抽提和乙醇沉淀后,利用T4 DNA连接酶进行连接;连接产物转化E.coliDH5a,利用鉴定引物abmB1-TF/TR筛选丢失了阿普拉抗性基因片段acc(3)IV-oriT的重组粘粒9-7C2。重组粘粒9-7C2转入E.coliET12567/pUZ8002中,并通过结合转移导入到野生物型菌株S.koyangensisSCSIO 5802中,使其发生同源重组。首先利用含50 μg/mL阿普拉霉素的A1培养基筛选发生同源单交换的突变株,命名为5802AS。将该单交换突变在不含抗性的A1平板上进行传代培养5 d后,收集孢子并进行适当稀释后涂布于不含抗性的A1平板上继续培养5 d,挑选在无抗A1平板上生长且在含50 μg/mL阿普拉霉素的A1平板上不生长的单克隆菌株,经PCR验证正确后,获得双交换同源重组突变株5802A。
1.2.3 Candicidin生物合成基因簇聚酮合酶型基因canD的抗性替换突变S.koyangensisSCSIO 5802基因组cosmid文库在前期研究中已经构建完成[11]。本研究中为了筛选到覆盖candicidin生物合成基因簇的粘粒,用于candicidin生物合成基因的敲除,设计了3对筛库引物Primer A、 Primer B 和Primer C(见表1)对已构建的S.koyangensisSCSIO 5802基因组cosmid文库进行筛选,获得包含有canD基因的粘粒7-8F,用于canD基因的突变。
将筛选到的含canD基因的粘粒7-8F转入E.coliBW25113/PIJ790中,获得重组菌株E.coliBW25113/PIJ790/7-8F,接种于LB培养基中于28 ℃培养,同时添加 L-阿拉伯糖诱导λ-red重组系统表达,并制备成感受态细胞。此外,同时利用表1中的引物canD-Del-F/R扩增阿普拉霉素的抗性替换DNA片段acc(3)IV-oriT。通过电转将纯化的acc(3)IV-oriTDNA片段导入E.coliBW25113/PIJ790/7-8F感受态细胞中,使其发生重组,替换粘粒9-7C中相应位置的canD基因,获得重组质粒7-8F-DKO。将突变粘粒7-8F-DKO转化到E.coliET12567/pUZ8002中,并通过结合转移导入到不生产abyssomicin类化合物的同框基因缺失突变株5802AKO中,使其发生同源重组。通过阿普拉霉素(50 μg/mL)和卡那霉素(50 μg/mL)抗性筛选接合子,引物canD-Test-F/R进行验证,获得既不生产abyssomicin类化合物也不生产candicidin类化合物的基因突变株5802AC。
1.2.4S.koyangensisSCSIO 5802 野生菌及其突变株的发酵和HPLC分析 从A1平板上将S.koyangensisSCSIO 5802AC和S.koyangensisSCSIO 5802A菌株的孢子分别接入含有50 mL RA培养基的锥形瓶中, 28 ℃,200 rpm培养条件下摇床培养7 d后100 mL丁酮萃取发酵液,浓缩后1 mL甲醇溶解,HPLC分析(A相:100%超纯水和0.1%TFA;B相:100%乙腈和0.1%TFA。HPLC分析检测波长为365 nm;分析程序:为0~20 min,0%~65% B相;20~22 min,65%~100% B相;22~27 min,100%B相;27.1~30 min,0%B相)。
2 结果
2.1S.koyangensisSCSIO 5802代谢产物中candicidin化合物的鉴定 通过构建S.koyangensisSCSIO 5802菌株中负责主代谢产物abyssomicin类化合物生物合成的聚酮合成酶基因abmB1的同框缺失突变株(见图1),阻断主产物abyssomisin类化合物的生产将构建成功的同框缺失突变株,命名为S.koyangensisSCSIO 5802A。与野生型菌株SCSIO 5802相比较,同框缺失突变株SCSIO 5802A不生产abyssomisin类化合物化合物,同时在 16 min-20 min之间产生了3个明显的新峰 (见图2A, 图谱ii)。紫外/可见光图谱分析发现,该类化合物具有相同的光谱,均含有3个明显的最大吸收峰,分别在360 nm,380 nm和401 nm(见图2B)处,与文献报道的七烯大环内酯类化合物的特征性紫外-可见吸收谱一致。多烯大环内酯化合物具有特征性的三峰紫外吸收光谱,峰值最大值的波长由共轭双键的数量决定,其UV吸收光谱可用于鉴定多烯大环内酯类化合物中共轭双键的数目[13],因此,同框缺失突变株SCSIO 5802A所产生的3个新化合物应该属于七烯大环内酯类化合物。高效液相-质谱联用(LC-MS)分析发现这3个峰的分子量分别为1110.35,1108.34和1092.33(见图3),与已经报道的七烯大环内酯类化合物candicidin A3 (1110.59),candicidin D (1108.57)和candicidin A1(1092.58) 的分子量一致[14-15]。因此本文所鉴定的3个化合物确实是candicidin类化合物,分别为①candicidin A3;②candicidin D;③candicidin A1。
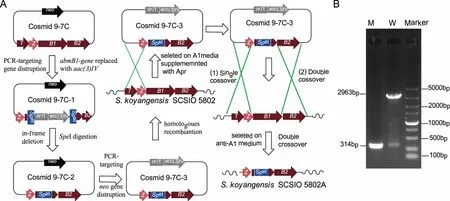
A:abmB1基因替换突变株的构建示意图;B:突变株abmB1的PCR验证图,野生型2963 bp,突变株314 bp ,Marker:DL5000,W:以S.koyangensis SCSIO 5802野生型菌株基因组DNA为模板,M:以突变5802A基因组DNA为模板。图1 abmB1-in基因替换突变株的构建及验证
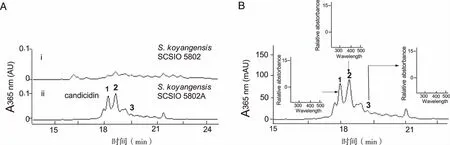
A:基因阻断突变株的发酵产物HPLC检测;B: candicidin的HPLC分析及各个峰的UV。图2 基因阻断突变株的发酵产物分析及 candicidin化合物鉴定

图3 三个Candicidin类化合物的质谱图及对应化学结构
2.2S.koyangensisSCSIO 5802中 candicidin 生物合成基因簇的鉴定 通过在线数据库anti-SMAH进行分析,发现S.koyangensisSCSIO 5802基因组中的20个连续的开放阅读框(open reading frame,ORF)在蛋白水平上与已报道的Streptomycessp.FR-008中的candicidin化合物生物合成基因具有94%-99%的相似性,表明该20个基因组成的基因簇可能为candicidin的生物合成基因簇,根据已经报道的文献[16],本文将该20个开放阅读框进行了逐一命名和功能注释(见表2)。该基因簇中含有7个PKS相关基因(canA、canC、canB、canF、canE、canD和canTE);4个调控基因(canR2、canR2、canR3和canR4);2个转运蛋白(canT1、canT2);2个负责起始单元对氨基本乙酮合成相关酶(canPAB1和canPAB2); 2个后修饰基因(P450氧化酶基因canP,氧化铁蛋白基因canFE);以及3个与糖基单元合成和转移相关的基因(糖基转移酶canM1、氨基转移酶canM2和脱水酶canM3)。20个开放阅读框的组织排列方式见图4A,基因功能注释见表2。
表2S.koyangensisSCSIO 5802中candicidin生物合成基因的功能注释

ORFSizeaProposed functionHomologous Genes Identity/%bcanPAB2257biosynthesis of starter unite p-aminobenzoic acidpabC94canR1231LuxR_family_transcriptional_regulatorfscRⅠ 95canR2960LuxR_family_transcriptional_regulator fscRⅡ96canR31011LuxR_family_transcriptional_regulatorfscRⅢ95canR4970LuxR_family_transcriptional_regulator fscRⅣ97canM1458Glycosyltransferase,_MGT_family fsc M199canM2352StrS_aminotransferasefscMⅡ99canP393CytochromeP450fscP99canFE64Ferredoxin fscFE98canTE256 Type II thioesterase fscTE98canPAB1723 biosynthesis of starter unite p-aminobenzoic acidPabAB97canA1742 AMP-dependent_synthetase_and_ligase,loading module and module 1 fscA95canT1335 ABCtransporterATP-binding_protein fscT I98canT2280 ABC-2typetransporter fscTⅡ97canC10627 Beta-ketoacylsynthase,modules 5-10fscC95can B5541 Beta-ketoacylsynthase,modules 2-4fscB97can F2049Beta-ketoacylsynthase,module 21 and TEfscF98canE7774Beta-ketoacylsynthase ,module 17-20 fscE97can D9546Beta-ketoacylsynthase,modules 11-16fscD97canM3344DAD-dependent/dehydratasfsc MⅢ99
a:蛋白质大小; b:ID是与同源基因的一致性/相似性;can:推断的S.koyangensisSCSIO 5802中candicidin的生物合成基因簇;fsc:已报道的Streptomycessp.FR-008中candicidin/FR-008的生物合成基因簇。
2.3 化合物candicidin生物合成途径的推导 根据基因簇中生物合成基因的功能注释,结合candicidin的分子结构和有机化学基本生物合成原理,对candicidin的生物合成途径进行了推导。该基因簇中共编码6个PKS基因:canA、canC、canB、canF、canE、canD,共编码1个起始模块和21个延伸模块,负责聚酮骨架结构的合成和组装。
CanA包含1个起始模块(loading module)和1个延伸模块(module 1)。根据candicidin的分子结构,我们推导其聚酮骨架的组装起始于1个对氨基苯乙酮分子的装载(见图4B),而该分子的装载则是由CanA中的装载模块负责的,锚定在起始模块ACP结构域上的对氨基苯乙酮分子,作为后续骨架分子组装的起点,开始candicidin聚酮链的后续组装过程。
接下来的聚酮链组装过程大体可以分为以下几6个阶段(见图4B):①CanA编码的模块1于起始对氨基苯乙酮分子上延伸一个二碳单元;②CanB编码模块2-4,连续负责3个三碳结构单元——2-甲基丙二酸单酰辅酶A进行顺序缩合;③canC编码延伸模块5-11,这7个模块中均含有负责将β-酮基进行还原的KR和DH结构域,负责candicidin结构中7个共轭双键的组装;④canD编码延伸模块12-16,除了模块13识别三碳结构单元——2-甲基丙二酸单酰辅酶A,剩下的4个模块识别的底物则均为二碳结构单元丙二酸单酰辅酶A;⑤canD编码延伸模块17-20,这4个模块识别的底物均为二碳结构单元——丙二酸单酰辅酶A,负责催化他们之间的顺序缩合延伸;⑥canF编码延伸模块21和硫酯酶结构域,除了负责一个二碳单元的延伸外,还负责催化聚酮链上C37-OH对锚定在模块21的ACP结构域上的硫酯键进行亲和攻击,导致聚酮链环化解离,生成七烯大环内脂骨架结构。
生成的七烯大环内脂骨架结构可能在后修饰P450氧化酶CanP的催化下,将C18位的甲基氧化为羧基。此外,推责糖基转移酶CanM1、氨基转移酶CanM2和脱水酶CanM3负责C21上的糖基单元的合成和连接。经过以上生物合成步骤后,最终生成candicidin类化合物。
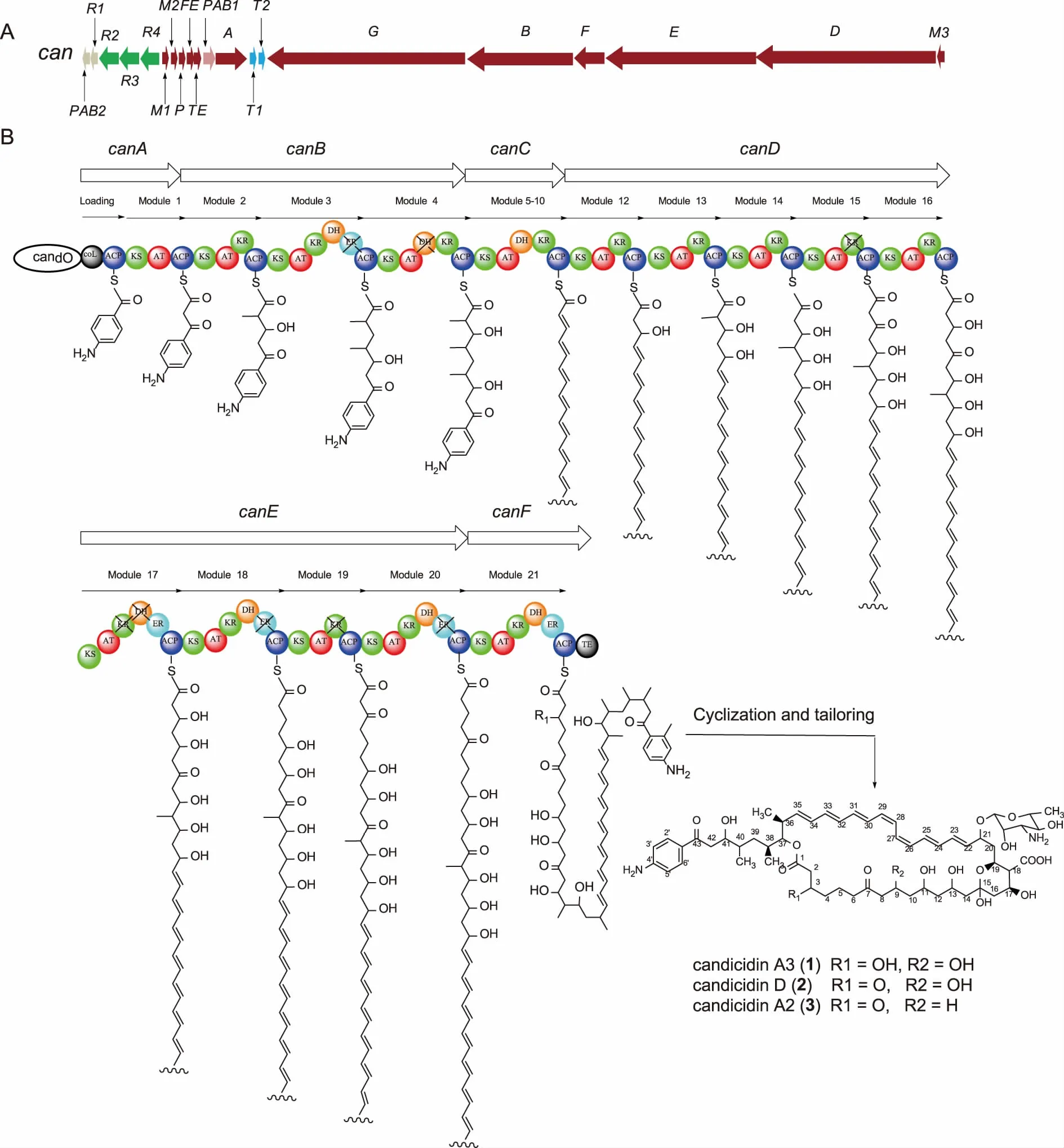
A:S.koyangensis SCSIO 5802中candicidin 的生物合成基因组织排列方式;B:S.koyangensis SCSIO 5802中candicidin聚酮骨架的组装过程。图4 candicidin的生物合成基因簇和可能生物合成途径
2.4S.koyangensisSCSIO 5802中candicidin生物合成基因簇的确认 通过对基因簇中负责聚酮骨架合成的I型PKS基因canD进行抗性替换突变,获得canD的双交换突变株△canD(命名为SCSIO 5802AC,见图5)。将突变株SCSIO 5802AC与敲掉的abyssomicins生物合成聚酮合酶基因的同框敲除(inframe)突变株5802A同步对比发酵培养,利用HPLC对发酵产物进行分析,发现5802AC菌株不产candicidin类化合物(见图6),此结果证明该基因簇确实负责candicidin类化合物的生物合成。
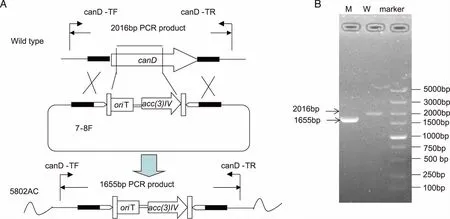
A:candD基因替换突变株的构建示意图及预测的PCR片段长度,野生型2016 bp,突变株1655bp;B:突变株candD的PCR验证图;marker:DL5000,W:以S.koyangensis SCSIO 5802野生型菌株基因组DNA为模板,M:以突变株5802AC基因组DNA为模板。图5 canD基因替换突变株的构建及验证
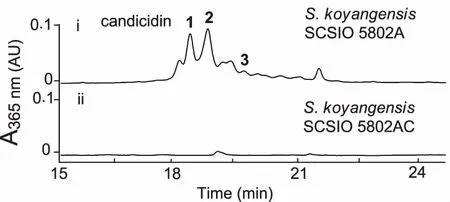
图6 基因阻断突变株SCSIO 5802AC发酵产物的HPLC检测
3 讨论
多烯大环内酯类化合物candicidin具有是一种抗真菌类的抗生素,具有除了出色的抗真菌活性外[17],还对显著的抗病毒[18]和抑制前列腺癌细胞的生长活性[19],具有广阔的临床药物开发前景。但是,candicidins类抗生素因其水溶性差、毒性高等缺点,在临床上大大限制了将其应用于全身性的真菌感染治疗,因此,各国研究者都致力于candicidin的生物合成途径和基因工程改造研究,希望通过改变其生物合成途径,获取结构类似物用于药物的开发研究。海洋放线菌具有产生多种活性显著、结构新颖复杂的次级代谢产物的潜能,本研究对来源于我国南海深海沉积物的放线菌Stretomycessp.SCSIO 5802进行定向遗传改造,构建了不生产abyssomicin类化合物的基因突变株Stretomycessp.SCSIO 5802A,阻断了主要次级代谢产物abyssomicins的生产,达到了改变菌株的代谢流以增加微量次级代谢产物的生物合成前体供应的目的,从该突变株发酵液中成功鉴定了另一类多烯大环内酯类化合物candicidin,并且鉴定了其生物合成基因簇,该基因簇与已经报道的其它菌株中基因簇具有部分差异,同源基因在蛋白水平上具有95%~98%的相似性,为candicidins类化合物的途径改造提供了信息基因资源,为通过组合生物合成技术对基因簇中的基因原件进行改造或其它多烯大环内酯类化合物的生物合成途径进行重组,获得新结构衍生物奠定了基础。
此外,利用生物信息学对海洋放线菌Stretomycessp.SCSIO 5802进行分析发现,该菌株的基因组中存在至少21个负责天然产物的生物合成的基因簇,但目前我们仅从该菌株中鉴定了abyssomicins和candicidins这两类化合物,其它生物合成基因簇还处于沉默或未激活状态,因此,下一步我们拟利用本研究中获得的candicidin的生物合成基因簇,在聚酮合酶abmB1的同框缺失突变株中继续对负责candicidin聚酮骨架合成的canD基因进行同框缺失突变,获得的突变株将会丧失生产abyssomicin和candicidin类化合物的能力,使菌株的代谢背景更为干净,在此基础上,可以通过添加强启动子激活其他基因簇或改变发酵条件,将有助于其它结构新型的天然产物的发现和鉴定。

